Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Комплексная диаграмма состоянияСодержание книги Поиск на нашем сайте
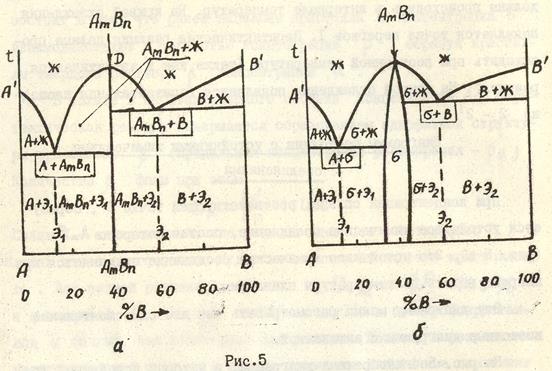
Для многих реальных систем диаграммы состояния включают в себя образование твердых растворов, смесей, промежуточных фаз, а также превращений в твердом состоянии. Поэтому целесообразно рассмотреть более сложную диаграмму, состоящую из элементарных диаграмм состояний, рассмотренных ранее. Пример такой диаграммы изображен на рис. 10. В жидком состоянии компоненты А и В неограниченно растворимы друг в друге. Разбор следует начать с превращений, которые имеют компоненты, образующие систему. Компонент А кристаллизуется при температуре Компонент В кристаллизуется при температуре Максимум на диаграмме состояний при температуре t8 указывает на образование Затем следует определить фазы, которые могут быть образованы в результате перитектической и перитектоидной реакций. В нашем случае в результате перитектических реакций происходит образование соответственно фаз:
Определив однофазные состояния, следует заполнить двухфазные области, пользуясь правилом отрезков. Для этого, например, для сплава I при температуре Дня построения структурной диаграммы следует учесть в ней эвтектические, эвтектоидные превращения и переменную растворимость в твердом состоянии. В нашем случае на линиях aec и Твердый раствор При концентрации Соответственно в доэвтектических сплавах концентрация Далее следует рассмотреть линии переменной растворимости. Линия bn указывает на переменную растворимость компонента В в твердом растворе В сплавах концентрации b'd'. (сплав I) из По линии Заполнение диаграммы ниже температуры эвтектоидного превращения Построение кривой охлаждения для сплава I проводится в координатах температура - время. Пересечение сплава I с наклонной линией t1р на диаграмме в точке 9 указывает начало кристаллизация Для построения схемы кристаллизации сплава делаются условные обозначения фаз и структурных составляющих. Например, в сплаве I кристаллы Фаза
Для выполнения домашнего задания студенту ведается "слепая" диаграмма состояния без указания фаз и структур. В соответствии с методическими указаниями необходимо: 1. Определить однофазные состояния - твердые растворы и химические соединения. 2. Заполнить двухфазные области диаграммы и тем самым получить фазовую диаграмму состояния. 3. Учитывая эвтектические, эвтектоидные превращения и переменную растворимость в твердом состоянии указать структурное строение сплавов. 4. Построить треугольника кристаллизации Таммана. 5. Для заданного сплава построить термограмму (кривую охлаждения), на которой указать превращения, которые происходят в сплаве. Применить правило фаз (закон Гиббса). 6. Обозначив фазы и структурные составляющие, построить схему кристаллизации для заданного сплава. 7. В соответствии с правилом отрезков (рычага) определить концентрации фаз при заданной температуре для данного сплава. 8. По правилу отрезков определить количественное соотношение этих фаз. Работа выполняется мягким карандашом, так как в процессе работы и изучения диаграммы возможны изменения, связанные с неправильным заполнением. ЛИТЕРАТУРА
1. Гуляев А.П. Металловедение.М.:Металлургия,1966,544 с.
2. Лахтин Ю.М. Металловедение и термическая обработка. М. Металлургия, 1983,360 с.
|
||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 312; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.156 (0.009 с.) |

 , пря температурах
, пря температурах  он имеет полиморфные превращения. Компонент В растворяется в компоненте А, образуя твердые растворы
он имеет полиморфные превращения. Компонент В растворяется в компоненте А, образуя твердые растворы  .
. . Полиморфные превращения в нем происходят при температурах t6 и t7. Компонент А растворяется в компоненте В и образует твердые растворы
. Полиморфные превращения в нем происходят при температурах t6 и t7. Компонент А растворяется в компоненте В и образует твердые растворы  и
и 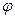 .
.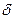 - твердого раствора на базе соединения АкBs. Линии 8f и 8а'1 показывают на то, что фаза
- твердого раствора на базе соединения АкBs. Линии 8f и 8а'1 показывают на то, что фаза 


 провести горизонталь до ближайших линий этой двухфазной области. Точки пересечения коноды с ближайшими линиями диаграммы состояния К и m указывают на то, что в данной двухфазной области будут фазы
провести горизонталь до ближайших линий этой двухфазной области. Точки пересечения коноды с ближайшими линиями диаграммы состояния К и m указывают на то, что в данной двухфазной области будут фазы  и Ж. Пользуясь правилом концентраций можно определить концентрации этих фаз. Для этого точки К и m следует спроектировать на линию концентраций. Концентрация
и Ж. Пользуясь правилом концентраций можно определить концентрации этих фаз. Для этого точки К и m следует спроектировать на линию концентраций. Концентрация  происходят эвтектические превращения. В первом случае жидкость распадается с образованием эвтектики Э1 cстоящей из
происходят эвтектические превращения. В первом случае жидкость распадается с образованием эвтектики Э1 cстоящей из  и
и  распадается с образованием эвтектоида Э3, состоящего из
распадается с образованием эвтектоида Э3, состоящего из 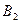 . Так как в состав Э2 входит твердый раствор
. Так как в состав Э2 входит твердый раствор  будет состоять из
будет состоять из  сплавы будут состоять полностью из Э1,
сплавы будут состоять полностью из Э1, 
 до эвтектики Э2 кристаллизуются крупные кристаллы
до эвтектики Э2 кристаллизуются крупные кристаллы  , а. в заэвтектических сплавах
, а. в заэвтектических сплавах  — твердого раствора
— твердого раствора  растворимость компонента В определяется отрезком Аb', а при температуре t0 отрезком Аn. В результате из
растворимость компонента В определяется отрезком Аb', а при температуре t0 отрезком Аn. В результате из  .
. по аналогии из твердого раствора
по аналогии из твердого раствора  , В заэвтектических сплавах
, В заэвтектических сплавах  из крупных избыточных кристаллов
из крупных избыточных кристаллов  в сплавах концентрации
в сплавах концентрации 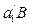 производится с учетом эвтектодного превращения - распада твердого раствора
производится с учетом эвтектодного превращения - распада твердого раствора  , перейдет в
, перейдет в  состоят из
состоят из 
 - из Э3 +
- из Э3 +  - из B+ Э3.
- из B+ Э3. -темные. Вторичные кристаллы
-темные. Вторичные кристаллы