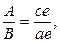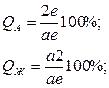Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Правило отрезков для двухфазной областиСодержание книги
Поиск на нашем сайте Основные положения
По сравнению с чистыми металлами сплавы обладают лучшими механическими и технологическими свойствами. Сплавы в основном получают сплавлением различных металлов или металлов с металлоидами. Однородный жидкий раствор при кристаллизации образует следующие типы сплавов: механические смеси, химические соединения, твердые растворы и промежуточные фазы. В теории сплавов широко применяют такие понятия как компонент и фаза. Дадим определение этим понятиям. Компонентами называются химические элементы или их устойчивые соединения, наименьшее число которых достаточно для образования всех фаз системы. Фаза - это структурно-однородная часть системы, отделенная от других частей поверхностью раздела, при переходе через которую резко изменяются свойства. Сплавы могут быть однофазными (гомогенными) и многофазными (гетерогенными), Диаграммы состояния являются теоретической основой создания сплавов и показывают графически фазовое и структурное состояние сплавов в зависимости от температуры и концентрации. Диаграммы, описывающие переход из жидкого состояния в твердое, называются первичными. Диаграммы, отображающие перекристаллизацию в твердом состоянии (переменная растворимость, полиморфное превращение), называются вторичными. Диаграммы состояния обычно строят экспериментально. Однако в настоящее время разработаны методы их расчета по термодинамическим функциям с применением ЭВМ. При построении диаграмм состояния по оси ординат откладывается температура, по оси абсцисс - концентрация компонентов (рис. I). Левая крайняя вертикаль соответствует 100%-ному содержанию компонента А (0$ В), а правая - 100$-ному содержанию компонента В (0$ А). Процентное содержание компонента В в сплавах возрастает слева направо, а компонента А, наоборот, справа налево. Например, сплав I имеет концентрацию 22% В и 78% А, сплавII – 50% В и 50$ А, сплав III – 78%В и 22% А (см.рис.I). Для построения диаграммы состояния берут серию сплавов с различным содержанием компонентов. Для каждого сплава строят термограмму - (кривую охлаждения)с помощью метода термического анализа. Для этого исследуемые сплавы нагревают в печи до жидкого состояния, а затем медленно охлаждают. По данным изменений температуры во времени строят кривые охлаждения. По перегибам на кривых, либо температурным остановкам (горизонтальным площадкам) определяются температуры фазовых превращений - критические точки I, 2,..... 10. Полученные значения критических точек переносят на вертикальные линии соответствующих сплавов на диаграмме температура - концентрация. Соединив точки начала и конца кристаллизации, получают линии фазовых превращений - диаграмму состояния. На рис. I показаны кривые охлаждения для чистых компонентов А и В, а также для сплавов I, II, III.
Правило фаз. Закон Гиббса
Равновесное фазовое состояние сплава при атмосферном давлении определяется температурой (внешним фактором) и концентрацией (внутренним фактором системы). Степень свободы системы - С - показывает число внешних и внутренних факторов - В, которые можно изменить без нарушения числа фаз, находящихся в равновесии. В общем случае число степеней свободы зависит от числа компонентов - К, числа фаз - Ф и определяется выражением: С = К - Ф + В. Для каждого конкретного сплава внутренний фактор - число компонентов К - величина постоянная, т.е. этот фактор в уравнении не учитывается. Остается лишь внешний изменяющийся фактор - температура. Поэтому в данном случае В = I и уравнение приобретает вид С = К - Ф + I. Для чистых компонентов А и В (см.рис. I) степень свободы при температуре кристаллизации равна нулю С = К – Ф + 1 = 1 – 2 + 1 = 0, и процесс кристаллизации должен проходить обязательно при постоянной температуре (горизонтальные площадки I - 2 и 9 - 10). Это нонвариантная система. В сплаве II в интервале температур 5-6 будут присутствовать две фазы (жидкая и твердый раствор
Компонентов эвтектикой
На практике чаще компоненты образуют ограниченные твердые растворы. В данном случае (рис. 3) компонент B растворяется до 20% в компоненте А, образуя твердый раствор С = К - Ф + 1 = 2 - 3 + 1 = 0. Значит, эвтектическая реакция ведет при постоянной температуре. Доэвтектические сплавы имеют структуру первичных крупных зерен
Диаграммы состояния о ограниченной растворимостью компонентов с перитектикой (рис.4)
В данной системе, как г в предыдущей, компоненты А и Вограниченно растворяются друг в друге. Компонент В, растворяясь в А, образует твердый раствор В сплаве II перитектического состава концентрации dd’ перитектическая реакция завершается образованием однофазной структуры кристаллов
Сплав II - единственный, где реакция идет без остатка фаз. В сплавах левее этого сплава будет избыточное количество кристаллов Рассмотрение кристаллизации сплава III (рис. 4 б) показывает, что выделившиеся в интервале температур 3 - 4 кристаллы
Применим правило фаз для сплава I.
1. При температуре t1 он двухфазен (
С = К – Ф + 1 = 2 – 2 + 1 = 1
2. При температуре перитектического превращения присутствуют три фазы: жидкость, С = К – Ф + 1 = 2 – 3 + 1 = 0
Из уравнений видно, что в первом случае кристаллизация должна происходить в интервале температур. На кривой охлаждения появляется точка перегиба I. Перитектическая реакция должна происходить при - постоянной температуре (также как и эвтектическая реакция). На кривой охлаждения появляется горизонтальная площадка 2 - 2' Полиморфные превращения Полиморфизм (аллотропия)- это способность компонентов с изменением температуры менять свою кристаллическую решетку. Перекристаллизация, связанная с изменением кристаллических решеток компонентов, безусловно сказывается на процессе кристаллизации сплавов, а значит и на виде диаграмм состояний. В принципе тип диаграммы состояния при вторичной кристаллизации будет зависеть от различия свойств компонентов после полиморфного превращения. Если после перекристаллизации свойства компонентов будут близки, то возможно неограниченная растворимость. Если же свойства у компонентов различные, то возможны образование ограниченной растворимости компонентов друг в друге, распад твердого раствора с образованием смеси, образование устойчивого я неустойчивого химического соединения и т.д. На рис. 8 изображены различные варианты диаграмм состояния I-УI, в которых при кристаллизации из жидкого состояния высокотемпературные модификации компонентов близки по своим свойствам и дают неограниченную растворимость друг в друге с образованием твердого раствора
В системе при температуре В системе I после полиморфного превращения компонентов В системе П после изменения кристаллических решеток у компонентов С и D их свойства оказались различными. Они не растворяются друг в друге. Твердый раствор В системе III компоненты Е и Р после полиморфного превращения при температуре В системах IУ и У на линиях pdb происходят паритектоидные превращения соответственно с образованием твердого В диаграмме УI также образуется химическое соединение
Распад твердого раствора с образованием промежуточной фазы. Такую диаграмму образует железо-хром и др. (рис.9). Как видно из рисунка, твердый раствор
ЛИТЕРАТУРА
1. Гуляев А.П. Металловедение.М.:Металлургия,1966,544 с.
2. Лахтин Ю.М. Металловедение и термическая обработка. М. Металлургия, 1983,360 с.
Основные положения
По сравнению с чистыми металлами сплавы обладают лучшими механическими и технологическими свойствами. Сплавы в основном получают сплавлением различных металлов или металлов с металлоидами. Однородный жидкий раствор при кристаллизации образует следующие типы сплавов: механические смеси, химические соединения, твердые растворы и промежуточные фазы. В теории сплавов широко применяют такие понятия как компонент и фаза. Дадим определение этим понятиям. Компонентами называются химические элементы или их устойчивые соединения, наименьшее число которых достаточно для образования всех фаз системы. Фаза - это структурно-однородная часть системы, отделенная от других частей поверхностью раздела, при переходе через которую резко изменяются свойства. Сплавы могут быть однофазными (гомогенными) и многофазными (гетерогенными), Диаграммы состояния являются теоретической основой создания сплавов и показывают графически фазовое и структурное состояние сплавов в зависимости от температуры и концентрации. Диаграммы, описывающие переход из жидкого состояния в твердое, называются первичными. Диаграммы, отображающие перекристаллизацию в твердом состоянии (переменная растворимость, полиморфное превращение), называются вторичными. Диаграммы состояния обычно строят экспериментально. Однако в настоящее время разработаны методы их расчета по термодинамическим функциям с применением ЭВМ. При построении диаграмм состояния по оси ординат откладывается температура, по оси абсцисс - концентрация компонентов (рис. I). Левая крайняя вертикаль соответствует 100%-ному содержанию компонента А (0$ В), а правая - 100$-ному содержанию компонента В (0$ А). Процентное содержание компонента В в сплавах возрастает слева направо, а компонента А, наоборот, справа налево. Например, сплав I имеет концентрацию 22% В и 78% А, сплавII – 50% В и 50$ А, сплав III – 78%В и 22% А (см.рис.I). Для построения диаграммы состояния берут серию сплавов с различным содержанием компонентов. Для каждого сплава строят термограмму - (кривую охлаждения)с помощью метода термического анализа. Для этого исследуемые сплавы нагревают в печи до жидкого состояния, а затем медленно охлаждают. По данным изменений температуры во времени строят кривые охлаждения. По перегибам на кривых, либо температурным остановкам (горизонтальным площадкам) определяются температуры фазовых превращений - критические точки I, 2,..... 10. Полученные значения критических точек переносят на вертикальные линии соответствующих сплавов на диаграмме температура - концентрация. Соединив точки начала и конца кристаллизации, получают линии фазовых превращений - диаграмму состояния. На рис. I показаны кривые охлаждения для чистых компонентов А и В, а также для сплавов I, II, III.
Правило фаз. Закон Гиббса
Равновесное фазовое состояние сплава при атмосферном давлении определяется температурой (внешним фактором) и концентрацией (внутренним фактором системы). Степень свободы системы - С - показывает число внешних и внутренних факторов - В, которые можно изменить без нарушения числа фаз, находящихся в равновесии. В общем случае число степеней свободы зависит от числа компонентов - К, числа фаз - Ф и определяется выражением: С = К - Ф + В. Для каждого конкретного сплава внутренний фактор - число компонентов К - величина постоянная, т.е. этот фактор в уравнении не учитывается. Остается лишь внешний изменяющийся фактор - температура. Поэтому в данном случае В = I и уравнение приобретает вид С = К - Ф + I. Для чистых компонентов А и В (см.рис. I) степень свободы при температуре кристаллизации равна нулю С = К – Ф + 1 = 1 – 2 + 1 = 0, и процесс кристаллизации должен проходить обязательно при постоянной температуре (горизонтальные площадки I - 2 и 9 - 10). Это нонвариантная система. В сплаве II в интервале температур 5-6 будут присутствовать две фазы (жидкая и твердый раствор
Правило отрезков для двухфазной области
Во - первых - это правило позволяет определить концентрации (химический состав) фаз исследуемого сплава при заданной температуре. Для этого необходимо провести коноду (изотерму) до пересечения с линиями диаграммы, ограничивающими данную двухфазную область. Проекции точек пересечения на оськонцентраций (ось абсцисс) показывают концентрацию фаз. Например, для сплава II при температуре Проекция точки а (т. Проекция точки С (т. Это правило позволяет также определить количество (массу) фаз отношением противоположного отрезка ко всему отрезку - коноде. Так, если для сплава II (см. рис. I) отрезок
Таким образом, количество жидкой фазы
Диаграммы состояний с образованием механической смеси компонентов с эвтектикой
На рис. 2а показана диаграмма состояний сплавов, где компоненты полностью не растворяются в жидком состоянии и образуют смесь. Сплав II является эвтектическим (наиболее легкоплавким). Он кристаллизуется при самой низкой температуре Эвтектическое превращение сплава II протекает изотермически на участке 3 - 3' при постоянной концентрации фаз, так при кристаллизации существует три фазы: компонент А, В и жидкость. Число степеней свободы С = К - Ф + 1 = 2 – 34 - 1 = 0. Для эвтектики характерно определенное количественное соотношение компонентов (фаз), которое сохраняется во всех сплавах данной системы. Так для данного случая
Следовательно, эвтектикой называется мелкодисперсная смесь двух компонентов (фаз), которая кристаллизуется из жидкости определенного химического состава при постоянной самой низкой для данной системы температуре. В доэвтектическом сплаве I ниже линии А'е в интервале температур 1-2 из жидкости выделяются первичные крупные кристаллы компонента А, а в заэвтектическом сплаве III в температурном интервале 4 - 5 - первичные крупные кристаллы компонента В. При достижении эвтектической температуры во всех сплавах жидкость распадается с образованием мелкодисперсной эвтектической смеем компонентов А и В. Первичные крупные зерна компонентов А, В и эвтектика являются структурными составляющими сплавов. Структуры, полностью, эвтектического, доэвтектического и заэвтектического сплавов показаны на рис. 26. Количество структурных составляющих в сплаве может быть определено при помощи треугольника Таммана, (рис. 2 в), Вертикали в треугольнике указывают количество эвтектики. Высота треугольника соответствует 100%-ной эвтектике. Количество эвтектики будет уменьшаться с удалением от эвтектического сплава по закону прямой линии от 100 до 0%. Если для сплава I количество эвтектики по треугольнику будет определяться отрезками 2 - 2', то количество избыточных кристаллов компонента А - отрезком 2' - 2". Так как количество эвтектика пропорционально времени ее кристаллизации, отрезок 2 – 2’ треугольника соответствует отрезку 2 - 2' на кривой охлаждения сплава I при кристаллизации эвтектики. Количество структурных составляющих можно также определить по правилу отрезков. Для сплава.I
Рассмотренный тип диаграммы состояния имеют системы: свинец-сурьма, олово-цинк и др.
|
||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 423; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.156 (0.013 с.) |

 В данном случае компоненты близки по свойствам и неограниченно растворимы в жидком и твердом состоянии, образуя непрерывный ряд твердых растворов. Образуется диаграмма состояния, имеющая вид "чечевицы" или "двояковыпуклой линзы". Линия начала кристаллизации (А' и В’) называется линией ликвидус (ликвидус - жидкий). Выше этой линии сплавы находятся в жидком состоянии. Линия конца кристаллизации (В’ с а') называется линией солидус (солидус - твердый) В ниже ее сплавы находятся в твердом состоянии. Экспериментально построенные кривые охлаждения и диаграммы состояния проверяют по правилу фаз.
В данном случае компоненты близки по свойствам и неограниченно растворимы в жидком и твердом состоянии, образуя непрерывный ряд твердых растворов. Образуется диаграмма состояния, имеющая вид "чечевицы" или "двояковыпуклой линзы". Линия начала кристаллизации (А' и В’) называется линией ликвидус (ликвидус - жидкий). Выше этой линии сплавы находятся в жидком состоянии. Линия конца кристаллизации (В’ с а') называется линией солидус (солидус - твердый) В ниже ее сплавы находятся в твердом состоянии. Экспериментально построенные кривые охлаждения и диаграммы состояния проверяют по правилу фаз. ). Число степеней свободы С = К - Ф + 1 = 2 - 2 + 1 = 1. Это моновариантная система, т.е. кристаллизация сплава идет не при постоянной температуре, а в условиях непрерывного охлаждения в интервале температур. На термограмме в точках 5 и 6 наблюдается перегиб кривой, а горизонтальная площадка отсутствует.
). Число степеней свободы С = К - Ф + 1 = 2 - 2 + 1 = 1. Это моновариантная система, т.е. кристаллизация сплава идет не при постоянной температуре, а в условиях непрерывного охлаждения в интервале температур. На термограмме в точках 5 и 6 наблюдается перегиб кривой, а горизонтальная площадка отсутствует.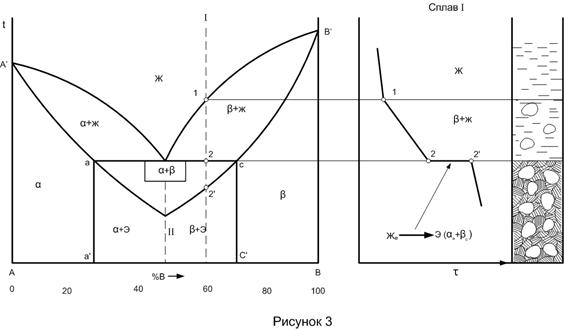
 . Предельное растворение при этом ограничивается линией сольвус СС’ (30%А). Рассмотренные сплавы имеют однофазное строение. В интервале концентраций a' - С’ твердые растворы
. Предельное растворение при этом ограничивается линией сольвус СС’ (30%А). Рассмотренные сплавы имеют однофазное строение. В интервале концентраций a' - С’ твердые растворы 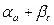 с предельной концентрацией
с предельной концентрацией  (т. а) и
(т. а) и  (т. С). На линии aec при температуре
(т. С). На линии aec при температуре  происходит эвтектическое превращение
происходит эвтектическое превращение  . Применим правило фаз для эвтектического сплава II при температуре tЭ
. Применим правило фаз для эвтектического сплава II при температуре tЭ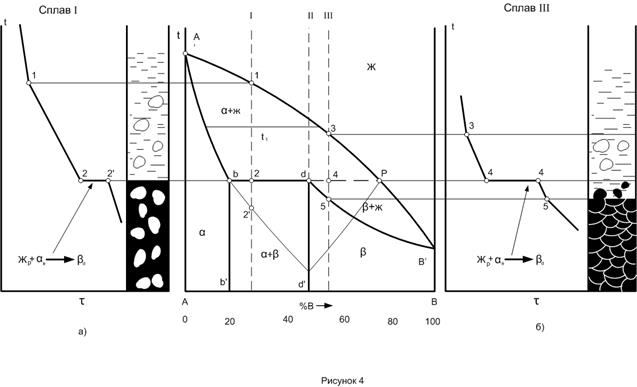
 на линии bdp происходит перитектическая реакция. Физическая сущность этого превращения состоит в том, что ранее выпавшие кристаллы
на линии bdp происходит перитектическая реакция. Физическая сущность этого превращения состоит в том, что ранее выпавшие кристаллы 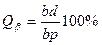
 , а в сплаве I
, а в сплаве I  , т.е. в сплаве I кристаллов
, т.е. в сплаве I кристаллов 


 происходят полиморфные превращения в компонентах А, С, Е, К, М, Р. Например, в I системе компонент А до температуры
происходят полиморфные превращения в компонентах А, С, Е, К, М, Р. Например, в I системе компонент А до температуры  . При температуре
. При температуре  в
в 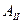 . Компоненты В, D, F, L, N изменяют кристаллическую решетку при температуре
. Компоненты В, D, F, L, N изменяют кристаллическую решетку при температуре 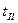 , компонент R - при температурах t2 и
, компонент R - при температурах t2 и  .
. свойства низкотемпературных модификаций компонентов
свойства низкотемпературных модификаций компонентов  и
и 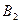 также близки и они дают неограниченную растворимость -
также близки и они дают неограниченную растворимость - 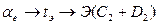 . Эвтектоидная смесь более дисперсная (мелкая), чем эвтектическая, подученная в результате распада жидкости.
. Эвтектоидная смесь более дисперсная (мелкая), чем эвтектическая, подученная в результате распада жидкости.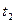 . ограниченно растворяются друг в друге, образуя твердые растворы
. ограниченно растворяются друг в друге, образуя твердые растворы  . В интервале концентраций ac твердый раствор
. В интервале концентраций ac твердый раствор 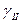 .
. и неустойчивого химического соединения
и неустойчивого химического соединения  по реакции
по реакции  В системе IУ по линии bn изменяется растворимость компонентов К и L с выделением из
В системе IУ по линии bn изменяется растворимость компонентов К и L с выделением из 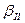 .
. , а на линиях aec и
, а на линиях aec и  происходят эвтектоидные превращения.
происходят эвтектоидные превращения. В системе У1 компонент Р претерпевает одно полиморфное превращение при температуре
В системе У1 компонент Р претерпевает одно полиморфное превращение при температуре  близок по строению к свойствам к компоненту о решеткой
близок по строению к свойствам к компоненту о решеткой  и они неограниченно растворяются друг в друге, образуя твердый раствор
и они неограниченно растворяются друг в друге, образуя твердый раствор 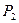 и
и  ограниченные растворы
ограниченные растворы 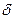 - фазу. Она представляет собой твердый раствор на базе химического соединения
- фазу. Она представляет собой твердый раствор на базе химического соединения  , который существует в интервале концентраций ab.
, который существует в интервале концентраций ab.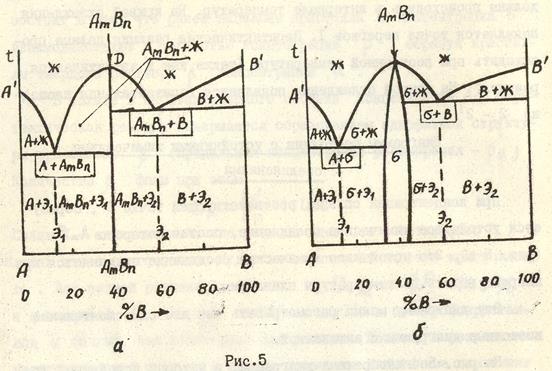
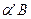 .
. ) покажет концентрацию жидкой фазы, т.е. в жидкости количество компонента В будет определяться отрезком А
) покажет концентрацию жидкой фазы, т.е. в жидкости количество компонента В будет определяться отрезком А  (в миллиметрах) принять за общее количество – 100% (
(в миллиметрах) принять за общее количество – 100% (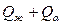 ), то количество фаз в сплаве будет определяться соотношениями:
), то количество фаз в сплаве будет определяться соотношениями: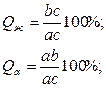
 пропорционально отрезку bc, прилегающему к линии солидус, а количество твердой фазы – отрезку ab, прилегающему к линии ликвидус.
пропорционально отрезку bc, прилегающему к линии солидус, а количество твердой фазы – отрезку ab, прилегающему к линии ликвидус.