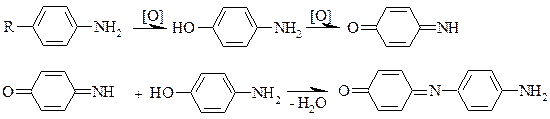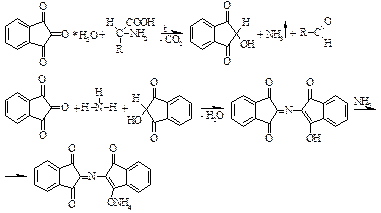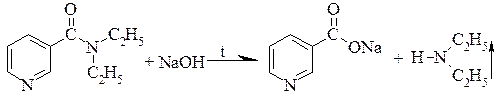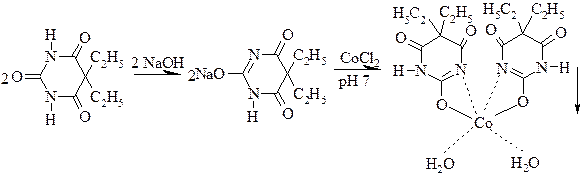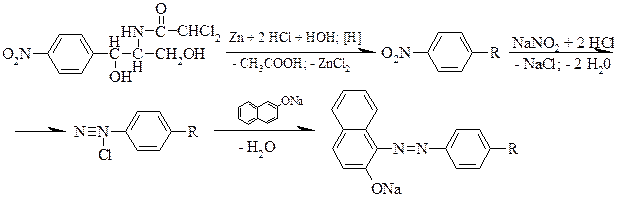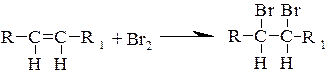Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Этиловый (характерный запах)Содержание книги
Поиск на нашем сайте
Информационный блок
Функциональные группы
5.1.1. Содержащие кислород:
а) гидроксильная группа (спиртовый и фенольный гидроксилы):
б) альдегидная группа:
в) кетонная группа:
г) гидроксиацетильная группа (α-кетольная группа):
д) карбоксильная группа:
е) сложноэфирная группа и лактонная группа:
ж) простая эфирная группа:
5.1.2. Содержащие азот: а) первичная ароматическая и алифатическая аминогруппы:
б) вторичная аминогруппа:
в) третичная аминогруппа:
г) амидная группа:
д) азометиновая группа:
е) гидразидная группа:
ж) нитрогруппа:
5.1.3. Содержащие серу: а) тиольная группа (сульфгидрильная группа):
б) сульфамидная группа:
в) органически связанная сера:
5.1.4. Содержащие галоген: а) органически связанный галоген:
5.2. Структурные фрагменты: 5.2.1. Двойная связь:
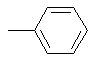
5.2.2. Фенильный радикал:
Лекарственные вещества, содержащие спиртовый гидроксил:
6.1. Реакция образования сложных эфиров Спирты в присутствии кислоты серной концентрированной образуют с органическими кислотами сложные эфиры. Низкомолекулярные эфиры имеют характерный запах, высокомолекулярные – определенную температуру плавления:
Спирт Этилацетат Этиловый (характерный запах)
Метилтестостерон метилтестостерона ацетат (температура плавления 173 – 176 о С)
Реакции окисления Спирты окисляются до альдегидов при добавлении окислителей (калия дихромата, калия гексацианоферрата (III), реактива Фреде, иода). Спирт этиловый окисляется иодом в щелочной среде при нагревании до трийодацетальдегида, который разрушается до йодоформа и соли кислоты муравьиной (первичные спирты):

6.3. Реакции образования комплексных соединений (многоатомные спирты)
Многоатомные спирты (глицерин и др.) образуют с раствором меди сульфатом в щелочной среде комплексные соединения синего цвета:
Глицерин осадок голубого интенсивно-синяя окраска раствора Цвета
Идентификация фенольного гидроксила Реакция с железа (III) хлоридом Фенолы в нейтральной среде в водных или спиртовых растворах образуют соли с железа (III) хлоридом, окрашенные в сине-фиолетовый (одноатомные), синий (двухатомные: резорцин), зеленый (пирокатехин) или красный (флороглюцин). Это объясняется образованием катионов С6Н5ОFе2+, С6Н5ОFе+ и др.
7.2. Реакции окисления (индофеноловая проба) а). Реакция с хлорамином. При взаимодействии фенолов с хлорамином и аммиаком образуется индофенол, окрашенный в различные цвета: сине-зеленый (фенол), буровато-желтый (резорцин), красно-бурый (ПАС-натрия) и др.
Реакции конденсации с альдегидам. Фенолы в присутствии кислоты серной концентрированной конденсируются с альдегидами с образованием бесцветного вещества. Затем кислота серная концентрированная дегидратирует продукт конденсации с образованием вещества хиноидной структуры. Появляется красное окрашивание.
Сочетание с солями диазония
Фенолы в щелочной и аммиачной среде взаимодействуют с солями диазония с образованием азокрасителя (красное окрашивание):
Азокраситель (красное окрашивание)
Реакции замещения (с бромной водой и азотной кислотой Реакции основаны на способности фенолов бромироваться и нитроваться за счет замещения подвижного атома водорода в орто- и пара-положениях. Бромпроизводные выпадают в осадок белого цвета, а нитропроизводные окрашены в желтый цвет.
Резорцин белый осадок
Желтое окрашивание
Идентификация альдегидной группы Красный осадок
в ). реакция с реактивом Несслера:
Черный осадок Реакции конденсации а). Альдегиды в среде кислоты серной концентрированной конденсируются с фенолами (см. методику 5.5.3), образуются окрашенные хиноны. Ниже приводится уравнение химической реакции с хромотроповой кислотой (реактив на альдегиды). Появляется фиолетовое окрашивание:
б). Кроме фенолов с альдегидами конденсируются первичные ароматические амины (образуются основания Шиффа) и гидразины (в виде осадка или окрашенного продукта). Тип реакции – нуклеофильное замещение:
Идентификация кето-группы.
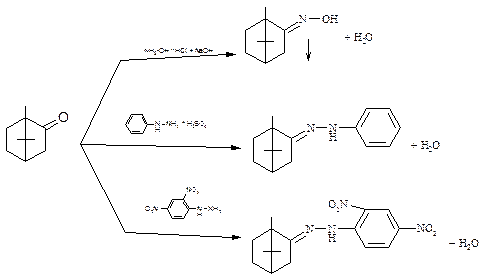
Кислота ацетилсалициловая
Кислота уксусная
Кислота салициловая (белый осадок)
Фиолетовое окрашивание Гидроксамовая проба Реакция основана на щелочном гидролизе сложного эфира. При гидролизе в щелочной среде в присутствии гидроксиламина гидрохлорида образуются гидроксамовые кислоты, которые с солями Fe (III) дают гидроксаматы железа красного или красно-фиолетового цвета. Гидроксаматы меди (II) – осадки зеленого цвета.
Гидроксиламина гидрохлорид
Гидроксамат железа (III)
Гидроксамат железа (III)
Обнаружение лактонов
Димедрол
Реакции окисления Первичные ароматические амины легко окисляются даже кислородом воздуха, образуя окрашенные продукты окисления. В качестве окислителей используются также хлорная известь, хлорамин, перекись водорода, железа (III) хлорид, калия дихромат и др.:
Нингидриновая проба Первичные алифатические амины окисляются нингидрином при нагревании:
Щелочной гидролиз Лекарственные препараты, содержащие амидную группу R-CO-NH2 (никотинамид) и N-замещенную амидную группу R-CO-NH-R1 (парацетамол, фтивазид, фталазол, барбитураты, пуриновые алкалоиды, диэтиламид никотиновой кислоты и др.) при нагревании в щелочной среде гидролизуются с образованием аммиака или аминов и соли кислот:
19.2. Реакция образования комплексных солей с металлами Соединения, содержащие амидную группу, с солями тяжелых металлов (COCl2, CuSO4) образуют окрашенные в различные цвета осадки комплексных солей.
Реакция восстановления
Препараты, содержащие нитрогруппу (левомицетин и др.), идентифицируются с помощью реакции восстановления до аминогруппы, затем проводят реакцию образования азокрасителя:
Реакция минерализации Вещества, имеющие сульфамидную группу, минерализуются кипячением в кислоте азотной концентрированной до кислоты серной, которую обнаруживают по выпадению белого осадка после добавления раствора хлорида бария:
Двойную связь Лекарственные вещества, содержащие двойную связь, способны присоединять галогены:
Информационный блок
Функциональные группы
5.1.1. Содержащие кислород:
а) гидроксильная группа (спиртовый и фенольный гидроксилы):
б) альдегидная группа:
в) кетонная группа:
г) гидроксиацетильная группа (α-кетольная группа):
д) карбоксильная группа:
е) сложноэфирная группа и лактонная группа:
ж) простая эфирная группа:
5.1.2. Содержащие азот: а) первичная ароматическая и алифатическая аминогруппы:
б) вторичная аминогруппа:
в) третичная аминогруппа:
г) амидная группа:
д) азометиновая группа:
е) гидразидная группа:
ж) нитрогруппа:
5.1.3. Содержащие серу: а) тиольная группа (сульфгидрильная группа):
б) сульфамидная группа:
в) органически связанная сера:
5.1.4. Содержащие галоген: а) органически связанный галоген:
5.2. Структурные фрагменты: 5.2.1. Двойная связь:
5.2.2. Фенильный радикал:
Лекарственные вещества, содержащие спиртовый гидроксил:
6.1. Реакция образования сложных эфиров Спирты в присутствии кислоты серной концентрированной образуют с органическими кислотами сложные эфиры. Низкомолекулярные эфиры имеют характерный запах, высокомолекулярные – определенную температуру плавления:
Спирт Этилацетат этиловый (характерный запах)
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 576; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.177.116 (0.007 с.) |

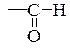


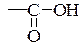

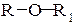

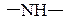




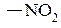

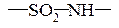
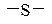


 6. Идентификация спиртового гидроксила
6. Идентификация спиртового гидроксила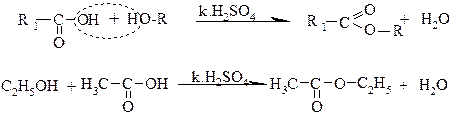



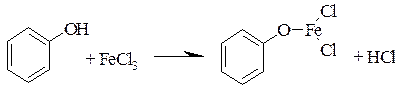
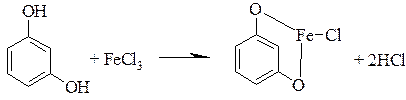
 б). Нитрозореакция Либермана. Окрашенный продукт (красный, зеленый, красно-коричневый) образуют фенолы, у которых в орто- и пара-положениях нет заместителей.
б). Нитрозореакция Либермана. Окрашенный продукт (красный, зеленый, красно-коричневый) образуют фенолы, у которых в орто- и пара-положениях нет заместителей.
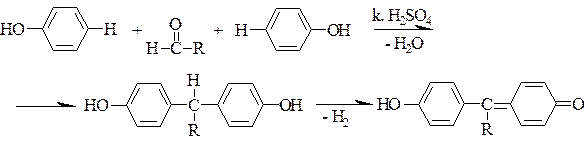

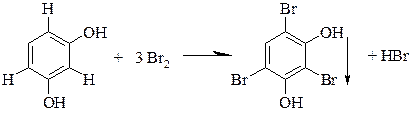
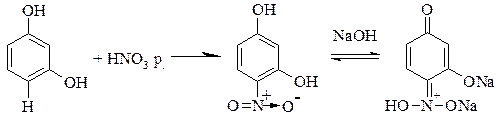

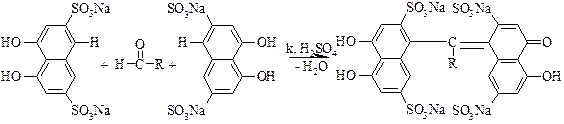
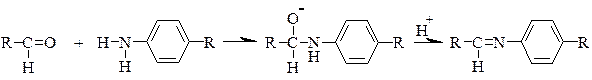
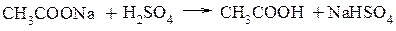


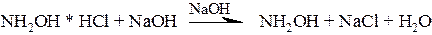
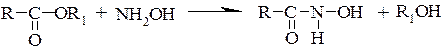
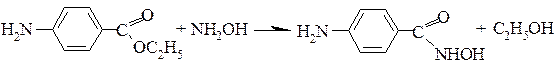
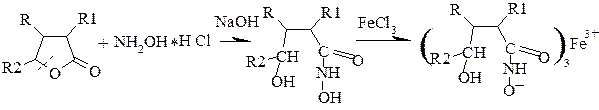 Лактонная группа – это внутренний сложный эфир. Лактонную группу можно определить с помощью гидроксамовой пробы:
Лактонная группа – это внутренний сложный эфир. Лактонную группу можно определить с помощью гидроксамовой пробы: