
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Цитологические основы универсальности законов наследованияСодержание книги
Поиск на нашем сайте
Цитологические основы универсальности законов наследования Материальная в информационная преемственность между поколениями организмов, размножающихся половым путем, осуществляется в процессе оплодотворения слиянием мужской и женской половах клеток. Наследственная информация в эукариотическпх клетках локализована в хромосомах ядра. Хромосомы - материальные носители наследственности. Биологическое значение хромосом заключается в том, что они обеспечивают следующие процессы: 1. хранение наследственной информации 2. создание в поддержание клеточной организации благодаря взаимодействию с другими клеточными механизмами 3. регуляцию считывания наследственной информации 4. самоудвоение генетического материала и передачу eго от материнской клетки к дочерней. Строение и химический состав хромосом одинаковы для растительных и животных организмов, что свидетельствует о единстве происхождения всех форм жизни на Земле. Химический состав и структура хромосом.
Основной химический компонент хромосом - двойная спираль молекулы ДНК. Выполнение хромосомой отдельных функций приурочено к фазам митотического цикла, что сопровождается изменением ее структуры. Различают митотическую в интерфазную формы структурной организации хромовом (см. рис. 1). Митотическая форма свойственна периоду митоза, когда хромосомы имеют вид компактных, интенсивно окрашенных телец. Компактность структуры обеспечивает передачу наследственного материала без повреждения. Интерфазная форма соответствует хроматину ядер неделящихся клеток и под микроскопом заметна в виде рыхло расположенных нитчатых образований эухроматина и глыбок гетерохроматина. Степень конденсации этих участков хроматина различна. При дифференциальной окраске они по-разному окрашиваются. Слабоокрашенные участки – эухроматиновые – соответствуют положению структурных генов в слабоконденсированных локусах ДНК. В них активно происходит транскрипция. Интенсивно окрашенные участки – гетерохроматин – характеризуются отсутствием структурных генов, а значит и транскрипции, в основном расположены в области центромер и на свободных концах хромосом и соответствуют высококонденсированной ДНК.
концах которых расположены Рис. 2. Типы метафазных хромосом. (8) теломеры. По расположению первичной перетяжки различают следующие виды хромосом (см. рис. 1 и 2) 1) метацентрические – центромера расположена посередине и плечи примерно равной длины; 2) субметацентрические – центромера смещена от середины и плечи имеют разную длину; 3) акроцентрические – центромера резко смещена к одному концу и одно плечо хромосомы очень короткое; Для организмов каждого вида установлена специфичность хромосомного набора. Специфичность проявляется в постоянстве числа хромосом, их относительных размеров, форме, деталей строения и окраске. Хромосомный комплекс клетки конкретного организма с присущими ему морфофизиологическими особенностями называется кариотип. Хромосомные болезни а) Классификация хромосомных болезней. Хромосомные болезни - это большая группа врожденных наследственных болезней. Они занимают одно из ведущих мест в структуре наследственной патологии человека. По данным цитогенетических исследований среди новорожденных детей частота хромосомной патологии составляет 0,6— 1,0%. Самая высокая частота хромосомной патологии (до 70%) зафиксирована в материале ранних спонтанных абортусов. Следовательно, большинство хромосомных аномалий у человека несовместимо даже с ранними этапами эмбриогенеза. Такие зародыши элиминируются во время имплантации (7-14-е дни развития), что клинически проявляется как задержка или выпадение менструального цикла. Некоторая часть эмбрионов гибнет вскоре после имплантации (ранние выкидыши). Сравнительно немногие варианты числовых аномалий хромосом совместимы с постнатальным развитием и ведут к хромосомным заболеваниям (Кулешов Н.П., 1979). Хромосомные болезни появляются вследствие повреждений генома, возникающих при созревании гамет, в процессе оплодотворения или на ранних стадиях дробления зиготы. Все хромосомные болезни могут быть разделены на три большие группы: 1) связанные с нарушением плоидности; 2) обусловленные нарушением числа хромосом; 3) связанные с изменением структуры хромосом. Аномалии хромосом, связанные с нарушением плоидности, представлены триплоидией и тетраплоидией, которые встречаются преимущественно в материале спонтанных абортусов. Отмечены лишь единичные случаи рождения детей-триплоидов с тяжелыми пороками развития, несовместимыми с нормальной жизнедеятельностью. Триплоидия может возникать как вследствие дигении (оплодотворение диплоидной яйцеклетки гаплоидным сперматозоидом), так и вследствие диандрии (обратный вариант) и диспермии (оплодотворение гаплоидной яйцеклетки двумя сперматозоидами). Хромосомные болезни, связанные с нарушением числа отдельных.хромосом в наборе, представлены либо целой моносомией (одной из двух гомологичных хромосом в норме) либо целой трисомией (тремя гомологами). Целая моносомия у живорожденных встречаются только по хромосоме X (синдром Шерешевского-Тернера), поскольку большинство моносомий по остальным хромосомам набора (Y хромосоме и аутосомам) погибают на очень ранних этапах внутриутробного развития и достаточно редко встречаются даже в материале спонтанно абортированных эмбрионов и плодов. Следует, однако, отметить, что и моносомия X с достаточно высокой частотой (около 20%) выявляется у спонтанных абортусов, что свидетельствует о ее высокой пренатальной летальности, составляющей свыше 99%. Причина гибели зародышей с моносомией X в одном случае и живорождения девочек с синдромом Шерешевского-Тернера в другом, неизвестна. Существуют ряд гипотез, объясняющих этот факт, одна из которых связывает повышенную гибель Х-моносомных зародышей с более высокой вероятностью проявления рецессивных летальных генов на единственной Х-хромосоме. Целые трисомии у живорожденных встречаются по X, 8, 9, 13, 14, 18, 21 и 22 хромосомам. Наибольшая частота хромосомных нарушений - до 70% отмечается у ранних абортусов. Трисомии по 1, 5, 6, 11 и 19 хромосомам встречаются редко даже в абортивном материале, что свидетельствует о большой морфогенетической значимости этих хромосом. Более часто целые моно- и трисомии по ряду хромосом набора встречаются в мозаичном состоянии как у спонтанных абортусов, так и у детей с МВПР (множественными врожденными пороками развития). Хромосомные болезни, связанные с нарушением структуры хромосом, представляют большую группу синдромов частичных моно- или трисомии. Как правило, они возникают в результате структурных перестроек хромосом, имеющихся в половых клетках родителей, которые вследствие нарушения процессов рекомбинации в мейозе приводят к утрате или избытку фрагментов хромосом, вовлеченных в перестройку. Частичные моно- или трисомии известны практически по всем хромосомам, но лишь некоторые из них формируют четко диагностируемые клинические синдромы. Фенотипические проявления этих синдромов более полиморфны, чем синдромов целых моно- и трисомии. Отчасти это связано с тем, что размеры фрагментов хромосом и, следовательно, их генный состав, могут варьировать в каждом отдельном случае, а также тем, что при наличии хромосомной транслокации у одного из родителей частичная трисомия по одной хромосоме у ребенка может сочетаться с частичной моносомией по другой. б) Клинико-цитогенетическая характеристика синдромов, связанных с числовыми аномалиями хромосом. 1.Ссиндром Патау (трисомия по хромосоме 13). Впервые описан в 1960 году. Цитогенетические варианты могут быть различны: целая трисомия 13 (нерасхождение хромосом в мейозе, в 80% случаев у матери), транслокационный вариант (робертсоновские транслокации D/13 и G/13), мозаичные формы, дополнительная кольцевая хромосома 13, изохромосомы. Больные имеют тяжелые аномалии строения: расщепление мягкого и твердого неба, незаращение губы, недоразвитие или отсутствие глаз, неправильно сформированные низко посаженные уши, деформированные кости рук и стопы, многочисленные нарушения со стороны внутренних органов, например отмечены врожденные пороки сердца (дефекты перегородок и крупных сосудов). Глубокая идиотия. Продолжительность жизни детей меньше года, чаще 2-3 месяца. Популяционная частота 1 на 7800.
[7] [7]
[5]
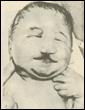
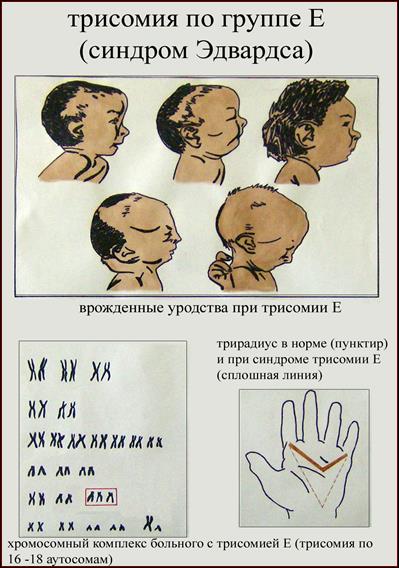
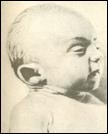
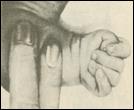
2. Синдром Эдвардса (трисомия по хромосоме 18).. Описан в 1960 году. Цитогенетически в большинстве случаев представлен целой трисомией 18 (гаметическая мутация одного из родителей, чаще по материнской линии). Кроме того, встречаются и мозаичные формы, а транслокации наблюдаются очень редко. Критическим сегментом, ответственным за формирование основных признаков синдрома, является сегмент 18q11. Клинических различий между цитогенетическими формами не обнаружено. Больные имеют узкий лоб и широкий выступающий затылок, очень низко расположенные деформированные уши, недоразвитие нижней челюсти, широкие и короткие пальцы рук. Из
[7]
[5]
внутренних пороков следует отметить комбинированные пороки сердечно-сосудистой системы, незавершенный поворот кишечника пороки развития почек и пр.. Дети с синдромом Эдвардса имеют малую массу тела при рождении. Отмечается задержка психомоторного развития, идиотия и имбецильность. Продолжительность жизни до года - 2-3 месяца. Популяционная частота 1 на 6500. 4. 5. имеют укороченные конечности, маленький череп, плоское и широкое переносье, узкие, с косым разрезом глазные щели, нависающую складку верхнего века – эпикант, избыток кожи на шее, короткие конечности, поперечная четырехпальцевая ладонная складка (обезьянья борозда). Из пороков внутренних органов часто отмечаются врожденные пороки сердца и желудочно-кишечного тракта, которые и определяют продолжительность жизни больных. Характерна психическая отсталость средней степени тяжести. Дети с синдромом Дауна часто ласковые и привязчивые, послушные и внимательные. Жизнеспособность их понижена.
[5]
в) Клинико-цитогенетическая характеристика синдромов, связанных с аномалиями половых хромосом. 1. Синдром Шерешевского-Тернера (моносомия Х-хромосомы). Это единственная форма моносомии у человека, которая может быть
[17]
[5]
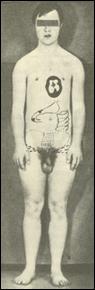
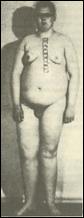
2. Синдром полисомии Х-хромосомы ( Трисомии Х). Цитогенетически выявляются (8) формы 47,ХХХ, 48,ХХХХ и 49,ХХХХХ. С увеличением числа X хромосомы нарастает степень отклонений от нормы. У женщин с тетра- и пентасомией X описаны отклонения в умственном развитии, аномалии скелета и половых органов. Женщины с кариотипом 47,ХХХ в полной или мозаичной форме в основном имеют нормальное физическое и психическое развитие, а интеллект - в пределах нижней границы нормы. У этих женщин имеется ряд нерезких отклонений в физическом развитии, нарушения функции яичников, преждевременный климакс, однако они могут иметь потомство. Популяционная частота 1 на 1000 новорожденных девочек. 3. Синдром Клайнфельтера. Описан в 1942 году. Популяционная частота 1 на 1000 мальчиков. Цитогенетические варианты синдрома могут быть различны: 47.XXY: 48.XXYY; 48.XXXY; 49.XXXXY. Отмечены как полные, так и мозаичные формы. Больные высокого роста с непропорционально длинными конечностями. В детстве отличаются хрупким телосложением, а после 40 лет страдают ожирением. У них развивается астенический или евнуховидный тип телосложения: узкие плечи, широкий таз, жироотложение по женскому типу, слабо развита [5]
мускулатура, скудная растительность на лице. Больные имеют недоразвитие семенников, отсутствие сперматогенеза, снижение полового влечения, импотенция и бесплодие. Обычно развивается умственная отсталость. Коэффициент интеллекта ниже 80. (8) 4. Синдром полисемии Y-хромосомы (дабл-У или «лишней У хромосомы»). Популяционная частота 1 на 1000 мальчиков. Цитогенетически отмечены полные и мозаичные формы. Большинство индивидов по физическому и умственному развитию не отличается от здоровых. Половые железы развиты нормально, рост, как правило, высокий, имеются некоторые аномалии зубов и костной системы. Наблюдаются психопатические черты: неустойчивость эмоций, асоциальное поведение, склонность к агрессии, гомосексуализму. Больные не обнаруживают значительной задержки умственного развития, а часть больных вообще имеет нормальный г) Клинико-цнтогенетнческая характеристика синдромов, связанных со структурными перестройками хромосом. Синдром "кошачьего крика" (моносомия 5р). Описан в 1963 году. Популяционная частота 1 на 50000. Цитогенетические варианты варьируют от частичной до полной делеции короткого плеча хромосомы 5. Для развития основных признаков синдрома большое значение имеет сегмент - 5р15. Кроме простой делеции отмечены кольцевые хромосомы 5, мозаичные формы, а также транслокации между коротким плечом хромосомы 5 (с потерей критического сегмента) и другой аутосомой. Диагностическими признаками заболевания являются: микроцефалия, необычный крик или плач, напоминающий мяуканье кошки (особенно в первые недели после рождения); антимонголоидный разрез глаз, косоглазие, лунообразное лицо, широкая переносица. Ушные раковины низко посажены и деформированы. Имеется поперечная ладонная складка, аномалии строения кистей и пальцев. Умственная отсталость в стадии имбецильносги. Нужно отметить, что такие признаки как лунообразное лицо и кошачий крик с возрастом сглаживаются, а микроцефалия и косоглазие выявляются более отчетливо. Продолжительность жизни зависит от тяжести врожденных пороков развития внутренних органов. Большинство больных погибают в первые годы жизни. д) Клинико-цитогенетическая характеристика синдромов и злокачественных новообразований, связанных с микроструктурными аномалиями хромосом. В последнее время клинико-цитогенетические исследования стали опираться на высокоразрешающие методы хромосомного анализа, позволившее подтвердить предположение о существовании микрохромосомных мутаций, выявление которых находится на грани возможностей светового микроскопа. Используя стандартные цитогенетические методы можно достичь визуального разрешения хромосом с числом сегментов не более 400, а с применением методов прометафазного анализа, предложенного Юнисом в 1976 году, удается получать хромосомы с числом сегментов до 550-850. Незначительные нарушения в структуре хромосом могут быть выявлены с помощью этих методов хромосомного анализа не только среди больных с МВПР, но и при некоторых неизвестных менделирующих синдромах, различных злокачественных образованиях. Большинство синдромов, связанных с микроаномалиями хромосом, встречается редко - 1 случай на 50000-100000 новорожденных. Ретинобластома. Больные с ретинобластомой - злокачественной опухолью сетчатки глаза, составляют 0,6-0,8% от числа всех больных с онкозаболеваниями. Это первая опухоль, для которой установлена связь с хромосомной патологией. Цитогенетически при данном заболевании выявляется микроделеция 13 хромосомы, сегмента 13q14. Кроме микроделеций встречаются мозаичные формы и транслокационные варианты. Описано несколько случаев транслокации сегмента 13 хромосомы на Х-хромосому. Не отмечено корреляции между размерами делецированного фрагмента и фенотипическими проявлениями. Заболевание обычно начинается в возрасте около 1,5 лет и первыми признаками являются свечение зрачков, вялая реакция зрачка на свет, а затем и снижение зрения вплоть до слепоты. Осложнениями ретинобластомы являются отслойка сетчатки, вторичная глаукома. В 1986 году в критическом сегменте 13ql4 обнаружен ген-супрессор опухоли RBI, который явился первым антионкогеном, обнаруженным у человека. е) Моногенные заболевания, проявляющиеся хромосомной нестабильностью. К настоящему времени установлены новые типы изменчивости генома, отличающиеся по частоте и механизмам от обычного мутационного процесса. Одним из проявлений нестабильности генома на клеточном уровне является хромосомная нестабильность. Нестабильность хромосом оценивают по увеличению спонтанной и/или индуцированной частоте хромосомных аберраций и сестринских хроматидных обменов (СХО). Впервые повышенная частота спонтанных хромосомных аберраций была показана в 1964 году у больных с анемией Фанкони, а повышенная частота СХО была обнаружена при синдроме Блюма. В 1.968 году было установлено, что пигментная ксеродерма - фотодерматоз, при котором повышена частота индуцированных УФ-облучением хромосомных аберраций, связана с нарушением способности клеток репарировать (восстанавливать) свою ДНК от повреждений, вызванных УФ-облучением. В настоящее время известно около полутора десятков моногенных патологических признаков, связанных с повышенной ломкостью хромосом. При этих заболеваниях нет специфических участков хромосомных повреждений, однако повышается общая частота аберраций хромосом. Молекулярный механизм данного явления чаще всего связан с дефектами отдельных генов, кодирующих ферменты репарации ДНК. Поэтому большинство болезней, сопровождающихся хромосомной нестабильностью, называют еще болезнями репарации ДНК. Несмотря на то, что по своим клиническим проявлениям эти болезни различны, для всех них характерны повышенная склонность к злокачественным новообразованиям, признаки преждевременного старения, неврологические расстройства, иммунодефицитные состояния, врожденные пороки развития, кожные проявления, нередко наблюдается умственная отсталость. Помимо мутаций генов репарации ДНК в основе болезней с хромосомной нестабильностью могут лежать дефекты и других генов, обеспечивающих стабильность генома. В последнее время накапливается все больше данных о том, что помимо заболеваний, проявляющихся нестабильностью структуры хромосом, имеются и моногенные дефекты, приводящие к болезням с нестабильностью числахромосом. В качестве такой самостоятельной группы моногенных болезней можно выделить редкие патологические состояния, указывающие на неслучайный, наследственно обусловленный характер нерасхождения хромосом в соматических клетках в ходе эмбриогенеза. При цитогенетическом исследовании у этих больных в небольшой части клеток (обычно в 5-20%) выявляется соматический мозаицизм сразу по нескольким хромосомам набора или у одной супружеской пары может быть несколько сибсов с хромосомным мозаицизмом. Предполагается, что такие больные являются "митотическими мутантами" по рецессивным генам, контролирующим отдельные этапы прохождения митоза. Нет сомнения в том, что большинство подобного рода мутаций являются летальными, а выжившие индивиды имеют относительно легкие формы патологии клеточного деления. Несмотря на то, что указанные выше заболевания обусловлены дефектами отдельных генов, проведение цитогенетического исследования у больных с подозрением на данную патологию поможет врачу в дифференциальной диагностике этих состояний. Заболевания с нестабильностью структуры хромосом: Синдром Блюма. Описан в 1954 году. Основными диагностическими признаками являются: низкий вес при рождении, задержка роста, узкое лицо с эритемой в виде бабочки, массивный нос, иммунодефицитные состояния, склонность к злокачественным новообразованиям. Умственная отсталость отмечается не во всех случаях. Цитогенетически характеризуется увеличением числа сестринских хроматидных обменов (СХО) на клетку до 120-150, хотя в норме их число не превышает 6-8 обменов на 1 клетку. Кроме того, с высокой частотой обнаруживаются хроматидные разрывы, а также дицентрики, кольца и хромосомные фрагменты. У больных обнаруживаются мутации в гене ДНК-лигазы 1, локализованном на 19 хромосоме- 19q13.3, однако ген синдрома Блюма картирован в сегменте 15q26.1. Анемия Фанкони. Заболевание с аутосомно-рецессивным типом наследования. Описано в 1927 году. Основные диагностические признаки: гипоплазия лучевой кости и большого пальца, задержка роста и развития, гиперпигментация кожи в паховой и подмышечных областях. Кроме того, отмечаются гипоплазия костного мозга, склонность к лейкозам, гипоплазия наружных половых органов. Цитогенетически характеризуется множественными хромосомными аберрациями - разрывами хромосом и хроматидными обменами. Это генетически гетерогенное заболевание, т.е. клинически сходный фенотип обусловлен мутациями разных генов. Существует по крайней мере 7 форм этого заболевания: A - ген локализован в сегменте 16q24.3; В - локализация гена неизвестна; С - 9q22.3; D - Зр25.3; Е - 6р22; F - 11р15; G (MIM 602956) - 9р13. Наиболее часто встречается форма А - около 60% больных. Синдром Вернера (синдром преждевременного старения). Заболевание с аутосомно-рецессивным типом наследования. Описано в 1904 году. Основными диагностическими признаками являются: преждевременное поседение и облысение, атрофия подкожной жировой клетчатки и мышечной ткани, катаракта, ранний атеросклероз, эндокринная патология (сахарный диабет). Характерны бесплодие, высокий голос, склонность к злокачественным новообразованиям. Больные умирают в возрасте 30-40 лет. Цитогенетически характеризуется клеточными клонами с разными хромосомными транслокациями (мозаицизм по различным транслокациям). Ген заболевания локализован в сегменте 8р11-р12. ж) Синдром ломкой Х-хромосомы. Как правило, разрывы хромосом или пробелы хроматид, возникающие с повышенной частотой в тех или иных конкретных хромосомных сегментах (так называемые ломкие участки или фрагильные сайты хромосом), не связаны с какими-либо заболеваниями. Однако из этого правила есть исключение. В 1969 году у больных с синдромом, сопровождающимся умственной отсталостью, обнаружилось наличие специфического цитогенетического маркера - в дистальной части длинного плеча X-хромосомы в сегменте Xq27.3 в отдельных клетках фиксируется разрыв или пробел хроматид. Позднее было показано, что первое клиническое описание семьи с синдромом, в котором умственная отсталость является ведущим клиническим признаком, был описан еще в 1943 году английскими врачами П. Мартином и Ю. Белл. Синдром Мартина-Белл или синдром, ломкой Х-хромосомы характеризуется ломкой (фрагильной) Х-хромосомой в сегменте Xq27.3, которая выявляется в специальных условиях культивирования клеток в среде с дефицитом фолиевой кислоты. Фрагильный сайт при этом синдроме получил обозначение FRAXA. Основными диагностическими признаками заболевания являются: умственная отсталость, широкое лицо с чертами акромегалии, большие оттопыренные уши, аутизм, гиперподвижность, плохая концентрация внимания, дефекты речи, более выраженные у детей. Отмечаются также аномалии соединительной ткани с гиперрастяжимостью суставов и дефектом митрального клапана. Относительно полный спектр клинических признаков имеют только 60% мужчин с фрагильной Х-хромосомой, 10% больных не имеют лицевых аномалий, 10% имеют только умственную отсталость без других признаков. Синдром фрагильной Х-хромосомы интересен своим необычным наследованием и высокой популяционной частотой (1 на 1500-3000). Необычность наследования состоит в том, что только 80% мужчин, носителей мутантного гена, имеют признаки заболевания, а остальные 20% как клинически, так и цитогенетически нормальны, хотя после передачи мутации своим дочерям могут иметь пораженных внуков. Этих мужчин называют трансмиттерами, т.е. передатчиками неэкспрессированного мутантного гена, который становится экспрессируемым в последующих поколениях. Кроме того, имеется два типа женщин - гетерозиготных носителей мутантного гена: а) дочери мужчин-трансмиттеров, не имеющих симптомов заболевания, у которых не выявляется фрагильная X хромосома; б) внучки нормальных мужчин-трансмиттеров и сестры пораженных мужчин, которые обнаруживают клинические признаки заболевания в 35% случаев. Таким образом, мутация гена при синдроме Мартина-Белл существует в двух формах, отличающихся по своей пенетрантности: первая форма - фенотипически не проявляющаяся премутация, которая переходит в полную мутацию (вторая форма) при прохождении через женский мейоз. Обнаружена четкая зависимость развития умственной отсталости от положения индивида в родословной. При этом хорошо прослеживается явление антиципации - более тяжелого проявления заболевания в последующих поколениях. Молекулярный механизм мутации стал понятен в 1991 году, когда был охарактеризован ген, ответственный за развитие данного заболевания. Ген получил название FMR1 (англ. - Fragile site Mental Retardation 1 - ломкий участок хромосомы, связанный с развитием умственной отсталости 1 типа). Было установлено, что в основе клинических проявлений и цитогенетической нестабильности в локусе Xq27.3 лежит многократное увеличение в первом экзоне гена FMR-1 простого тринуклеотидного повтора CGG. У нормальных людей число этих повторов в Х-хромосоме колеблется от 5 до 52, а у больных их число составляет 200 и более. Такое явление резкого, скачкообразного изменения числа CGG-повторов у больных получило название экспансии числа тринуклеотидных повторов: Показано, что экспансия CGG-повторов существенно зависит от пола потомка, она заметно увеличена при передаче мутации от матери к сыну. Важно отметить, что экспансия нуклеотидных повторов является постзиготическим событием и возникает на очень ранних стадиях эмбриогенеза. Молекулярная цитогенетика Молекулярно-цитогенетические методы, в основе которых лежит использование различных ДНК-зондов и методология гибридизации in situ являются довольно перспективными для диагностики большинства хромосомных нарушений, таких как сбалансированные и несбалансированные транслокации, дополнительные маркерные хромосомы неизвестной природы, дицентрические хромосомы, некоторые варианты микродупликаций, микроделеций и инсерций. Кроме того, методы молекулярной цитогенетики могут использоваться для уточнения степени мозаицизма или установления небольшого аномального клона клеток, не улавливаемого обычным цитогенетическим исследованием. Установленная с помощью молекулярно-цитогенетических методов тонкая структура хромосомной перестройки является необходимым условием для описания новых и уточнения уже существующих хромосомных синдромов. Флюоресцентная гибридизация in situ (англ. - Fluorescence In Situ Hybridization - FISH) Представляет собой реакцию гибридизации специфических ДНК-зондовна те или иные известные участки генома с ДНК хромосом исследуемого индивида. В основе этой реакции лежит феномен комплиментарного спаривания азотистых оснований ДНК. В качестве ДНК-зондов выступают любые клонированные последовательности ДНК, выделенные фрагменты ДНК, целые хромосомы и их участки, отдельные гены и т.д. Для обнаружения (детекции) ДНК-зонда перед проведением гибридизации в его состав вводят специфические «метки» (молекулы), которые маркируют данный зонд и позволяют увидеть его непосредственно на исследуемых хромосомах (in situ). Исторически первым методом гибридизации in situ был радиоактивный вариант детекции (1969), впоследствии модифицированный в неизотопный - флюоресцентный (1986). При флюоресцентной гибридизации in situ ДНК-зонды «метят» двумя способами: 1) ДНК-зонд метится непосредственно флюоресцирующими репортерными молекулами, конъюгированными с нуклеотидами (прямая детекция); 2) Сначала ДНК-зонды метятся репортерными молекулами (биотин, дигоксигенин), которые затем «узнаются» с помощью других соединений (например, авидином) или антител, коньюгированных с флюорохромами (например, родамином) (непрямая детекция). ДНК-зондов проводится чаще всего в ходе реакции ник-трансляции, заключающейся во внесении одноцепочных разрывов («ников») в молекулу ДНК с последующим восстановлением ее структуры за счет имеющихся в реакционной смеси свободных нуклеотидов, в том числе и коньюгированных с репортерными молекулами. В настоящее время разработаны и другие способы мечения ДНК-зондов. FISH-анализ проводят на цитологических препаратах с метафазными хромосомами или интерфазными ядрами любых клеток организма.Для этого пригодны любые клетки организма, но наиболее часто используются лимфоциты периферической крови, клетки буккального эпителия, фибробласты кожи, клетки ворсин хориона и амниотической жидкости. Основные этапы FISH-анализа включают: 1. Прегибридизация. Обработка цитологических препаратов РНК-азой и пепсином; 2. Денатурация анализируемой двухцепочечной ДНК на одноцепочечньге молекулы в 70% формамиде; 4. Гибридизация с ДНК-зондом; Отмывка неспецифически связанного ДНК-зонда с препаратов в 50% формамиде; 5.Детекция: прямая или непрямая. Для непрямой детекции проводят последовательную обработку препарата соединениями или антителами, коньюгированными с соответствующими флюорохромами. Метод позволяет проанализировать числовые аномалии хромосом в метафазных и интерфазных клетках (особенно для выявления небольших по численности клеточных клонов; исследование процессов мутагенеза), их структурные нарушения, уточнить происхождение сложных комплексных структурных перестроек хромосом и картировать гены. Типы ДНК-зондов и область их применения: 1. Центромероспецифичные ДНК-зонды.Это клонированные в составе какого-либо вектора (например, бактериальной плазмиды) фрагменты ДНК, содержащие высокоповторяющиеся последовательности нуклеотидов в центромерном или прицентромерном гетерохроматине, но обладающие полной или относительной специфичностью к центромерным районам определенных хромосом. При полной специфичности таких ДНК-зондов они связываются с центромерным районом только одной хромосомы, а относительно специфические ДНК-зонды связываются с центромерными районами двух или более хромосом. Применяются для анализа числовых нарушений хромосом в метафазных и интерфазных клетках, исследования происхождения маркерных хромосом, анализа хромосомного мозаицизма, определения пола плода. 2. Теломерные ДНК-зонды. Это клонированные фрагменты ДНК, содержащие последовательности нуклеотидов, специфичные к теломерным районам определенных хромосом. Применяются для анализа структурных нарушений хромосом (особенно скрытых микроделеций) в терминальных районах короткого или длинного плеча конкретной хромосомы. 3. Хромосомоспецифичные ДНК-библиотеки.Это совокупность уникальных последовательностей ДНК, покрывающих всю длину определенной хромосомы. Такие ДНК-зонды, полностью окрашивающие индивидуальную хромосому после проведения процедуры гибридизации и детекции, получили название "painting''-пробы. Применяются для идентификации целых хромосом или их фрагментов в исследуемых метафазных пластинках, при исследовании происхождения сложных транслокаций, дупликаций, инсерций и маркерных хромосом. 4. Уникальные ДНК-зонды. Это клонированные уникальные последовательности ДНК, строго специфичные для определенных районов хромосом или отдельных генов. Применяются для исследования синдромов, связанных с микроструктурными перестройками хромосом и для целей картирования генов. Модификации FISH-метода: 1. Супрессионная гибридизация in situ (англ. - Chromosomal In Situ Supression - CISS). Принцип CISS-анализа заключается в использовании для гибридизации меченых репортерной молекулой (например биотином) набор хромосомоспецифических ДНК-проб, маркирующих всю длину анализируемой хромосомы, вместе с избытком немеченой высокоповторяющейся конкурирующей ДНК. Диспергированные повторяющиеся последовательности, локализованные в ДНК-пробах, быстро гибридизуются с конкурирующей ДНК (супрессируются), в то время как уникальные последовательности остаются однонитчатыми и поэтому не теряют способности гибридизоваться в дальнейшем с соответствующей хромосомой. Эти меченные уникальные последовательности ДНК детектируются на хромосомах с помощью коньюгированных с флюорохромом молекул. Область применения соответствует области использования "painting''-проб. 2. Синтез ДНК in situ с помощью олигонуклеотидных праймеров (англ. - Oligonucleotide Pr
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 223; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.195.180 (0.014 с.) |

 Рис. 1.Строение хромосом. Метафазные и интерфазные хромосомы (8)
Рис. 1.Строение хромосом. Метафазные и интерфазные хромосомы (8) Митотическая хромосома состоит из двух хроматид, соединенных в области первичной перетяжки – центромеры. При помощи кинетохора к хромосоме в области центромеры прикрепляются нити веретена деления. Центромера делит хромосому на участки, называемые плечами, на
Митотическая хромосома состоит из двух хроматид, соединенных в области первичной перетяжки – центромеры. При помощи кинетохора к хромосоме в области центромеры прикрепляются нити веретена деления. Центромера делит хромосому на участки, называемые плечами, на


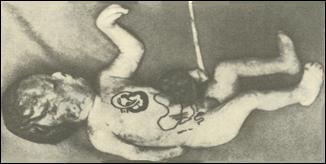
 Синдром Дауна (трисомия хромосомы 21). Впервые описан в 1866 году английским врачом Дауном. Популяционная частота 1 случай на 600-700 новорожденных детей.Частота рождения детей с данным синдромом зависит от возраста матери и резко увеличивается после 35 лет. Цитогенетические варианты очень разнообразны, но около Рис. 15. С. Дауна (6) вверху (8)внизу
Синдром Дауна (трисомия хромосомы 21). Впервые описан в 1866 году английским врачом Дауном. Популяционная частота 1 случай на 600-700 новорожденных детей.Частота рождения детей с данным синдромом зависит от возраста матери и резко увеличивается после 35 лет. Цитогенетические варианты очень разнообразны, но около Рис. 15. С. Дауна (6) вверху (8)внизу 95% случаев представлены простой трисомией 21 хромосомы, в результате нерасхождения хромосом в мейозе у родителей. Наличие полиморфных молекулярно-генетических маркеров позволяет определить конкретного родителя и стадию мейоза в которой произошло нерасхождение. Несмотря на интенсивное изучение синдрома причины нерасхождения хромосом до настоящего времени не ясны. Этиологически важными факторами считаются внутри- и внефолликулярное перезревание яйцеклетки, снижение числа или отсутствие хиазм в первом делении мейоза. Отмечены мозаичные формы синдрома (2%), робертсоновские транслокационные варианты (4%). Около 50% транслокационных форм наследуются от родителей и 50% являются мутациями de novo. Критическим сегментом, ответственным за формирование основных признаков синдрома, является область 21q22. Больные
95% случаев представлены простой трисомией 21 хромосомы, в результате нерасхождения хромосом в мейозе у родителей. Наличие полиморфных молекулярно-генетических маркеров позволяет определить конкретного родителя и стадию мейоза в которой произошло нерасхождение. Несмотря на интенсивное изучение синдрома причины нерасхождения хромосом до настоящего времени не ясны. Этиологически важными факторами считаются внутри- и внефолликулярное перезревание яйцеклетки, снижение числа или отсутствие хиазм в первом делении мейоза. Отмечены мозаичные формы синдрома (2%), робертсоновские транслокационные варианты (4%). Около 50% транслокационных форм наследуются от родителей и 50% являются мутациями de novo. Критическим сегментом, ответственным за формирование основных признаков синдрома, является область 21q22. Больные



 выявлена у живорожденных. Кроме простой моносомии по X хромосоме, составляющей 50%, встречаются мозаичные формы, делеции длинного и короткого плеча X хромосомы, изо-Х-хромосомы, а также кольцевые X хромосомы. Интересно отметить, что мозаицизм 45,X/46,XY составляет 2-5% от всех больных с этим синдромом и характеризуется широким диапазоном признаков: от типичного синдрома Шерешевского-Тернера до нормального мужского фенотипа. Популяционная частота 1 на 3000 новорожденных. Больные имеют небольшой рост, бочкообразную грудную клетку, широкие плечи, узкий таз, укороченные нижние конечности. Очень характерный признак - короткая шея со складками кожи, идущими от затылка (шея сфинкса). У них наблюдается низкий рост волос на затылке, гиперпигментация кожи, снижение зрения и слуха. Внутренние углы глаз располагаются выше наружных. Часто встречаются врожденные пороки сердца и почек. У больных выявляется недоразвитие яичников. Бесплодны. Интеллектуальное развитие в пределах нормы. Отмечается некоторая инфантильность эмоций, неустойчивость настроения. Больные достаточно жизнеспособны.
выявлена у живорожденных. Кроме простой моносомии по X хромосоме, составляющей 50%, встречаются мозаичные формы, делеции длинного и короткого плеча X хромосомы, изо-Х-хромосомы, а также кольцевые X хромосомы. Интересно отметить, что мозаицизм 45,X/46,XY составляет 2-5% от всех больных с этим синдромом и характеризуется широким диапазоном признаков: от типичного синдрома Шерешевского-Тернера до нормального мужского фенотипа. Популяционная частота 1 на 3000 новорожденных. Больные имеют небольшой рост, бочкообразную грудную клетку, широкие плечи, узкий таз, укороченные нижние конечности. Очень характерный признак - короткая шея со складками кожи, идущими от затылка (шея сфинкса). У них наблюдается низкий рост волос на затылке, гиперпигментация кожи, снижение зрения и слуха. Внутренние углы глаз располагаются выше наружных. Часто встречаются врожденные пороки сердца и почек. У больных выявляется недоразвитие яичников. Бесплодны. Интеллектуальное развитие в пределах нормы. Отмечается некоторая инфантильность эмоций, неустойчивость настроения. Больные достаточно жизнеспособны.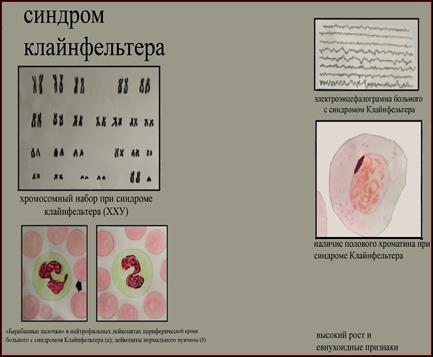
 [7]
[7] интеллект. Могут иметь нормальное потомство в 50% случаев.
интеллект. Могут иметь нормальное потомство в 50% случаев.


