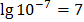Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Диссоциация воды. Ионное произведение воды, рН и рОН.Содержание книги
Поиск на нашем сайте
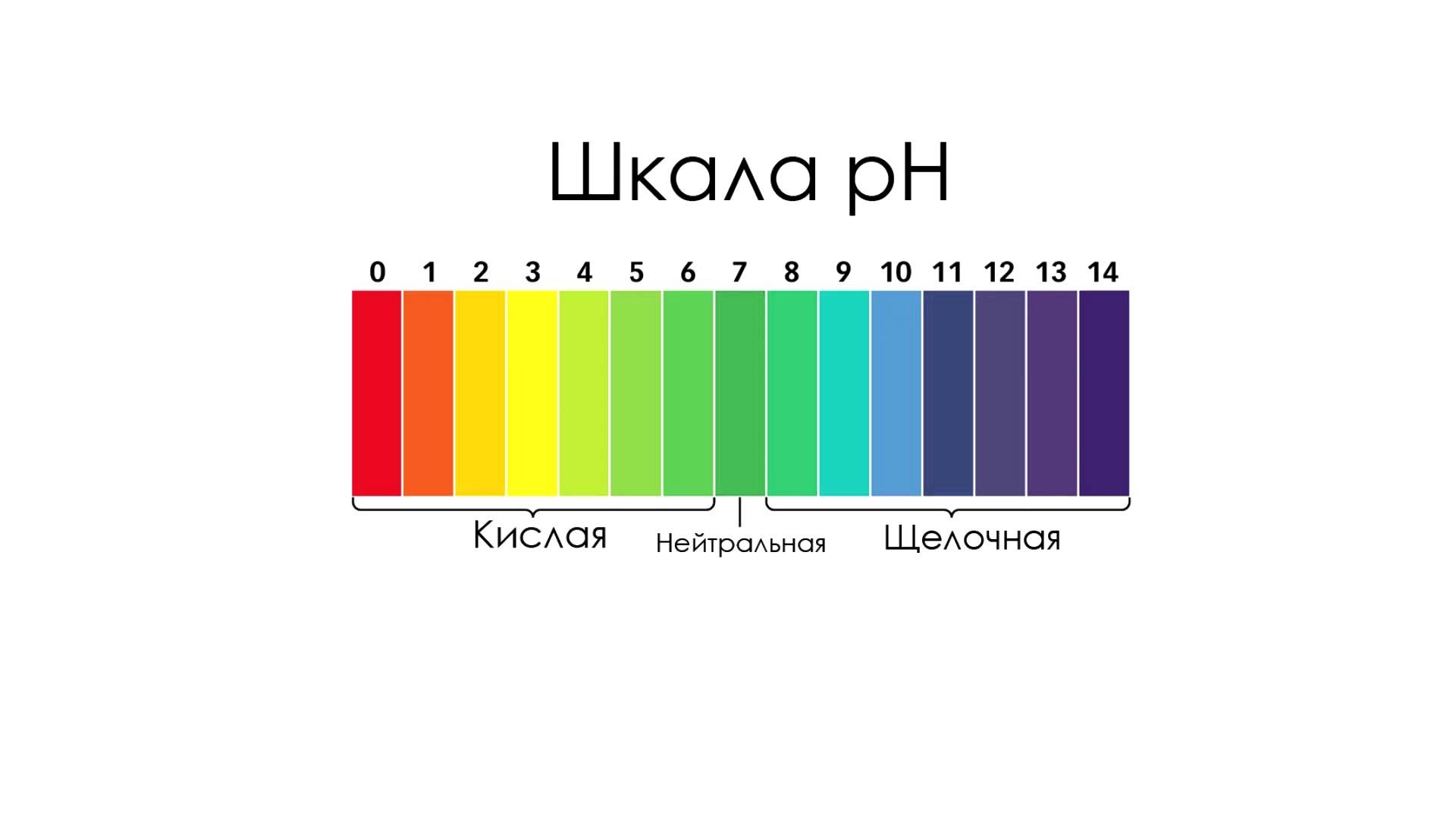
Состояние динамического равновесия электрической диссоциации воды можно представить уравнением: Н2О = Н+ + ОН- Согласно этому, вода является типичным амфотерным соединением, т.к. при её диссоциации образуются ионы водорода – носители кислотных свойств и ионы гидроксида – носители щелочных свойств. Как видно из уравнения, концентрация Н+ = концентрации ОН-. Но в растворах кислот, щелочей, солей концентрации могут изменяться: а) в нейтральных растворах [H+] = [OH-] б) в кислых растворах [H+]> [OH-] в) в щелочных растворах [H+] <[OH-] Произведение концентрации ионов водорода и гидроксид-ионов называется ионным произведением воды. Опытным путем установлено, что [H+] · [OH-]» 10-14 и обозначается Кислотные и щелочные свойства водных растворов характеризуются с количественной стороны величиной концентрации ионов водорода или гидроксид-ионов. В чистой воде и нейтральных водных растворах концентрации ионов равны, и поэтому: [H+] = [OH-] =10-7 моль/л в кислой среде: [H+]> 10-7 моль/л, а [OH-] <10-7 в щелочной среде: [H+] <10-7 моль/л, а [OH-]> 10-7 10-7=0,0000001 Обычно вместо величины [H+] применяют отрицательный десятичный логарифм этой величины, называемый показателем водородных ионов или водородным показателем рН, отрицательный десятичный логарифм [OH-] называется показателем гидроксид-ионов рОН (гидроксидный показатель) рН = - Следовательно, в нейтральном растворе рН = рОН = 7 в кислой среде рН <рОН; рН <7 в щелочном растворе рН> рОН; рН> 7 Для определения среды водных растворов кислот, солей и оснований необходимо усвоить шкалу рН.
Если в анализируемом растворе рН = 5, то среда будет кислая, т.к. 5<7. Если в анализируемом растворе рН = 13, то среда будет щелочная, т.к. 13>7. рН + рОН = 14 Следовательно, если в растворе рН = 4, то рОН = 14 - 4 = 10 Для определения рН растворов используют: 1) индикаторы. Индикаторы реагируют на среду раствора, окрашиваясь при этом в определенные ему цвета. Наиболее распространенными индикаторами являются: · метиловый оранжевый (красный – желтый) · лакмус (красный – синий) · фенолфталеин (бесцветный – красный) · универсальный (универсальная индикаторная бумага) представляет собой полоску желтого цвета. При опускании её в раствор, она окрашивается в цвет, соответствующий среде раствора и определяемый по шкале.
2) лабораторные рН-метры (потенциометры). Это оборудование физико-химических методов анализа. Буферные растворы При выполнении анализа часто возникает необходимость провести реакцию при определенном значении рН раствора, в этом случае используют буферные растворы. Буферные растворы (или буферные системы) –это растворы, способные сохранять приблизительно постоянное значение рН при добавлении к ним небольших количеств сильных кислот или сильных оснований. Рассмотрим два типа буферных растворов: растворы, содержащие слабую кислоту и ее соль, и растворы, содержащие слабое основание и его соль. 1. Буферный раствор, содержащий слабую кислоту и ее соль Ацетатный буферный раствор-содержит слабую уксусную кислоты и ее соль ацетат натрия CH3COOH+CH3COONa рН=4,74 2. Буферный раствор, содержащий слабое основание и его соль Аммиачный буферный раствор- водный раствор аммиака (слабое основание) и хлорид аммония (сильный электролит) NH4OH+NH4Cl рН=9,2
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 63; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.177.204 (0.006 с.) |

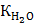
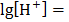 -
-