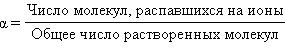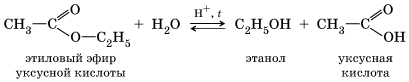Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Степень электролитической диссоциации. Сильные и слабые электролитыСодержание книги
Поиск на нашем сайте С. Аррениус для количественной характеристики электролитической диссоциации ввел понятие степени электролитической диссоциации, обозначаемой греческой буквой α. Степень электролитической диссоциации – это отношение числа молекул электролита, распавшихся на ионы, к общему числу растворенных молекул.
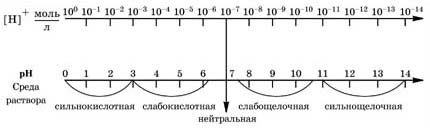
Если α = 0, то вещество совсем не распадается на ионы, оно является неэлектролитом. К неэлектролитам относятся вещества с ковалентными малополярными и неполярными связями, такие, как эфиры, углеводороды, кислород, азот и др. Степень электролитической диссоциации может иметь значение от 0 до 1 (в процентах от 0 до 100 %). Сильные электролиты – это такие электролиты, которые в водных растворах (даже концентрированных) практически полностью диссоциируют на ионы. У таких электролитов степень диссоциации стремится к 1 (100 %). К сильным электролитам относятся почти все соли, неорганические кислоты (HNO3, HCl, HBr, HI, HClO4, НМnО4, H2SO4), щелочи (LiOH, NaОН, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2, Ra(OH)2). Слабые электролиты – это такие электролиты, которые в водных растворах не полностью диссоциируют на ионы. Их степень диссоциации значительно меньше 1 (100 %), в большинстве случаев она стремится к нулю. Но при разбавлении, как вы помните, степень диссоциации увеличивается. К слабым электролитам относятся: многие неорганические кислоты (H2S, HF, H2CO3, H2SiO3, HNO2, H2SO3), органические кислоты, основания (за исключением щелочей), гидрат аммиака NH3 ∙ H2O, вода H2O, некоторые соли. Различают три типа сред: нейтральную, щелочную, кислотную. Нейтральная – это среда, в которой концентрация ионов водорода равна концентрации гидроксид-ионов: [ H+ ] = [ ОН– ] = 10–7 моль/л Кислотная – это среда, в которой концентрация ионов водорода больше концентрации гидроксид-ионов: [ H+ ] > [ OH– ], [ H+ ] > 10-7 моль/л Щелочная – это среда, в которой концентрация ионов водорода меньше концентрации гидроксид-ионов: [ H+ ] < [ OH– ], [ H+ ] < 10-7 моль/л Для характеристики сред растворов удобно использовать так называемый водородный показатель pH (пэ-аш), введенный датским химиком Сёренсеном: р – начальная буква слова potenz — математическая степень, буква Н – химический знак водорода. Водородным показателем pH называется отрицательный десятичный логарифм концентрации ионов водорода: pH = –lg[ H+ ]
Например, если [ Н+ ] = 10–3 моль/л, то pH = 3, среда раствора кислотная; если [ Н+ ] = 10–12 моль/л, то pH = 12, среда раствора щелочная; если [ H+ ] = 10–7 моль/л, то pH = 7, среда нейтральная. Чем pH меньше 7, тем больше кислотность раствора. Чем pH больше 7, тем больше щелочность раствора. Наглядно зависимость между концентрацией ионов водорода, значением pH и реакцией среды раствора показана на схеме:
Существуют различные методы измерения pH. Качественно тип среды и pH водных растворов электролитов определяют с помощью индикаторов – веществ, которые обратимо изменяют свой цвет в зависимости от среды растворов, то есть pH растворов. На практике, как вы знаете, для этого применяют такие индикаторы, как лакмус, метиловый оранжевый, фенолфталеин, универсальный. Водородный показатель имеет большое значение в химических и биологических процессах, так как в зависимости от типа среды эти процессы могут протекать с разными скоростями и в разных направлениях. Измерение pH крови или желудочного сока является диагностическим тестом в медицине. Отклонение pH от нормального значения даже на 0,01 единицы свидетельствует о патологии в организме. Во внутренней среде живых организмов значение pH постоянно. Так, при нормальной кислотности желудочный сок имеет pH = 1,7 (сильнокислотная среда), pH крови человека равен 7,4 (слабощелочная среда), слюны – 7 (близка к нейтральной). Каждый фермент функционирует при определенном значении pH: каталаза крови при pH = 7; пепсин желудочного сока – при pН = 1,5–2 и т. д Гидролиз Согласно теории электролитической диссоциации, в водном растворе частицы растворенного вещества взаимодействуют с молекулами воды. Такое взаимодействие может привести к реакции гидролиза (от греческого hydro – вода, lysis – разложение, распад). Гидролиз – это реакция обменного разложения веществ водой.
Гидролизу подвергаются различные вещества: неорганические – соли, карбиды и гидриды металлов, галогениды неметаллов; органические – галогеналканы, сложные эфиры и жиры, углеводы, белки, полинуклеотиды. Реакции гидролиза могут протекать обратимо и необратимо. Рассмотрим разные случаи этого процесса и его значение.
1. Гидролиз галогеналканов используют для получения спиртов. Например:
хлорэтан этанол Присутствие щелочи (ОН–) позволяет «связать» получающуюся кислоту и сместить равновесие в сторону образования спирта. 2. Гидролиз сложных эфиров протекает обратимо в кислотной среде (в присутствии неорганической кислоты) с образованием соответствующего спирта и карбоновой кислоты:
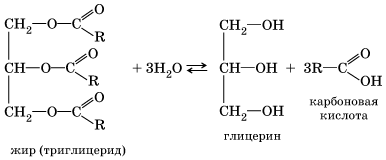
Для смещения химического равновесия в сторону продуктов реакции гидролиз проводят в присутствии щелочи. Французский химик М. Бертло в 1854 г. осуществил реакцию этерификации и впервые синтезировал жир. Следовательно, гидролиз жиров (как и других сложных эфиров) протекает обратимо. Уравнение реакции можно упрощенно записать так:
В живых организмах происходит ферментативный гидролиз жиров. В кишечнике под влиянием фермента липазы жиры пищи гидролизуются на глицерин и органические кислоты, которые всасываются стенками кишечника, и в организме синтезируются новые жиры, свойственные данному организму. Они по лимфатической системе поступают в кровь, а затем в жировую ткань. Отсюда жиры поступают в другие органы и ткани организма, где в процессе обмена веществ в клетках опять гидролизуются и затем постепенно окисляются до оксида углерода (IV) и воды с выделением энергии, необходимой для жизнедеятельности. В технике гидролиз жиров используют для получения глицерина, высших карбоновых кислот, мыла.
|
||||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 136; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.01 с.) |