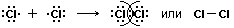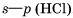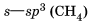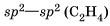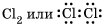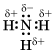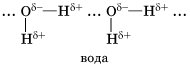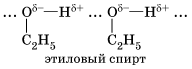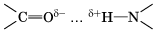Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химическая связь – ионная и ковалентная.
Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы. Различают четыре типа химических связей: ионную, ковалентную, металлическую и водородную. Ионная химическая связь Ионная химическая связь – это связь, образовавшаяся за счет электростатического притяжения катионов к анионам. Атомы, присоединившие «чужие» электроны, превращаются в отрицательные ионы, или анионы. Атомы, отдавшие свои электроны, превращаются в положительные ионы, или катионы. Понятно, что между анионами и катионами возникают силы электростатического притяжения, которые и будут удерживать их друг около друга, осуществляя тем самым ионную химическую связь. Так как катионы образуют в основном атомы металлов, а анионы – атомы неметаллов, логично сделать вывод, что этот тип связи характерен для соединений типичных металлов (элементы главных подгрупп I и II групп, кроме магния Mg и бериллия Be) с типичными неметаллами (элементы главной подгруппы VII группы). Классическим примером является образование галогенидов щелочных металлов (фторидов, хлоридов и др.). Например, рассмотрим схему образования ионной связи в хлориде натрия:
Два разноименно заряженных иона, связанные силами притяжения, не теряют способности взаимодействовать с противоположно заряженными ионами, вследствие чего образуются соединения с ионной кристаллической решеткой. Ионные соединения представляют собой твердые, прочные, тугоплавкие вещества с высокой температурой плавления. Растворы и расплавы большинства ионных соединений – электролиты. Такой тип связи характерен для гидроксидов типичных металлов и многих солей кислородсодержащих кислот. Однако при образовании ионной связи не происходит идеального (полного) перехода электронов. Ионная связь является крайним случаем ковалентной полярной связи
Рисунок 1. Кристаллическая решетка хлорида натрия, состоящая из противоположно заряженных ионов натрия и хлорид-ионов
В ионном соединении ионы представлены как бы в виде электрических зарядов со сферической симметрией электрического поля, одинаково убывающего с увеличением расстояния от центра заряда (иона) в любом направлении (рис. 1). Поэтому взаимодействие ионов не зависит от направления, то есть ионная связь, в отличие от ковалентной, будет ненаправленной.
Ионная связь существует также в солях аммония, где нет атомов металлов (их роль играет катион аммония
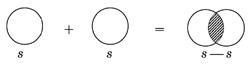
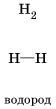
Ковалентная химическая связь – это связь, возникающая между атомами за счет образования общих электронных пар. Механизм образования такой связи может быть обменный или донорно-акцепторный. Обменный механизм действует, когда атомы образуют общие электронные пары за счет объединения неспаренных электронов. Например: 1. Н2 – водород:
2. Связь возникает благодаря образованию общей электронной пары s -электронами атомов водорода (перекрыванию s -орбиталей):
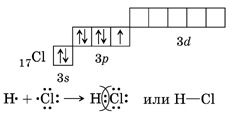
3. HCl – хлороводород:
4. Связь возникает за счет образования общей электронной пары из s - и p -электронов (перекрывания s – p -орбиталей):
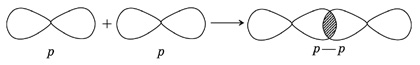
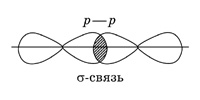
5. Cl2 – в молекуле хлора ковалентная связь образуется за счет непарных p -электронов (перекрывания p – p -орбиталей):
6. N2 – в молекуле азота между атомами образуются три общие электронные пары:
По способу перекрывания электронных орбиталей различают σ- и π-ковалентные связи (сигма- и пи-). В молекуле азота одна общая электронная пара образуется за счет σ-связи (электронная плотность находится в одной области, расположенной на линии, соединяющей ядра атомов; связь прочная).
Две другие общие электронные пары образуются за счет π-связей, то есть бокового перекрывания p -орбиталей в двух областях; π-связь менее прочна, чем σ-связь.
В молекуле азота между атомами существует одна σ-связь и две π-связи, которые находятся во взаимно перпендикулярных плоскостях (так как взаимодействуют 3 неспаренных p -электрона каждого атома). Следовательно, σ-связи могут образовываться за счет перекрывания электронных орбиталей:
а также за счет перекрывания «чистых» и гибридных орбиталей.
По числу общих электронных пар, связывающих атомы, то есть по кратности, различают ковалентные связи:
1. одинарные:
2. двойные:
3. тройные:
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть неполярной и полярной. При неполярной ковалентной связи общие электронные пары не смещены ни к одному из атомов, так как эти атомы имеют одинаковую электроотрицательность (ЭО) – свойство оттягивать к себе валентные электроны от других атомов. Ковалентную химическую связь, образующуюся между атомами с одинаковой электроотрицательностью, называют неполярной. Например:
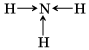
то есть посредством ковалентной неполярной связи образованы молекулы простых веществ-неметаллов. Значения относительной электроотрицательности фосфора и водорода практически одинаковы: ЭО (Н) = 2,1; ЭО (Р) = 2,1, поэтому в молекуле фосфина PH3 связи между атомом фосфора и атомами водорода ковалентные неполярные. Ковалентную химическую связь между атомами элементов, электроотрицательности которых различаются, называют полярной. Например: аммиак
Азот – более электроотрицательный элемент, чем водород, поэтому общие электронные пары смещаются к его атому.
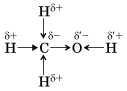
В метаноле CH3OH:
ЭО(O) > ЭО(C) > ЭО(H) 6. Химическая связь - металлическая связь и водородная Металлическая связь Связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке, называют металлической. Такая связь характеризуется небольшим числом валентных электронов и большим числом свободных орбиталей, что характерно для атомов металлов. Схема образования металлической связи (М – металл):
Наличием металлической связи обусловлены физические свойства металлов и сплавов: твердость, электрическая проводимость и теплопроводность, ковкость, пластичность, металлический блеск. Вещества с металлической связью имеют металлическую кристаллическую решетку. В ее узлах находятся ионы или атомы металла, между которыми свободно (в пределах кристалла) перемещаются электроны («электронный газ»).
Водородная связь Химическую связь между положительно поляризованными атомами водорода одной молекулы (или ее части) и отрицательно поляризованными атомами сильно электроотрицательных элементов, имеющих неподеленные электронные пары (F, О, N и реже Сl и S) другой молекулы (или ее части), называют водородной. Механизм образования водородной связи имеет частично электростатический, частично донорно-акцепторный характер. Примеры межмолекулярной водородной связи:
При наличии такой связи даже низкомолекулярные вещества могут быть при обычных условиях жидкостями (спирт, вода) или легко сжижающимися газами (аммиак, фтороводород). В биополимерах – белках (вторичная структура) имеется внутримолекулярная водородная связь между карбонильным кислородом и водородом аминогруппы:
Вещества с водородной связью имеют молекулярные кристаллические решетки.
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 62; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.196.171 (0.024 с.) |
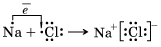

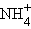 – NH4Cl, (NH4)2SO4, и в солях, образованных органическими основаниями – аминами (например, в хлориде метиламмония – [CH3NH3]+Cl– и т. д.).
– NH4Cl, (NH4)2SO4, и в солях, образованных органическими основаниями – аминами (например, в хлориде метиламмония – [CH3NH3]+Cl– и т. д.).