
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Внутриклеточный транспорт рецепторов
Это новый материал, обсуждается в очень специальной литературе. Прежде, чем разобраться с тем, как это каметоподобное движение ацетилхолиновых рецепторов может повлиять на депрессию (депрессия - модель пластичности на командных нейронах беспозвоночных, которые обеспечивают реакцию избегания). В предыдущей лекции -участие микротрубочек и отчасти моторов миозина 4-5 на актиновые нити, а также предложенное Пивоваровым нарушение кластеризации рецепторов, которые сосредоточены в субсинаптической мембране, может быть вызвано разными причинами - какие-то изменения транспортных систем. Все выполняем на моделях и исключаем те или иные механизмы, но есть еще один механизм, который не был разобран, он тоже связан с актиновыми нитями, связан с системой транспорта, но вещь особенная. Прежде, чем перейти к изложению, необходимо дать общую характеристику цитоскелета, разобраться, как он функционирует, как он формирует различные мембранные образования, в частности, дендритические шипики.
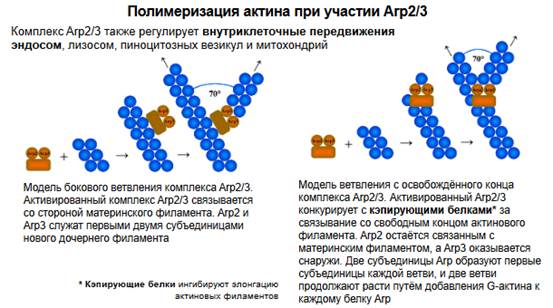
Мы знаем, что актиновые нити растут, а рост этот заключается в полимеризации, то есть отдельные молекулы цепляются одна за другую и, соответственно, прорастают (?). Полимеризация идет до тех пор, пока регулирующие механизмы не остановят эту полимеризацию. И вот мы, собственно, немножко об этом поговорим. Перед нами на слайде схематичное изображение комплекса Arp2/3, это 7 различных субъединиц, ключевые части комплекса (оранжевая и голубая) - Arp2 и Arp3 на рисунке, остальные вспомогательные. Комплекс является наиболее крупным компонентом актинового цитоскелета и имеется в большинстве клеток, которые обладают актиновым цитоскелетом. Актин необходим для обеспечения некой жесткости постсинаптических мембран, не только постсинаптических, мы сейчас говорим о субсинаптической мембране, которая содержит рецепторы. Актиновый цитоскелет обеспечивает структурную стабильность дендритических шипиков. Если происходят какие-то события в цитоскелете, то это совершенно однозначно меняет характеристики шипиков, их морфологию. Две его субъединицы ARP2 и ARP3 (Actin-Related Proteins —родственные актину белки) по структуре близки к мономерному актину (к мономеру актиновых нитей) и служат сайтами нуклеации для новых актиновых филаментов. Нуклеация - это образование неких стабильных структур в органических молекулах, точка нуклеации - это полимеризация. Если болтающаяся актиновая молекула приобретает это свойство (нуклеация), вернее, она цепляется за сайт нуклеации, то она уже входит в состав новых растущих актиновых филаментов. Комплекс Arp2/3 прикрепляется сбоку к исходному («материнскому») филаменту и инициирует рост нового бокового («дочернего») филамента под характерным углом 70° к исходному филаменту, угол определяется молекулярными взаимодействиями. От этой точки как бы отрастает ветка, так же как отрастает ветка, например, от основного ствола дерева. В результате нуклеации таких дочерних филаментов формируется разветвлённая актиновая сеть. Регуляция перестроек актинового цитоскелета важна для таких процессов, как передвижение клетки, фагоцитоз и внутриклеточные перемещения липидных везикул. Липидные везикулы, понятно, могут каким-то образом передвигаться, но при этом передвигаются не только липидные везикулы, но и белковые молекулы, которые ассоциированы с этими везикулами. Подобный дополнительный материал очень важен для понимания, что из себя представляет каметоподобное движение рецепторов, белковых молекул в субсинаптической мембране.
Комплекс Arp2/3 также регулирует внутриклеточные передвижения эндосом, лизосом, пиноцитозных везикул и митохондрий. То есть все внутриклеточные структуры не плавают в растворе, а передвигаются за счет актиновых нитей.
Справа модель дихотомического ветвления. То есть один из участников комплекса заменяет как бы один мономер в филаменте и отсюда начинается его ветвление. Воспримем это как аксиому, потому что это хорошо изучено. Таким образом формируются боковые ветки и дихотомическое ветвление.
Пример. Синим показаны эти комплексы, от которых уже отрастают новые филаменты. Взято из русскоязычной статьи, в которой много ссылок на первоисточники, Латанов взял из этой статьи описание участия актиновых филаментов в движении бактерий. Бактерия Listeria использует полимеризацию актина для передвижения в клетке хозяина, бактерия активирует полимеризацию с помощью своего белка ActA. С белком ActA ассоциирован комплекс Arp 2/3, который садится на этот белок и обеспечивает рост. В результате роста актиновой нити эта бактерия может двигаться: растет филамент на конце, а бактерия отдаляется от комплекса Arp 2/3, то есть растет в сторону от комплекса, комплекс актиновый ее толкает. На слайде справа в маленьком окошке изображены схематично кометообразные следы, хвосты комет -это нити филаментов. Таким образом двигаются бактерии внутри клетки-хозяина. Таким же образом могут двигаться везикулы и внутриклеточные элементы.
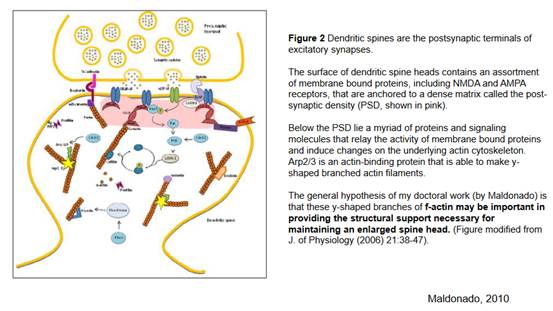
Благодаря таким актиновым нитям (здесь описание из работы Мальдонадо) обеспечивается структурная жесткость субсинаптической мембраны, в которой локализованы постсинаптические рецепторы. Из написанного на слайде важно знать, что f-актин (красненькие нити на слайде) могут быть важны для обеспечения структурной поддержки, что необходимо для роста головки шипика. Шипик изображен на слайде. То есть актиновые нити как бы выталкивают, делают своеобразный пузырек из мембраны, и своим ростом обеспечивают поддержку и формирование головки шипика, обеспечивая ее жесткость. Понятно, что в шипике происходят все молекулярные процессы, как и в теле клетки.
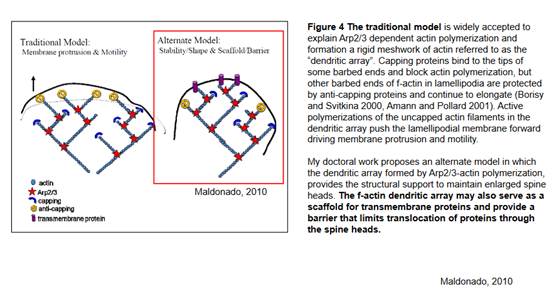
На слайде предлагается две модели. Первая модель слева на картинке - обеспечивает мембранное выпячивание и, собственно, движение вот этой вот мембраны. В работе была предложена вторая модель (справа на картинке) - актиновые компоненты, актиновые комплексы Arp2/3 служат не только для разрастания мембраны и формирования головки шипика, но так же могут быть барьером, то есть как бы укрепляют мембрану, и обеспечивают относительную неподвижность белковых молекул рецепторов на мембране, то есть актиновый цитоскелет препятствует утеканию этих рецепторов из этой области, ограничивают перемещение рецепторов на головке шипика. Для нас важно - эти элементы активно используются для поддержания структуры, если мы на них подействуем каким-то образом, что мы получим? А что это за воздействие будет? Во-первых, можно воздействие моделировать. Во-вторых, эти действия происходят при естественной активации постсинаптической клетки через синапс, через пресинаптический элементы. Ну и для нас важно, что мы сейчас будем рассматривать нашу модель депрессии и эта модель депрессии может каким-то образом, ожидается, повлиять на стабильность рецепторов на мембране. Это основная идея этого куска работы Пивоварова и он допустил, предположил, что эти пластические перестройки в синапсе,кроме тех, которые мы рассмотрели, могут касаться и комплекса Arp2/3, который поддерживает стабильность молекул. Был задан вопрос - а не меняется ли состояние актинового каркаса во время депрессии? Каким образом это можно доказать - использовать специальные блокаторы и посмотреть, если мы заблокируем - мы устраним депрессию или нет? Если мы эту депрессию устраняем, то эти элементы играют очень большую роль в обеспечении этого процесса.
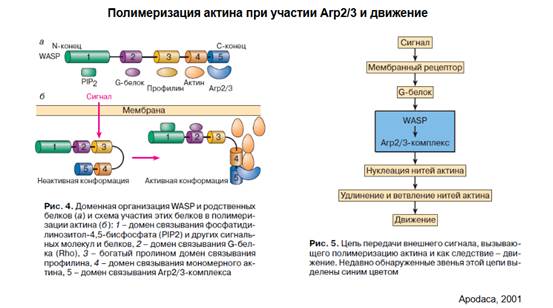
Продолжая предыдущую иллюстрацию, этот слайд. Здесь англоязычная ссылка, но она была пересказана в русскоязычной работе. Слева показана общая схема. Комплекс на рис. 4 а - WASP, на его конце - наш индуктор Arp2/3, две субъединицы (Arp2 и Arp3) - индукторы полимеризации актина. На схеме - как все происходит. PIP2 - это сигнальные элементы, если поступает какой-то сигнал на клетку, мембранный рецептор (PIP2???) сообщает G-белку, и определенный G-белок обеспечивает начало этой полимеризации. После активации комплекса WASP (это доменная организация WASP и родственных белков), активируется комплекс нуклеации Arp2/3, происходит нуклеация нитей актина, то есть начало полимеризации, удлинение и, может быть, ветвление, и, собственно, движение. И вот это вот движение может каким-то образом повлиять и на наши рецепторы, они могут тоже передвигаться.
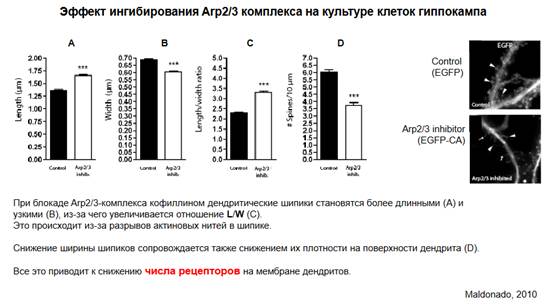
В этом эксперименте эффект ингибирования этого Arp2/3 комплекса на культуре клеток гиппокампа. Воздействие на клетку кофиллином. Есть флуоресцентный краситель с кофиллином - EGFP-CA, EGFP - обозначение красителя без кофиллина. Что дает нам этот краситель - он отражает морфологию шипиков, поскольку он садится на актиновые нити. Что происходит в присутствии кофиллина (кофиллин сам мы видеть не можем, но мы видим его активность по красителю) - здесь 4 эффекта на графиках. А - по оси у - длина шипика, длина от основания до его верхушки, В - по оси у - ширина шипика, поперечный размер шипика. Длина и ширина в микронах. С - по оси у - отношение длины к ширине. Д - по оси у - число шипиков на площади 10 квадратных микрон.
Смотрим, как кофиллин влияет на эти параметры. Кофиллин блокирует комплекс Arp2/3, то есть он разрывает актиновые нити, устраняет активность этого комплекса, который обеспечивает поддержку в том числе и разрастание этих актиновых нитей. Белые столбики - данные при блокаде. При блокаде комплекса Arp2/3 шипики становятся более длинными в сравнении с нормой - фрагмент А. Фрагмент В - шипик становится более узким, незначительное снижение (0,7 микрон в контроле и 0,6 микрон при блокаде), но если мы возьмем отношение длины к ширине - фрагмент С - видим значительные изменения, то есть становятся шипики более узкими и длинными. Фрагмент Д - снижение ширины шипиков сопровождается снижением их плотности на поверхности дендрита (ниже примерно в 1,8 раза). Что значит то, что поверхность шипиков уменьшается и число шипиков снижается? Это значит, что снижается количество постсинаптических рецепторов на постсинаптической мембране, на мембране шипиков => снижение числа рецепторов на мембране дендритов. Эти представления можно перенести и на клетки беспозвоночных, у которых нет шипикового аппарата, но, тем не менее, процессы, которые мы здесь рассмотрели, могут тоже привести к снижению числа рецепторов, поскольку уменьшается субсинаптическая мембрана (соответственно, плотность рецепторов тоже может уменьшиться).
К данному слайду, видимо, следует прочесть просто описание на слайде, которое согласуется со всеми предыдущими словами, но я законспектировала этот кусок лекции. После этих описаний того, что может быть, рассматриваем результат, который может быть получен в экспериментах Пивоварова. Внутриклеточный транспорт рецепторов с участием актиновых микрофиламентов без миозиновых моторов: «кометоподобное» движение. Были использованы два вещества - Wiskostatin и CK-636 - это блокаторы регуляторов полимеризации актина (WASP family regulators), эти вещества устраняют полимеризацию актина и устраняют транспорт этих молекул. Если мы устраним этот транспорт, то, ожидаемо, наша субсинаптическая мембрана остается стабильной. Мы в норме (если мы никак не влияем на этот процесс), получаем контрольные значения. Если мы повлияем на рост актиновых филаментов и если наша мембрана будет более стабильна, мы ожидаем, то что депрессия усилится. Усиливается депрессия за счет того, что мы кометообразное движение устраняем, то есть наши молекулы никуда не смещаются (буквально к предыдущему слайду он говорил, что если мы блокируем Arp 2/3 и WASP, то у нас из-за того, что актиновый цитоскелет стабилизирует рецепторы на мембране, эти же самые рецепторы остаются без якоря и их количество на мембране уменьшается). И такой вот результат был получен. При блокаде регуляторов полимеризации мы устраняем кометообразное движение и депрессия становится более глубокой при сравнении с контролем при применении блокаторов Wiskostatin и CK-636. Пивоваров всегда применял два блокатора для того, чтобы убедиться в том, что воздействие ровно такое, какое и предполагали. Ну и действительно, эти предположения подтвердились. Смотрим на графики - на длительное время усиливается блокада, соответственно, наши синапсы более стабильны, постсинаптическое утолщение более стабильно. Применялось и другое вещество с противоположными свойствами - это CK-548 - стимулятор полимеризации актина. Ожидалось, что ацетилхолиновые токи будут такие в контроле (смотрим на желтую линию на самый правый график) - нормальная депрессия без вмешательства, но если мы усилим рост актиновых нитий путем их активации, то мы увидим снижение этой депрессии, поскольку мы активируем вот это кометообразное движение. В работе Мальдонадо было высказано предположение, что полимеризация актина поддерживает и обеспечивает синапс структурно и вызывает увеличение рецепторов, увеличение головки шипика, что приводит к разрастанию шипика и увеличению количества рецепторов, а если много рецепторов, то мы получим меньшую депрессию (рецепторов стало больше и они обеспечивают вполне стойкую реакцию), то есть депрессия сильно уменьшалась. Видим, что блокаторы и стимуляторы полимеризации актина показали разный эффект => депрессия может во многом определяться кометообразным движением.
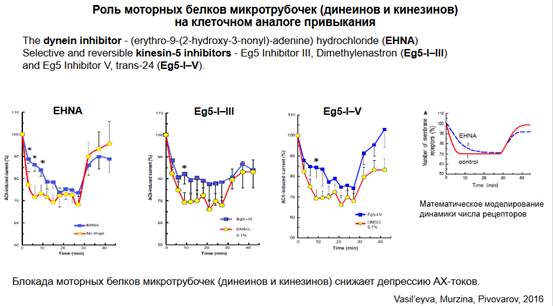
Роль моторных белков микротрубочек на клеточном аналоге привыкания. Динеины и кинезины. Здесь как раз было показано, какой эффект оказывает блокада с участием моторных белков (на предыдущем слайде разбирали, что происходит без их участия). Оказалось, что использование ингибиторов динеина (EHNA) и кинезина (Eg5-I-III и Eg5-I-V) приводит к снижению депрессии. Мы устраняем транспорт по микротрубочкам и больше рецепторов остается. Не везде есть статистически достоверные отличия, но, тем не менее, эффект есть. На основании этих результатов были построены математические модели - кривые, которые, в общем, хорошо демонстрируют этот эффект.
Теперь давайте посмотрим, какие были проведены эксперименты для того, чтобы доказать, что это действительно так.
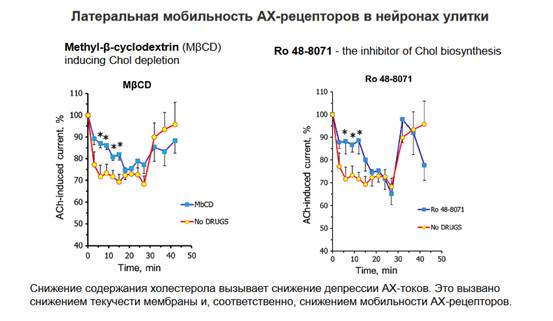
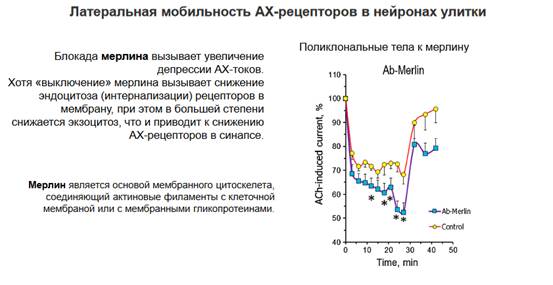
Кроме тех молекул, которые мы рассмотрели, надо посмотреть на мембрану, какие еще есть компоненты в мембране, которые так же определяют ее состояние, в частности жесткость и тот процесс, который связан с разжижением. В этом процессе участвует холестерол, холестерол входит в состав всех мембран и составляет 25% от общего веса фосфолипидов. Холестерол необходим для того, чтобы мембрана была достаточно пластична и это важно для кометоподобного движения, потому что если мы эту пластичность устраним, то латеральная диффузия у нас существенно снизится. Есть еще два белка, которые тоже обеспечивают стабильность мембраны - это спектрин и мерлин. Использовались их блокаторы - это поликлональные антитела, которые блокировали эти белки. Спектрин – белок цитоскелета, который выстилает внутреннюю сторону плазматической мембраны клеток. Спектрин формирует длинные молекулы структурной сетки и поддерживает целостность клеточной мембраны и структуры цитоскелета, то есть фактически склеивает и обеспечивает структуру цитоскелета. Мерлин является основой мембранного цитоскелета, соединяющий актиновые филаменты с клеточной мембраной или с мембранными гликопротеинами. Спектрин выстилает, а мерлин обеспечивает взаимодействие - соединяет актиновые нити со спектрином. В статье описано использование блокаторов холестерола, то есть уменьшение содержания холестерола в мембране и блокировали структурные белки (спектрин и мерлин). Снижение холестерола в мембране снижало ее текучесть, она становилась более жесткой. А если влияли на структурные белки, то это обеспечивало нарушение сцепления мембраны с внутриклеточным содержимым и снижение эффектов с растеканием белковых молекул, так как это снимало связь с актиновыми филаментами => рецепторы на постсинаптической мембране более стабильны (если мы убираем захват рецептора обратно в клетку это еще не значит, что рецепторы без привязки к цитоскелету никуда не поплывут, корректнее было бы сказать, что они становятся менее стабильными в плане локализации на мембране, но более стабильными относительно экзоцитоза).
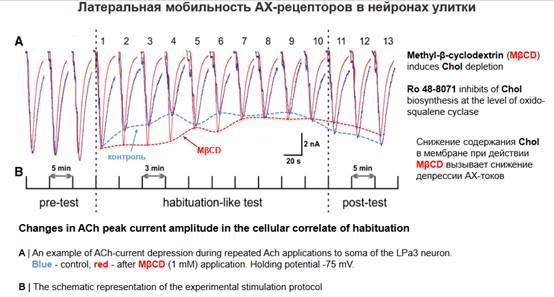
Смотрим на все это на модели. В этой модели использовались два блокатора Methyl-β-cyclodextrin (MβCD) и Ro 48-8071 - приводили к снижению содержания холестерола. Модель - по оси у - амплитуда тока, ось х - интервал между отдельными стимуляциями, аппликация ацетилхолина на поверхность рецептора командных нейронов, обеспечивающих реакцию избегания. В течение 5 минут происходит полное восстановление наших токов, то есть при межстимульном интервале 5 минут токи не меняются. Синие линии на рисунке - контроль. Красная линия - блокада холестерола. Если мы применяем 3-минутный интервал в контроле - видим, что за это время мембрана не успевает восстановить свои свойства и получается, что эта активная стимуляция - через 3 минуты аппликация ацетилхолина приводит к депрессии ответа, к привыканию, которая длится до тех пор, пока мы не восстановим исходный 5-минутный интервал. В контроле мы получаем депрессию - огибающая снизу пунктирная синяя линяя. Если мы подействуем на холестерол - мы получим существенное снижение депрессии - огибающая снизу пунктирная красная линия, эффекта депрессии нет, потому что мы стабилизируем нашу мембрану и она успевает восстанавливаться, хотя спустя какое-то количество (после 6 интервалов) депрессия все-таки отмечается, но начальная фаза фактически исчезает, по крайней мере эта депрессия замедляется, то есть мы на нее подействовали.
Давайте посмотрим на суммарные графики. Те эффекты, которые мы рассмотрели, то есть устранение депрессии или ее замедление, демонстрируются на этих графиках. При блокаде холестерола депрессия существенно снижается, то есть мы как бы сняли эту миграцию молекул, больше молекул осталось, соответственно, токи тоже в процентном отношении уменьшились.
Теперь поликлональные тела к спектрину. Здесь обратный такой процесс - блокада холестерола стабилизирует мембрану, а вот мерлин и спектрин поддерживают как бы целостность и обеспечивают стабильное состояние мембраны. Если мы эту стабильность устраним, то есть заблокируем функции спектринов, то блокада спектрина вызывает увеличение депрессии и вызвано это снижением экзоцитоза - если мы нарушаем связь между плазматической мембраной со своими белковыми рецепторами и с молекулами, которые обеспечивают встраивание новых рецепторов, в данном случае мы влияем на процесс рециклирования, то есть возвращение наших рецепторов в постсинаптическую мембрану или встраивание новых рецепторов, которые синтезировались, и за счет мобильности ацетилхолиновые рецепторы могут покидать постсинаптическое уплотнение. Здесь важно иметь в виду, что состояние рецепторов не стабильно в мембранах и они подвергаются, как мы рассмотрели в предыдущих лекциях, постоянному обновлению - это все включает эндоцитоз, их извлечение из мембраны и встраивание новых рецепторов. Соответственно, если мы повлияем на экзоцитоз, то мы замедлим встраивание новых рецепторов и это приведет к истощению или по крайней мере уменьшению числа рецепторов в мембране, в конечном счете это вызовет более стойкую депрессию, что мы и наблюдаем на графике.
Аналогичный эффект обеспечивает блокада мерлина, поскольку так же, как в случае спектрина мы устраняем взаимодействие мембраны с содержимым клетки. Выключение мерлина вызывает снижение эндоцитоза рецепторов, при этом в большей степени снижается экзоцитоз, что и приводит к снижению ацетилхолиновых рецепторов в синапсе. Спектрин влияет просто на экзоцитоз, а мерлин влияет на соотношение эндоцитоза и экзоцитоза, получается, что экзоцитоз подавляется в большей степени, это все приводит к дефициту рецепторов ацетилхолина (не очень понятно, каким образом, если мы все же блокируем экзоцитоз сильно, рецепторы остаются в мембране, по сути) и мы получаем примерно такой же эффект - видим глубокое подавление почти до 50% и в случае спектрина, и в случае мерлина. Показали влияние других компонентов синапса на его жесткость и связь с процессами экзоцитоза и эндоцитоза.
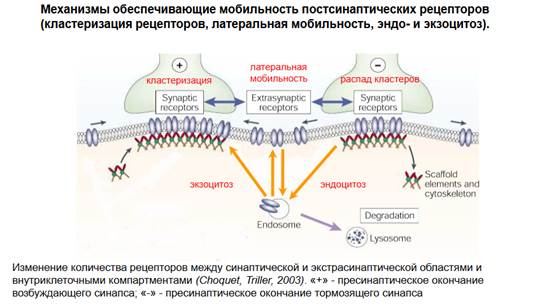
Наши рецепторы могут уходить из подсинапса и на этот процесс можно повлиять и структурные элементы цитоскелета и цитоскелет могут разрушаться, нарушаться, что вызывает смещение рецепторов по мембране. А если структурные элементы как-то удаляются из мембраны - они заблокированы. Если они добавляются - напротив, то здесь получается такая кластеризация рецепторов. Есть распад кластеров и есть формирование кластеров и наблюдается миграция - латеральная мобильность рецепторов.
Одно дело определить это все с помощью блокаторов, но хорошо бы все это дополнить визуализацией, то есть увидеть все это на живом нейроне без блокаторов. Надо показать, что рецепторы мобильны.
Эксперимент был выполнен на конфокальном микроскопе. И как раз было продемонстрировано движение рецепторов. Конфокальный микроскоп позволяет видеть живую ткань и, используя различные флуоресцентные метки, можно зарегистрировать движение помеченных молекул. Так как рецепторы расположены на мембранах - надо было увидеть эту мембрану, каким-то образом повлиять на метку. Помечались белковые молекулы ацетилхолиновых рецепторов булгаротоксином.
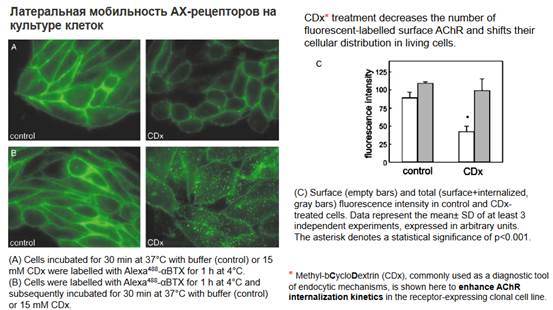
Результат эксперимента не связан с вопросами пластичности, это просто исследование концентрации рецепторов, в частности, ацетилхолиновых. В исследовании были помечены ацетилхолиновые рецепторы и исследован эффект холестерола. В этой работе было показано, что уменьшение концентрации холестерола в мембране обеспечивает мобильность рецепторов без пластичности. Исследования на флуоресцентном микроскопе.
Использовали два агента. Буфер - это вещество, которое ничего не меняет. Выдерживали 30 минут при температуре 37 градусов в буфере - это контроль. Подсвечивали ацетилхолиновые рецепторы (скорее всего, на беспозвоночных). Далее в течение часа при температуре 4 градуса на клетку влияли 15 милимолярной концентрацией метил-циклодекстрина (он влияет на эндоцитоз и усиливает захват ацетилхолиновых молекул из клетки). Демонстрация метода конфокальной микроскопии, с помощью которого можно увидеть при стимуляции эндоцитоза, снижение количества ацетилхолиновых рецепторов в мембране. При применении цитклодекстрина мы получаем уменьшение флуоресценции - это означает, что в мембране осталось меньше ацетилхолиновых рецепторов. Для контроля сделали обратную последовательность. Сначала клетку держали при декстрине, а затем отмыли от декстрина и инкубировали в буфере. При декстрине ацетилхолиновых рецепторов мало, а при замене его на буфер восстановилась флуоресценция.
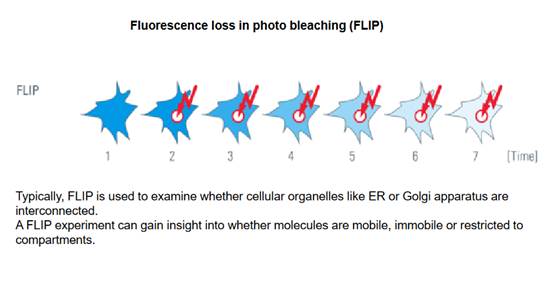
Далее - эксперимент Пивоварова будет. Рассмотрим только один вариант эксперимента, когда мы применяем фотобличинг (фотообесцвечивание) - если лазером действуем на краситель, то он теряет свои свойства флуоресценции, если мы оставим наш объект в течении какого-то времени без всякого влияния после обесцвечивания, то смотрим, восстанавливается ли окраска - если окраска восстанавливается, то значит, на это место в клетке приходят другие молекулы из окрестности этой клетки. Такая визуализация демонстрирует кометоподобное движение, то есть без миозиновых моторов.
Вот так выглядит этот эксперимент. Сначала через некоторый момент времени в какой-то части клетки наши молекулы, в какой-то части объекта измеряют флуоресценцию. В данном случае здесь светится весь объект, этот объект весь обработан флуоресцентной меткой и получается равномерный окрас. Спустя какое-то время мы обеспечиваем обесцвечивание - просто светим лазером в какую-то точку, после обесцвечивания видим на этом месте прозрачный пузырек - то есть на этом месте мы обесцветили все молекулы. Смотрим, что происходит. Постепенно флуоресценция восстанавливается. Это означает, что в это место приходят другие молекулы из окрестностей и, в конечном счете, это слепое пятнышко исчезнет или не исчезнет, поскольку кометоподобное движение достаточно медленное, а в течение длительного времени трудно удержать объект под конфокальным микроскопом.
Вот то, что нам интересно и нужно. Мы применяем этот метод (есть и другие методы, которые применяются для исследования мобильности). Кроме обесцвечивания есть еще и фотоактивация, которая позволяет увидеть, как молекулы, активированные в одной области, растекаются по окрестностям.
Здесь двойная метка еще. Это вариация этого метода.
Вот результат Пивоварова. Пример миграции рецепторов. 0 секунд - до обесцвечивания, видим сплошную пограничную область клетки и межклеточного пространства. Светятся ацетилхолиновые рецепторы. 4 секунды - обесцветили клетку в этот момент, флуоресценция стала в этой области существенно ниже. Смотрим, что дальше произойдет. Вот 16 секунд - особых изменений нет. От 32 секунд и дальше восстанавливается светимость. Это означает, что поскольку наша флуоресцентная метка обесцвечена и не функциональна, сюда (в обесцвеченную область) приходят другие молекулы) - они могут приходить со стороны не обесцвеченных интактных участков. Это восстановлении флуоресценции отражается кривой справа. Это является доказательством кометоподобного движения молекул, которое, как мы показали, участвует в пластичности нейронов.
Это все были беспозвоночные. И в том же 2017 году была в нейчер статья, что в гиппокампе, для LTP необходима диффузия AMPA-рецепторов. Было показано, что мобильность AMPA-рецепторов (рецепторы, которые и обеспечивают, собственно, потенциацию), активация их рециклирования (возвращения в мембрану) обеспечивает LTP.
|
||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 36; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.238.20 (0.007 с.) |



 Сейчас рассмотрим материал, который не имеет отношение к процессам пластичности, но в этом материале рассматривается возможные механизмы изменения и модификации дендритических шипиков. Рассмотрим, как можно повлиять на эти вот активные элементы и посмотреть, как они могут измениться. Здесь мы используем кофиллин - является одним из первичных белков, который разрывает актиновые нити. Если мы активируем кофиллин, его активация является ранним событием в миграции клеток. Речь идет про клетки, но мы имеем в виду, что и клетки могут двигаться благодаря миграции мембран клеток, миграции бактерий внутри клеток и внутриклеточных органелл, это более общий вопрос. Кофиллин разрывает актиновые нити, то есть он нарушает стабильность шипика.
Сейчас рассмотрим материал, который не имеет отношение к процессам пластичности, но в этом материале рассматривается возможные механизмы изменения и модификации дендритических шипиков. Рассмотрим, как можно повлиять на эти вот активные элементы и посмотреть, как они могут измениться. Здесь мы используем кофиллин - является одним из первичных белков, который разрывает актиновые нити. Если мы активируем кофиллин, его активация является ранним событием в миграции клеток. Речь идет про клетки, но мы имеем в виду, что и клетки могут двигаться благодаря миграции мембран клеток, миграции бактерий внутри клеток и внутриклеточных органелл, это более общий вопрос. Кофиллин разрывает актиновые нити, то есть он нарушает стабильность шипика.









 Далее слайды Латанов пролистал, просто сказал, что есть обратная задача.
Далее слайды Латанов пролистал, просто сказал, что есть обратная задача.






