Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторная работа 6. Определение подвижности ионов методом электрофореза на бумаге.Содержание книги
Поиск на нашем сайте
Цель работы: 1. Изучить теоретические основы электрофореза. 2. Овладеть методом электрофореза на бумаге для определения подвижности ионов. 1. Осознать возможности применения электрофореза в биологии и медицине. Оборудование: 1. Установка для определения подвижности ионов. 2. Растворы электролитов 1. Стеклянная подложка. 2. Фильтровальная бумага. 3. Индикаторная бумага. 4. Нить. 5. Секундомер. 6. Источник постоянного напряжения (электрощит). Контрольные вопросы 1. Электрофорез, электрофорез лекарственных веществ, применение в биологии и медицине. 2. Электролиты. Электролитическая диссоциация. Механизм электоролитической диссоциации. 3. Природа тока в электролитах. Электролиз. Первичные и вторичные реакции на электродах. 4. Электрохимическая поляризация. ЭДС поляризации. 5. Неполяризующиеся электроды. 6. Подвижность ионов, физический смысл, единицы измерения. 7. Рабочая формула для определения подвижности ионов (вывод). 8. Методика определения подвижности ионов методом электрофореза на бумаге. 9. Расчет погрешностей измерений (применение производной и дифференциала функции) Теоретические сведения Электрофорезом называется явление движения в жидкой среде заряженных взвешенных частиц под действием внешнего электрического поля. Явление электрофореза используют в биологии и медицине для разделения веществ, изучения подвижности клеток и субклеточных структур в постоянном электрическом поле, для исследования электрохимических свойств биологических тканей и их поверхностей. Электрофорез применяется при анализе смесей коллоидов, например, полисахаридов, нуклеиновых кислот, определении белкового состава сыворотки крови (качественный анализ альбуминов,
Для лекарственного электрофореза применяют только те препараты, которые представляют собой растворы электролитов. Электролиты – это вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток. К электролитам относятся соединения с ионной или полярной ковалентной связью – соли, кислоты и основания. Распад электролитов на ионы при растворении их в воде называется электролитической диссоциацией. Рассмотрим механизм электролитической диссоциации на примере молекулы с полярной ковалентной связью – хлорида натрия (рис.1). Вокруг каждой полярной молекулы
В результате этого взаимодействия электронное облако смещается к атому с большей электроотрицательностью и полярная молекула превращается в ионную (рис. 18 б), связь между ионами
Жидкие среды организмов содержат слабые растворы различных электролитов, общая концентрация которых примерно эквивалентна 0.9% раствору хлорида натрия. Поэтому подобный раствор может служить моделью при изучении условий образования тока в тканях организма. Рассмотрим электролиз слабоконцентрированного водного раствора хлорида натрия (электроды угольные). При растворении в воде хлорид натрия диссоциирует на ионы натрия и хлора:
Атомы соединяются в молекулы Ионы хлора и гидроксила Таким образом, в рассмотренном случае первоначально на электродах в результате приема или отдачи электронов образуются атомы хлора и водорода, которые затем соединяются в молекулы ( Реакции на электродах, при которых ионы отдают или принимают электроны, превращаясь в атомы, называются первичными. Реакции, при которых атомы вступают в химическое взаимодействие с веществом электродов или растворителем, называются вторичными. Газы, выделившиеся на электродах, не проводят электричества. Поэтому появление на электродах пузырьков газа уменьшает поверхность соприкосновения электрода и электролита и, следовательно, увеличивает сопротивление раствора и этим способствует ослаблению тока, протекающего через электролит. Кроме этого, в цепи между электродами образуется концентрационная разность потенциалов (рис.20), возникающая вследствие различия скоростей движения ионов противоположного знака и изменения их концентрации около электродов. Образовавшаяся разность потенциалов у электродов называется ЭДС поляризации (
ся мелкими пузырьками газа. Если теперь электроды отключить от источника тока и присоединить непосредственно к гальванометру, то стрелка последнего отклонится, показывая наличие в цепи тока в направлении, обратном тому, в котором ток проходил под действии
где:
нервном волокне противоположный возбуждающему току
Чаще применяют цинковый и серебряный неполяризующиеся электроды. Цинковый электрод (рис. 23 а) состоит из цинкового стержня происходят следующие химические реакции. На аноде атомы цинка, отдавая электроны, превращаются в ионы:
Серебряные неполяризующиеся электроды обычно изготавливают из серебряной пластинки, покрытой электролитическим путем хлористым серебром. В постоянном электрическом поле на ионы в растворе электролита действуют две силы: сила со стороны электрического поля
(здесь
где
Подставляя в данное выражение формулы (2) и (3), получим:
откуда
Если обозначить
Коэффициент
Подвижность ионов характеризует скорость движения ионов в растворе электролита при напряженности электрического поля 1 В/м. Подвижность ионов зависит от природы иона; температуры, вязкости и концентрации раствора электролита. Подвижность ионов является величиной специфичной, характерной для различных ионов, поэтому по подвижности ионов можно определить вид иона или, если имеется смесь ионов, разделить их в электрическом поле. Чтобы определить подвижность ионов исследуемого электролита, необходимо знать скорость ионов и напряженность электрического поля Е, в котором они перемещаются. Скорость ионов при равномерном движении можно вычислить по формуле:
где Установим зависимость между напряженностью и разностью потенциалов электрического поля. Работа
где
Единицей измерения подвижности ионов является Выражение (11) является рабочей формулой для определения подвижности ионов методом электрофореза на бумаге. Преимуществом этого метода является простота, а недостатком - зависимость результата эксперимента от капиллярных свойств бумаги.
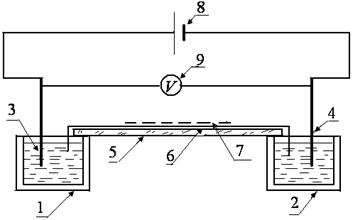
Установка для определения подвижности ионов (рис.24) представляет собой электролитические ванны (на схеме это сосуды 1 и 2), наполненные электролитом. В сосуды опущены электроды 3 и 4. На края сосудов помещают стеклянную подложку 5, на которую кладут фильтрованную бумагу 6, смоченную тем же электролитом, края которой должны быть опущены в ванны. Поверх фильтрованной бумаги кладут индикаторную бумагу 7, смоченную в растворе того же электролита. Нить смачивают в растворе электролита, содержащего ионы, подвижность которых определяют. Нить кладут поперек индикаторной бумаги. От источника постоянного напряжения 8 к электродам подводится напряжение, измеряемое вольтметром 9. Положительные и отрицательные ионы раствора при включенной установке придут в движение. С перемещением ионов движется и цветовая граница на индикаторной бума-
Рисунок 24 ге. Через определенное время установку отключают. И по результатам эксперимента определяют подвижность ионов.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 433; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.170.186 (0.013 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||

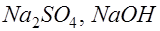 .
. и
и  глобулинов) /2/, анализа белкового состава желудочного сока и других биологических структур. Наибольшее практическое значение для медицины имеет электрофорез лекарственных веществ – это электрофармакологический метод, в основе которого лежит комплексное действие на организм постоянного тока (до 50 мА) и вводимых с его помощью ионов лекарственных веществ через кожу или слизистые оболочки. Метод электрофореза позволяет ввести ионы лекарственного вещества непосредственно в очаг поражения без повреждения кожных покровов и слизистых оболочек; не вызывает болезненных ощущений и не требует стерилизации. При лекарственном электрофорезе ионы лекарственного вещества проникают в глубокие слои подкожной клетчатки, медленно поступают в кровь и разносятся по всему организму, оказывая лечебное действие на ткани и клетки, наиболее чувствительные к вводимому препарату.
глобулинов) /2/, анализа белкового состава желудочного сока и других биологических структур. Наибольшее практическое значение для медицины имеет электрофорез лекарственных веществ – это электрофармакологический метод, в основе которого лежит комплексное действие на организм постоянного тока (до 50 мА) и вводимых с его помощью ионов лекарственных веществ через кожу или слизистые оболочки. Метод электрофореза позволяет ввести ионы лекарственного вещества непосредственно в очаг поражения без повреждения кожных покровов и слизистых оболочек; не вызывает болезненных ощущений и не требует стерилизации. При лекарственном электрофорезе ионы лекарственного вещества проникают в глубокие слои подкожной клетчатки, медленно поступают в кровь и разносятся по всему организму, оказывая лечебное действие на ткани и клетки, наиболее чувствительные к вводимому препарату.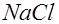 ориентируются диполи воды, которые своими отрицательными полюсами притягиваются к положительному полюсу молекулы
ориентируются диполи воды, которые своими отрицательными полюсами притягиваются к положительному полюсу молекулы 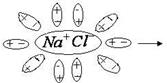
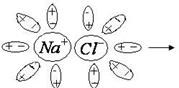
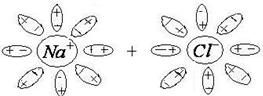
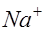 и
и 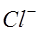 ослабевает. При столкновении молекулы электролита с быстро движущейся молекулой воды происходит разрыв связи между этими ионами
ослабевает. При столкновении молекулы электролита с быстро движущейся молекулой воды происходит разрыв связи между этими ионами 
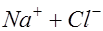 . В растворе имеется также некоторое количество диссоциированных молекул воды:
. В растворе имеется также некоторое количество диссоциированных молекул воды: 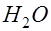
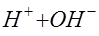 . Под действием приложенного напряжения ионы натрия и водорода
. Под действием приложенного напряжения ионы натрия и водорода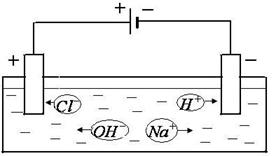
 .
.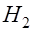 и выделяются в виде пузырьков газа. Ионы натрия вместе с остающимися в растворе ионами гидроксила образуют едкую щелочь:
и выделяются в виде пузырьков газа. Ионы натрия вместе с остающимися в растворе ионами гидроксила образуют едкую щелочь: 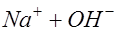
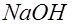 . Убыль из раствора ионов водорода восполняется путем диссоциации новых молекул воды.
. Убыль из раствора ионов водорода восполняется путем диссоциации новых молекул воды. движутся к аноду. Ионы хлора отдают электрон во внешнюю цепь и превращаются в атомы хлора:
движутся к аноду. Ионы хлора отдают электрон во внешнюю цепь и превращаются в атомы хлора: 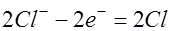 . Часть атомов хлора соединяется в молекулы
. Часть атомов хлора соединяется в молекулы 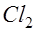 и выделяются в виде пузырьков газа на электроде. Другая часть атомов хлора реагирует с водой, образуя соляную кислоту
и выделяются в виде пузырьков газа на электроде. Другая часть атомов хлора реагирует с водой, образуя соляную кислоту 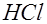 :
: 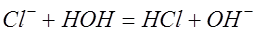 . Ионы гидроксила также отдают электроны во внешнюю цепь и образуют молекулы кислорода и воды:
. Ионы гидроксила также отдают электроны во внешнюю цепь и образуют молекулы кислорода и воды: 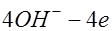

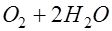 .
.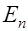 ). Величина ЭДС поляризации зависит от материала электродов, природы электролита и выделяющихся веществ на электродах.
). Величина ЭДС поляризации зависит от материала электродов, природы электролита и выделяющихся веществ на электродах.
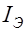 в рас- творе электролита имеет вид:
в рас- творе электролита имеет вид: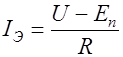 , (1)
, (1)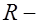 сопротивление электролита,
сопротивление электролита, 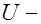 напряжение приложенное от внешнего источника питания. Однако ток может случайно увеличиться при отрыве пузырьков газа с поверхности электрода.
напряжение приложенное от внешнего источника питания. Однако ток может случайно увеличиться при отрыве пузырьков газа с поверхности электрода.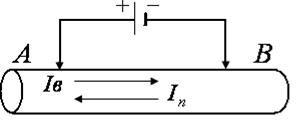
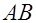 (рис. 22), ЭДС поляризации вызывает ток
(рис. 22), ЭДС поляризации вызывает ток 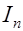 в
в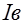 , снижает его и может даже прекратить возбуждение. Поляризация электродов также играет отрицательную роль при проведении работы 24. Вещество, выделяющееся на электродах в результате вторичных реакций, способствует уменьшению электрического тока между электродами, приводя к искажению результатов эксперимента.
, снижает его и может даже прекратить возбуждение. Поляризация электродов также играет отрицательную роль при проведении работы 24. Вещество, выделяющееся на электродах в результате вторичных реакций, способствует уменьшению электрического тока между электродами, приводя к искажению результатов эксперимента.
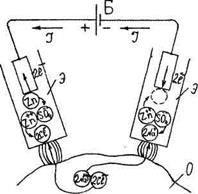
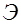 , помещенного в стеклянную трубку
, помещенного в стеклянную трубку 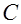 , наполненную раствором сернокислого цинка. Отверстие трубки закрыто пробкой
, наполненную раствором сернокислого цинка. Отверстие трубки закрыто пробкой 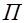 из каолина или желатина, пропитанного физиологическим раствором, снабженной кисточкой, при помощи которой электрод соприкасается с объектом
из каолина или желатина, пропитанного физиологическим раствором, снабженной кисточкой, при помощи которой электрод соприкасается с объектом 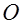 . При прохождении тока по цепи, состоящей из источника тока
. При прохождении тока по цепи, состоящей из источника тока 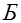 , неполяризующихся электродов
, неполяризующихся электродов 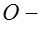 раствора хлористого натрия (рис.23 б)
раствора хлористого натрия (рис.23 б)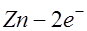
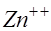 . Ионы цинка переходят в раствор и связываются ионами хлора, приходящими из объекта:
. Ионы цинка переходят в раствор и связываются ионами хлора, приходящими из объекта: 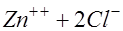
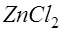 . В растворе появляется примесь хлористого цинка. На катоде ионы цинка приобретают электроны и выделяются в виде атомов:
. В растворе появляется примесь хлористого цинка. На катоде ионы цинка приобретают электроны и выделяются в виде атомов: 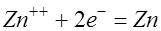 . Оставшиеся в избытке в растворе ионы радикала серной кислоты взаимодействуют с ионами натрия, приходящими из объекта:
. Оставшиеся в избытке в растворе ионы радикала серной кислоты взаимодействуют с ионами натрия, приходящими из объекта: 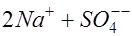
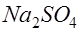 . В растворе появляется примесь сернокислого натрия. После употребления раствор в обоих электродах заменяется.
. В растворе появляется примесь сернокислого натрия. После употребления раствор в обоих электродах заменяется.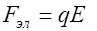 , (2)
, (2)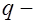 заряд иона,
заряд иона, 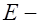 напряженность электрического поля) и сила сопротивления между гидратированным ионом и раствором электролита
напряженность электрического поля) и сила сопротивления между гидратированным ионом и раствором электролита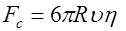 , (3)
, (3)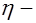 вязкость электролита (работа № 21). Движение иона можно рассматривать как равномерное и прямолинейное, поэтому:
вязкость электролита (работа № 21). Движение иона можно рассматривать как равномерное и прямолинейное, поэтому: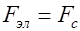 . (4)
. (4)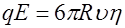 , (5)
, (5)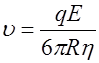 . (6)
. (6)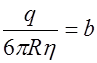 , то
, то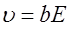 . (7)
. (7)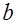 называют подвижностью ионов. Из формулы (7) следует, что
называют подвижностью ионов. Из формулы (7) следует, что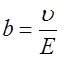 . (8)
. (8)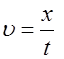 , (9)
, (9)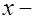 расстояние, на которое ион перемещается за время
расстояние, на которое ион перемещается за время 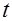 .
.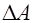 , совершаемая силой
, совершаемая силой 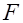 электрического поля напряженностью
электрического поля напряженностью 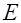 по перемещению заряда
по перемещению заряда 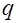 из данной точки на расстояние
из данной точки на расстояние 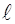 вдоль линии напряженности, равна
вдоль линии напряженности, равна 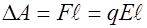 . Эта работа совершается силами поля за счет убыли потенциальной энергии заряда на величину
. Эта работа совершается силами поля за счет убыли потенциальной энергии заряда на величину 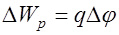 , где
, где 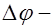 соответствующее изменение потенциала. Приравниваем два последних равенства:
соответствующее изменение потенциала. Приравниваем два последних равенства: 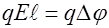 , откуда
, откуда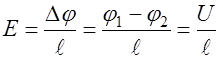 , (10)
, (10)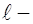 расстояние, на котором происходит падение напряжения. Подставив (9) и (10) в выражение (7), получим формулу для вычисления подвижности ионов:
расстояние, на котором происходит падение напряжения. Подставив (9) и (10) в выражение (7), получим формулу для вычисления подвижности ионов: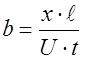 . (11)
. (11)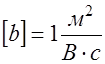 .
.