Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Пути и Способы введения лекарственныхСтр 1 из 13Следующая ⇒
ПУТИ И СПОСОБЫ ВВЕДЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ В ОРГАНИЗМ ЖИВОТНЫХ
Правила обращения с животными и простейшие способы Фиксации
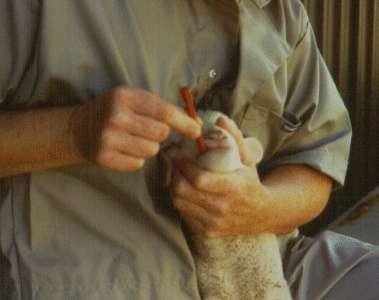
При введении лекарственных форм больным животным необходимо обеспечить безопасность для всех лиц, соприкасающихся с ними. Неправильное обращение вызывает у животных сильное возбуждение, в результате которого они могут нанести увечье людям и себе. Большинство процедур по введению лекарственных веществ требует фиксации животных. Фиксация челюстей у собаки. У спокойных собак несложные процедуры можно провести без применения инструментов. Одной рукой захватывают верхнюю челюсть и вдавливают края щек в ротовую полость, другой рукой оттягивают нижнюю челюсть книзу и раскрывают рот. Щеки, находясь между зубами, препятствуют смыканию челюстей. У крупных собак голову держат за намордник, или намордник привязывают к неподвижному предмету. Злобных собак захватывают за загривок длинными щипцами или за шею петлей специально фиксированной палки.
Энтеральные пути введения
От лат. enteros – кишечник. Лекарственное средство вводят в организм через слизистые оболочки желудочно-кишечного тракта. К энтеральным путям введения относят: через рот (per os), под язык (sub lingua), в прямую кишку (per rectum).
Пероральное введение лекарственных средств
Введение лекарства в организм путем проглатывания. При этом лекарство попадает вначале в желудок и кишечник, где в течение 30–40 мин происходит его всасывание в систему воротной вены. Далее с током крови лекарство поступает в печень, затем в нижнюю полую вену, правые отделы сердца и, наконец, в малый круг кровообращения. Пройдя малый круг, лекарство по легочным венам достигает левых отделов сердца и с артериальной кровью поступает к тканям и органаммишеням. Этим путем чаще всего вводят твердые и жидкие лекарственные формы (таблетки, драже, капсулы, растворы, пастилки и др.).
Преимущества метода
1. Наиболее физиологический метод введения лекарственного вещества, удобен и прост. 2. Не требуется специально обученный персонал для введения. 3. Безопасность.
Недостатки метода
1. Медленное поступление лекарственного вещества в системный кровоток.
2. Скорость всасывания непостоянна и зависит от наличия пищи в ЖКТ, его моторики (если моторика снижается, скорость всасывания падает). 3. На принятые внутрь лекарственные средства воздействуют ферменты желудка и кишечного сока, метаболические ферментные системы печени, которые разрушают часть вещества еще до того, как оно проникнет в системный кровоток. 4. Невозможно применять лекарства, которые плохо всасываются в ЖКТ (например, антибиотики, аминогликозиды) или разрушаются в нем (например, инсулин). 5. Лекарственное средство может вызвать язвенное поражение ЖКТ (например, при приеме кортикостероидов, салицилатов). 6. Этот путь введения неприемлем при отсутствии у пациента сознания (хотя лекарство можно ввести сразу внутрижелудочно через зонд), если у пациента неукротимая рвота или опухоль (стриктура) пищевода, имеются массивные отеки (анасарка, так как при этом нарушается процесс всасывания лекарства в кишечнике).
групповой способы дачи лекарственных веществ. Для одних животных эта манипуляция очень проста и доступна; для других требует определенного подхода и навыка. Собакам, кошкам и пушным зверям лекарственные вещества дают преимущественно с мясом, мясным фаршем и бульоном, творогом, колбасой и другими охотно поедаемыми кормами Насильственные методы. Введение лекарственных веществ через рот (перорально). При избрании способа введения необходимо руководствоваться фармакологическими свойствами лекарственных средств, а также состоянием и видом животных, условиями, в которых приходится оказывать лечебную помощь. Нельзя насильственно вводить лекарственные вещества через рот тем животным, которые не в состоянии глотать (паралич глотки, закупорка глотки инородными телами и др.). В таких случаях лучше вводить через зонд растворы.
С помощью зондов
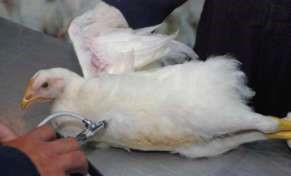
Для введения животным жидких лекарственных веществ внутрь можно использовать различные носопищеводные и ротожелудочные зонды, а также медицинские желудочные зонды разной величины (рис. 4). Их подбирают в зависимости от величины животного, проверяют целостность и проходимость, убирают шероховатости на поверхности и перед использованием обеззараживают антисептическими растворами или кипятят.


 
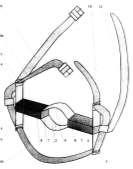
Рисунок 4 – Виды зондов: а – зонд силиконовый одноканальный желудочный; б – зонд пищеводно-желудочный спадающийся силиконовый ЗПЖС; в – зонд желудочно -кишечный двухканальный силиконовый универсальный ЗЖКСУ; г – зонд носоглоточный для лошадей; д – з онд пищеводный КРС
Рисунок 6 – Зондирование желудка у мелких домашних животных: а – расстояние от крыльев носа до желудка; б – проведение зонда через просвет рулона лейкопластыря, помещенного между челюстями собаки
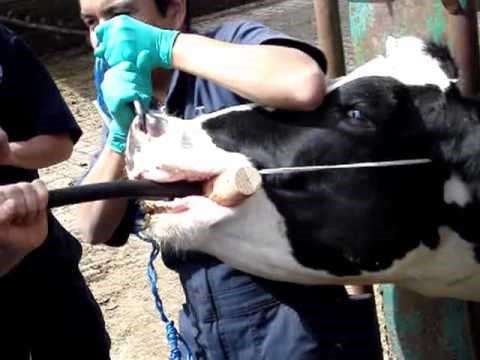
Рисунок 7 – Техника зондирования сычуга у ягненка а б Рисунок 8 – Зондирование рубца у коровы: а – зевники; б – введение зонда
Рисунок 9 – Зондирование желудка у птиц
В мочевой пузырь
Катетеризацией называется опорожнение мочевого пузыря с помощью специально введенной в него полой трубки – катетера. Ее проводят с диагностической при необходимости получения мочи для исследования и с лечебной целями.
 
в б
 
д е
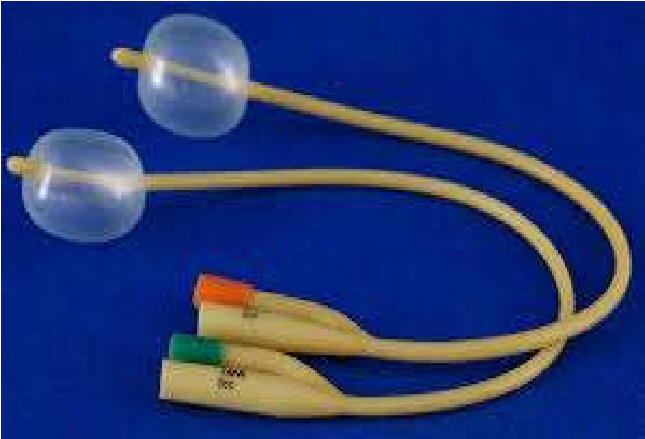
Рисунок 18 – Различные модификации мочевых катетеров: а – катетер Фолея; б – Фолея 2-ходовые; в – катетеры Нелатон; г – металлический; д – катетеры полиуритановые; е – катетер подключичный
Показания: переполнение мочевого пузыря вследствие пареза или паралича его стенок, при циститах, спазме сфинктера мочевого пузыря, для получения мочи с диагностической целью, промывания мочевого пузыря. Для проведения катетеризации мочевого пузыря применяют различные урологические катетеры. Мочевые катетеры различают по размеру, материалу, из которого они сделаны, конструкции. Катетеры бывают мягкие (резиновые), полужесткие (полихлорвиниловые или из искусственного шелка), жесткие (металлические), универсальные. Размер определяют по наружному диаметру с применением французской системы: одна французская единица (Fr) равна 1/3 мм. Внутренний диаметр катетера зависит от конструкции и материала. Катетеры подразделяются на самозакрепляющиеся и несамозакрепляющиеся. Они могут быть мягкие и твердые.
Катетер Фолея (рис. 18, а, б) – широко распространенный самозакрепляющийся катетер, снабженный на конце баллоном, который можно раздуть стерильным физиологическим раствором через канал, расположенный в стенке катетера. Раздувание баллона, когда конец катетера находится в мочевом пузыре, препятствует выходу катетера из просвета мочевого пузыря. Катетер Фолея изготавливают из латекса с тефлоновым или силиконовым покрытием, за счет чего он очень гибок, инертен и менее травматичен, чем многие жесткие несамозакрепляющиеся катетеры. Катетер Фолея показан главным образом для постоянной катетеризации у больших собак-самок; у самцов применяют более жесткие и длинные катетеры. Самые распространенные из несамозакрепляющихся катетеров – прямые однопросветные мочевые катетеры с одним или более отверстиями на дистальном конце (рис. 18, в, г, д). Их изготавливают из металла, полипропилена и поливинилхлорида (красная резина). Эти катетеры закрепляют с помощью лейкопластыря и/или швов. Металлические катетеры применяют для коров и собак-самок. К ним прибегают для однократной катетеризации, поскольку их жесткость облегчает катетеризацию. Однако металлические катетеры травмируют мочевой тракт и пользоваться ими не рекомендуется. Полипропиленовые катетеры – относительно жесткие, с закрытым концом и различным внутренним диаметром, но только одной длины (55 см). Их применяют и у кобелей, и у самок. Полипропиленовые катетеры для котов имеют только один диаметр (3,5 Fr) и снабжены закрытым или открытым концом. Их главное назначение – устранение обструкции уретры у котов. Полипропиленовые катетеры отнюдь не идеальное средство для постоянной катетеризации уретры, так как из-за своей жесткости способны вызывать травму уретры или мочевого пузыря. Поливинилхлоридные катетеры имеют различные диаметры и только две длины (чаще всего 40 см). Длина катетера размером 8 Fr составляет 55 см. Катетеры из красной резины боле гибкие, менее травматичные и в меньшей степени, чем полипропиленовые катетеры, раздражают слизистую оболочку уретры, что делает их более пригодными для постоянной катетеризации мочеиспускательного канала у всех животных обоих полов.
Прежде чем провести катетеризацию, подбирают катетер в зависимости от вида животного. На поверхности катетера не должно быть шероховатостей, зазубрин, трещин, так как небольшие царапины мочеиспускательного канала могут способствовать глубокому проникновению возбудителей инфекций. Внутрикожное введение
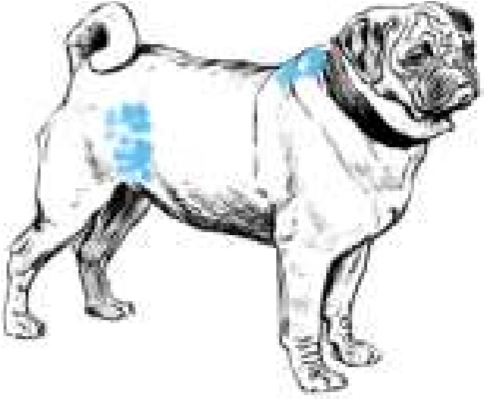
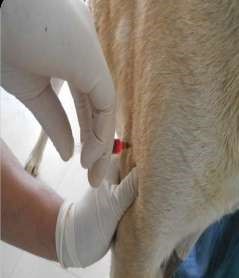
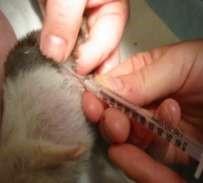
Инъекции делают на стоящих животных. Пальцами левой руки собирают кожу животного в небольшую складку, в которую правой рукой делают укол почти параллельно поверхности кожи (рис. 33, а, 34, а). Затем иглу постепенно продвигают дальше в толщу кожи параллельно поверхности, надавливая на поршень шприца. Чаще всего внутрикожно вводят анестезирующие жидкости и аллергены. Крупным животным аллергены вводят на боковой поверхности шеи, телятам в области лопатки, свиньям – на наружной поверхности уха, мелкому рогатому скоту – в складку нижней стороны хвоста, курам – в бородку. Внутрикожно инъецируют небольшое количество жидкости в пределах 0,1–0,5 мл.
Подкожное введение
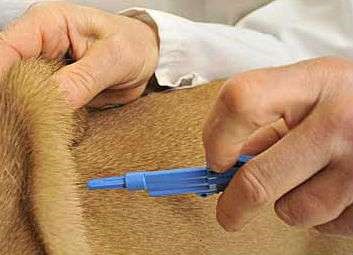
Данным путем вводят жидкие лекарственные формы любого вида и растворимые порошки. Игла шприца прокалывает кожу и входит в гиподерму (рис. 33, б, 34, б), лекарственное вещество после введения всасывается сразу в систему полых вен. Эффект развивается через 15–20 мин. Преимущества метода
1. Эффект сохраняется дольше, чем при внутривенном или внутримышечном введении этого же лекарства. 2. Можно вводить лекарства, которые разрушаются в ЖКТ.
Недостатки метода
1. Всасывание происходит достаточно медленно из-за низкой скорости кровотока. Если периферическое кровообращение нарушено, то эффект может не развиться вообще. 2. Нельзя вводить вещества, которые обладают раздражающим действием, и сильные сосудосуживающие средства, так как они могут вызывать некроз. 3. Риск инфицирования раны. 4. Требуется специальное обучение персонала.
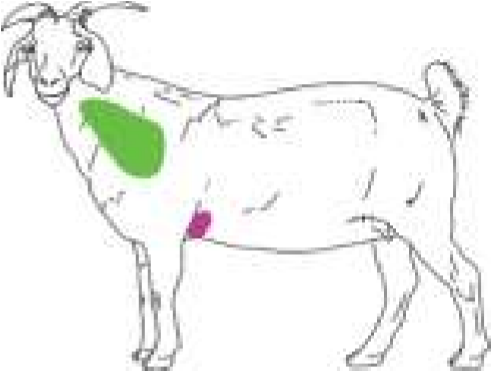



Рисунок 35 – Область для подкожного введения лекарственных веществ у разных видов животных: а – у плотоядных; б – у мелкого рогатого скота; в – у свиней; г – у коров; д – у птиц
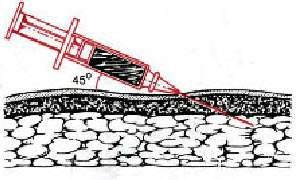 а а
б
в
Рисунок 36 – Техника подкожного введения: а – кожная складка; б – положение иглы при подкожном введение; в – инфузионный инфильтрат в области подкожной клетчатки
Для подкожных инъекций выбирают участки тела, наиболее богатые подкожной клетчаткой и относительно бедные нервами и сосудами. У лошадей и крупного рогатого скота наиболее удобное место для инъекций – боковая поверхность шеи или кверху от яремного желоба, подгрудок и средняя часть предплечья (рис. 35, г).
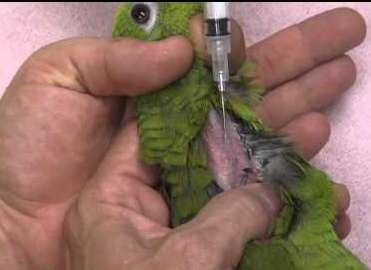
У овец и коз – внутренняя поверхность бедра, боковая поверхность шеи, область локтевого сустава (рис. 35, б). У мелких животных инъекции делают с правой и левой стороны шеи, на грудной стенке, на внутренней поверхности бедра и нижней стенке живота (рис. 35, а). У свиней – часть шеи у основания уха, подвздошно-коленная складка, внутренняя поверхность бедра и нижняя поверхность брюшной стенки (рис. 35, в). У птицы – в области затылка, груди и верхушки крыла (рис. 35, д). Техника выполнения (см. рис. 36) 1. Крупных животных фиксируют в стоячем положении, мелких можно в боковом. 2. Обработать центробежно (или по направлению снизу вверх) зону кожных покровов, непосредственно место пункции. 3. Левой рукой берут кожу в складку в месте инъекции (рис. 34, а). 4. Подведите иглу под кожу в основании кожной складки под углом 45º к поверхности кожи срезом наружу, на глубину 15 мм или 2/3 длины иглы (в зависимости от длины иглы показатель может быть разным) (рис. 34, в). 5. Указательным пальцем придержать канюлю иглы, а большим произвести давление на поршень и медленно ввести лекарственное средство. 6. Извлечь иглу, продолжая придерживать ее за канюлю, место прокола придержать стерильной ваткой, смоченной спиртом. 7. При образовании в месте инъекции желваков делают согревающие компрессы.
Внутримышечное введение
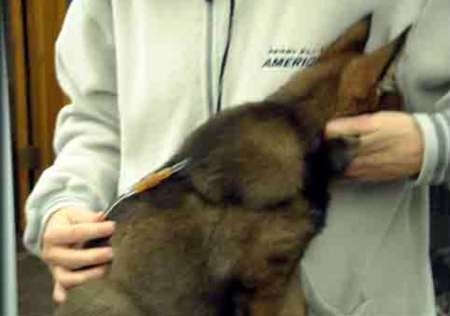
В основном мыщцы предназначены для введения медленно всасывающихся лекарственных растворов и взвесей (в мышцах больше сосудов, а сокращение их способствует более ускоренному всасыванию). Данным путем вводят все виды жидких лекарственных форм и растворы порошков. Иглой шприца прокалывают кожу, гиподерму, фасцию мышцы и затем ее толщу, куда и вводят лекарство (рис. 33, б, 34, б). Абсорбция лекарства происходит в систему полых вен. Эффект развивается через 10–15 мин. Объем вводимого раствора не должен превышать у мелких домашних животных 5 мл, у крупных животных 20–30 мл. При внутримышечном введении лекарство всасывается менее полно по сравнению с внутривенным введением, но лучше, чем при пероральном применении (однако могут быть исключения из этого правила, например, диазепам при внутримышечном введении всасывается менее полно, чем при введении внутрь).
Преимущества метода
1. Можно вводить масляные растворы и эмульсии, а также депо-препараты, которые обеспечивают сохранение эффекта несколько месяцев. 2. Сохраняется высокая точность дозирования. 3. Можно вводить раздражающие вещества, так как ткани мышц не содержат много рецепторов.
Недостатки метода
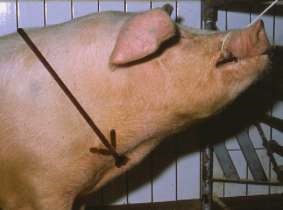
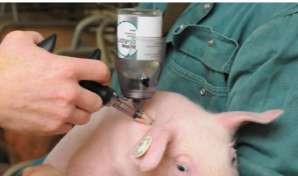
1. Требуется специально обученный персонал для выполнения инъекции. 2. Возможно повреждение сосудисто-нервных пучков при выполнении инъекции. 3. Невозможно удалить депо-препарат, если требуется прекращение лечения. Внутримышечные инъекции менее болезненны. Однако не следует назначать сильно раздражающие вещества, и резко гипер- и гипотонические растворы, так как это вызывает некроз тканей. Как правило, выбирают большие группы мышц, избегая места расположения крупных сосудов, нервов, сухожильных влагалищ, суставов и костей. Взрослым свиньям внутримышечную инъекцию выполняют в шею, если иное не предписано в инструкции к препарату. Самое часто используемое место введения у отъемышей, подсвинков, откормочных свиней и взрослых животных является область, расположенная в 50–75 мм позади основания уха, на границе кожной складки и кожи (рис. 37, д). Поросятам часто инъецируют в бедренную часть задней конечности, поскольку у таких животных еще недостаточно мышечной ткани в шейной области. Однако не рекомендовано проведение инъекции в эту область у поросят группы доращивания, подсвинков или откормочных свиней из-за высокой вероятности формирования абсцессов. У лошадей наиболее удобное место для инъекций – боковая поверхность шеи кверху от яремного желоба, подгрудок и заднебедренную группу мышц (рис. 37, в). У крупного рогатого скота – боковая поверхность шеи кверху от яремного желоба, ягодичная область или верхний наружный квадрат ягодицы, плечевая часть грудной мышцы и трехглавая мышца плеча (рис. 37, б).
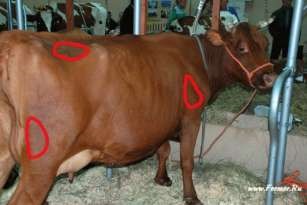
  
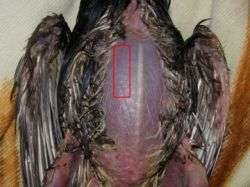 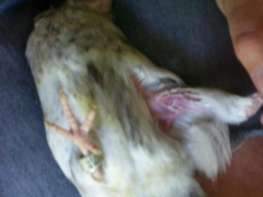

Рисунок 37 – Область внутримышечного введения лекарственных веществ: а – у плотоядных; б – у коров; в – у лошадей; г – у птиц; д – у свиней
а
б в
 г г
Рисунок 38 –Техника внутримышечного введения лекарственных препаратов: а – у лошадей; б – птиц; в – у свиней; г – у кошек и собак
У овец и коз – внутренняя поверхность бедра, боковая поверхность шеи, область локтевого сустава. У собак и кошек – в заднюю группу мышц бедра или плеча (рис. 37, а). У птицы – грудь и внутренняя поверхность бедра (рис. 37, г). Прокол производят строго перпендикулярно к поверхности кожи и вводят иглу на 2/3 ее длины в мышцу. Левой рукой кожу во время прокола слегка придавливают. Если игла вошла слишком глубоко или достигла кости, пугаться этого не следует, а необходимо ее немного оттянуть и, убедившись, что в шприце нет крови (значит, не попали иглой в кровеносный сосуд), медленно ввести лекарство. Если же в шприце появилась кровь, иглу необходимо извлечь и ввести ее в другое обработанное йодной настойкой место.
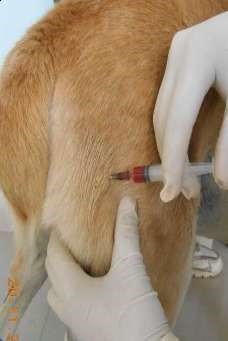
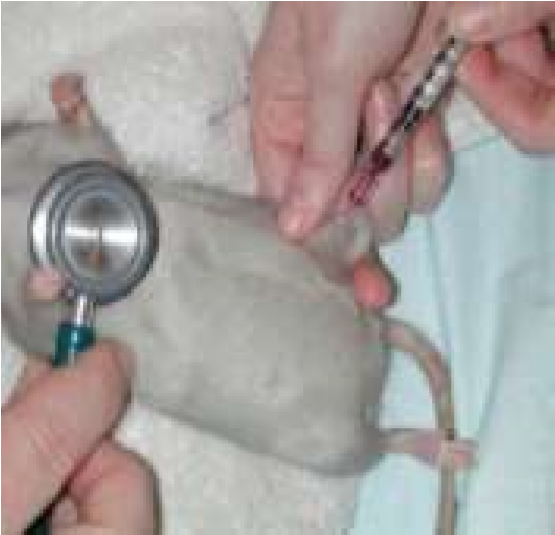
Внутривенное введение
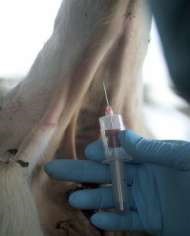
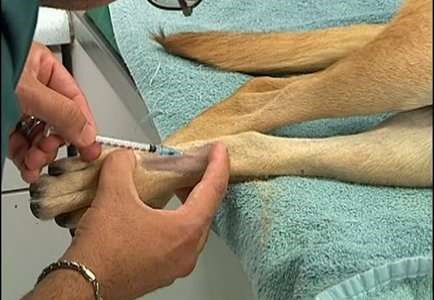
При этом способе введения игла шприца прокалывает кожу, гиподерму, стенку вены и лекарство непосредственно вводится в системный кровоток (нижнюю или верхнюю полые вены). Лекарство может вводиться струйно медленно или быстро (болюсом), а также капельным способом. Таким образом, вводят жидкие лекарственные формы, которые являются истинными растворами или лиофилизированные порошки (предварительно растворив их).
Преимущества метода
1. Непосредственное введение лекарства в кровь и практически мгновенное развитие эффекта. 2. Высокая точность дозирования. 3. Можно вводить вещества, которые обладают раздражающим действием или являются гипертоническими растворами (в количестве не более 20–40 мл). 4. Можно вводить вещества, которые разрушаются в ЖКТ.
Недостатки метода
1. Невозможно вводить масляные растворы, эмульсии и суспензии, если они не прошли специальной обработки. 2. Очень сложная техника манипуляции, которая требует специально обученного персонала. 3. В органах с хорошим кровоснабжением могут создаваться токсические концентрации вещества в первые минуты после введения. Возможно инфицирование и воздушная эмболия при неправильной технике. Инъекции делают шприцами, а для вливаний используют аппарат Боброва или системы капельницы.
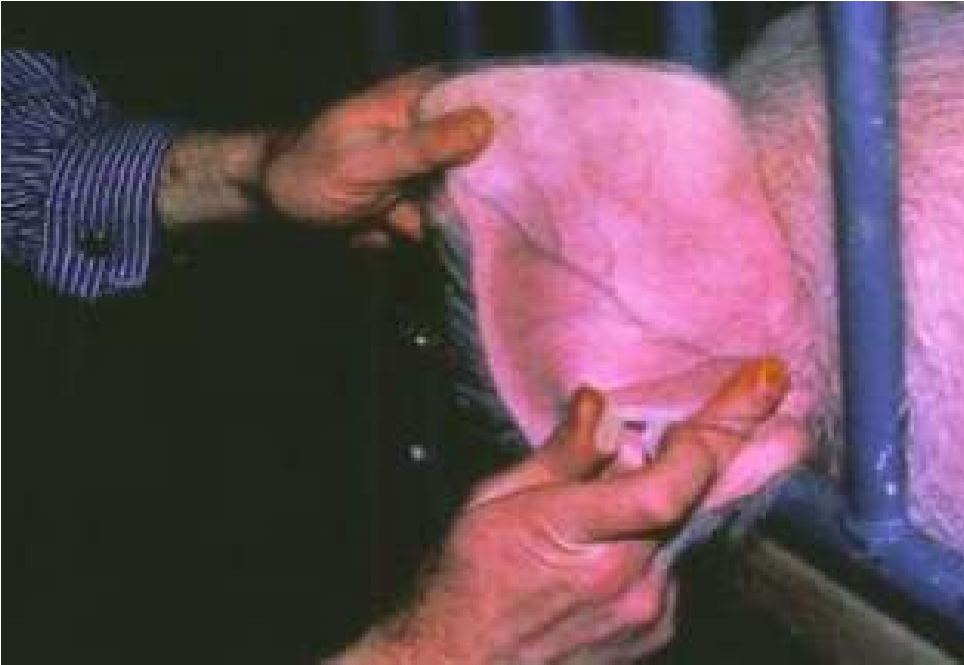
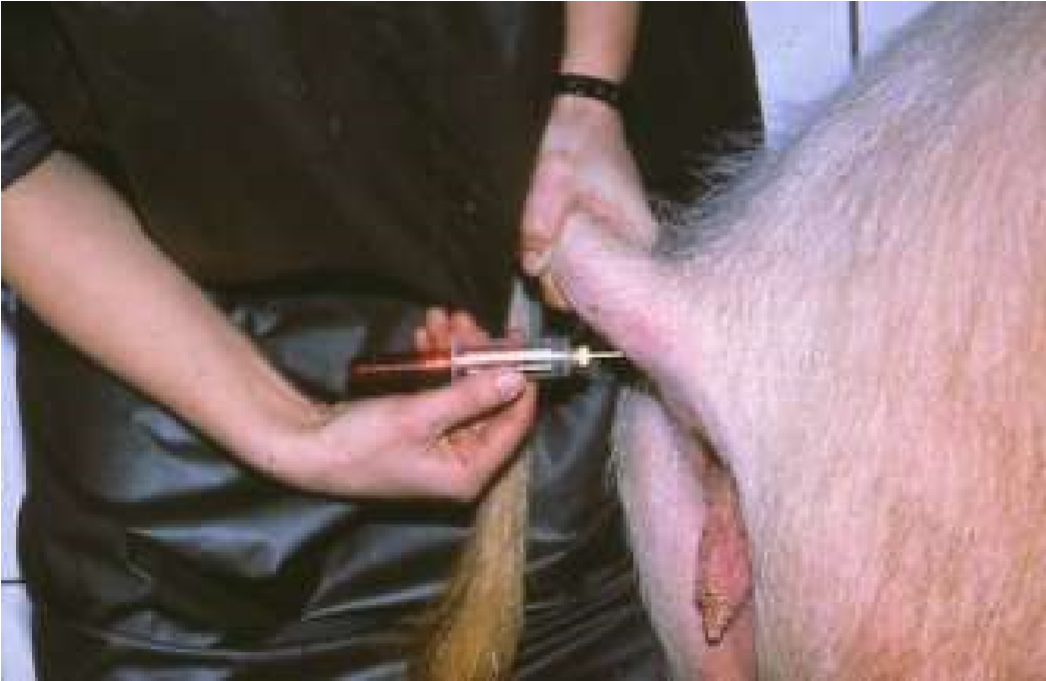
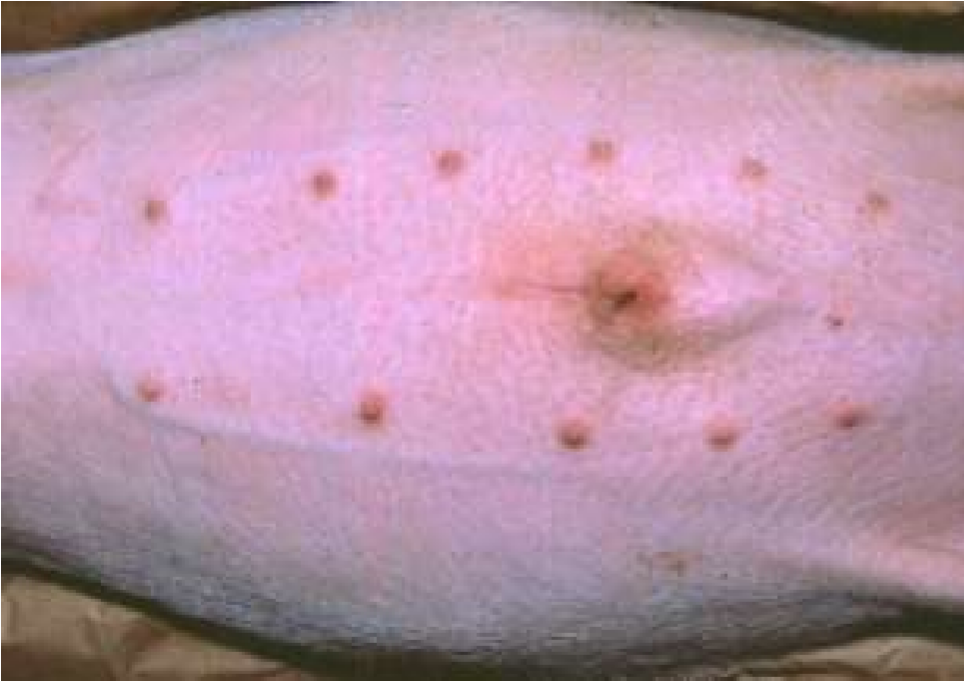
Рисунок 39 – Периферические вены, используемые для прокола у свиней: а – яремная; б – большая ушная вена; в – хвостовая; г –подкожная вена живота   а б
Рисунок 40 – Периферические вены, используемые для прокола у коров: а – яремная; б –подкожная вена живота; в – хвостовая
Окончание рис. 40

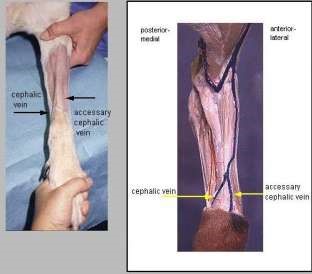
  г д Рисунок 41 – Периферические вены, используемые для прокола у собак: а – подкожная головная вена предплечья ; б – малая подкожная вена голени; в – бедренная вена; г – плюсневая латеральная; д – яремная вена
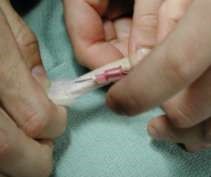 
a б в Рисунок 42 – Периферические вены, используемые для прокола у крыс: а – медиальная подкожная вена; б – хвостовая, в – бедренная
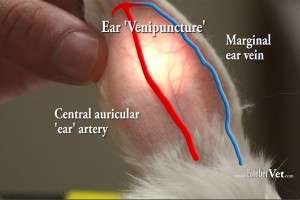
Рисунок 43 – Периферические вены, используемые для прокола: а – у лошади; б – у медведя; в – у кролика
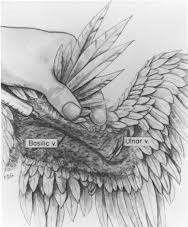

Рисунок 44 – Периферические вены, используемые для прокола у птиц: а – яремная; б – локтевая или вены крыла; в – медиальная плюсневая
 
а б в Рисунок 45 – Техника внутривенного введения
е г д
Окончание рис. 45
Лучшие места для прокола: – у свиней – большая ушная вена. Можно использовать для пункции яремную, хвостовую,подкожную вены живота (см. рис. 39); – плотоядных – малая подкожная вена голени, бедренная вена, подкожная головная вена предплечья, яремная вена (см. рис. 41); – крыс – медиальная подкожная вена, хвостовая, бедренная вены (см. рис. 42). – жвачных – яремная, подкожная вены живота и хвостовая вена (рис. 40); – лошадей – яремная вена (см. рис. 43, а); – птиц – яремная, локтевая вены или вена крыла, медиальная плюсневая вены (см. рис. 44); – кроликов – ушная вена (см. рис. 43, в). У всех животных можно использовать подъязычную вену.
Техника внутривенного введения
1. Крупных животных фиксируют стоя, голову приподнимают, слегка изогнув в противоположную сторону. Мелких животных фиксируют в боковом положении (рис. 45, а). 2. Шерсть вокруг вены выстригают, кожу дезинфицируют 4 %-м раствором хлоргекседина или 70 %-м спиртом (рис. 45, б). 3. Ассистент (у мелких животных) или врач (у крупных животных) пережимает сосуд большим пальцем руки проксимально от места введения (рис. 45, в). Можно использовать жгут как альтернативный метод пережатия сосуда. 4. Иглу срезом наружу вкладывают через кожу в вену и направляют против тока крови под углом 40–45° к поверхности кожи. При попадании иглы в вену кровь вытекает ровной, плавной струей (рис. 45, г, д). 5. Если игла в вену не попала, то принимают двухмоментную пункцию, иглу оттягивают наружу, не извлекая конца из кожи, еще раз уточняют местоположение вены и делают укол. 6. При появлении нормальной струи крови, иглу соединяют со шприцом, опускают его вниз до появления крови. Затем начинают медленно вводить раствор в вену (5–30 мл в 1 мин). 7. После скончания вливания иглу отделяют от резиновой трубки, полость иглы промывают током крови. Место укола смазывают раствором йода. Категорически запрещается: 1. Вводить иглу перпендикулярно к поверхности кожи, поскольку это приводит к одновременному проколу двух противоположных стенок вены и развитию гематомы. 2. Делать повторные пункции вены в одном и том же месте, поскольку возможна гематома или тромбофлебит.
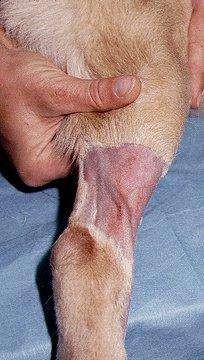
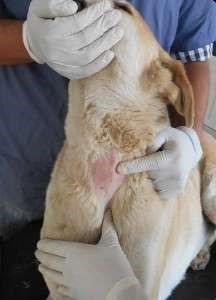
Местные осложнения
Гематома – это скопление крови в тканях. Гематома может образоваться в результате вытекания крови из сосуда в ткани, которые прилегают к месту установления катетера. Это может произойти в результате неудачной пункции вены непосредственно в момент установления ПВК или в результате следующего удаления катетера. Поэтому во избежание образования гематомы, обусловленной установлением ПВК, необходимо обеспечить адекватное наполнение вены, а также тщательным образом выбрать место установления катетера. Профилактика. В целях профилактики не следует делать венепункцию слабо контуруемых сосудов. Образование гематомы при удалении катетера можно избежать, если прижать место венепункции в течение 3–4 мин после удаления ПВК. Также можно поднять конечность. Тромбоз вены возникает при формировании тромба в просвете сосуда. Это может случиться при несоответствии диаметра вены и размера катетера, дефектах ухода. Профилактика. Во избежание развития тромбоза необходимо производить правильный выбор размера катетера в соответствии с величиной пунктируемой вены, придерживаться правил ухода. Канюли из качественных материалов (полиуретан, политетрафторэтилен, фторэтиленпропилен-кополимер) обладают меньшей тромбогенностью, чем полиэтиленовые и полипропиленовые катетеры. Профилактикой тромбоза также является смазывание участка кожи над местом предполагаемого нахождения катетера в вене гепариновыми гелями, например, «Лиотоном». Инфильтрация образуется в том случае, если лекарственные препараты или вливаемые растворы поступают под кожу, а не в вену. Проникновение в ткань некоторых растворов, таких как гипертонический, щелочной или раствор цитостатиков, может вызывать некроз тканей. Поэтому очень важно выявить инфильтрацию на ранних стадиях. При возникновении первых признаков инфильтрации стоит немедленно удалить ПВК. Чтобы избежать инфильтрации, используйте гибкие капиллярные катетеры и тщательным образом их фиксируйте. Профилактика. Используйте турникет для стабилизации катетера, если последний установлен в месте изгиба. Проверяйте, не снизилась ли температура тканей, обращайте внимание на отек вокруг места введения катетера. Флебит – воспаление интимы вены, которое может возникнуть в результате химического, механического раздражения или инфекции. Наиболее частыми возбудителями катетерных инфекций являются коагулазонегативные стафилококки и Staphylococcus aureus, энтерококки, Candida (часто на фоне антибиотикотерапии), резистентные ко многим антимикробным препаратам. Кроме воспаления, может сформироваться также тромб, что приводит к развитию тромбофлебита. Среди всех факторов, которые содействуют развитию флебита (таких как размер катетера, место венепункции и т. д.), особенно важными являются длительность пребывания катетера в вене и тип жидкости, которая вводится. Важна осмолярность препарата (выраженные флебиты развиваются при осмолярности более 600 мОсм/л, таблица 8.1) и рН вводимого раствора (лимитирующие значения рН влияют на развитие флебита). Все внутривенные доступы должны регулярно контролироваться для выявления симптомов флебита. Любой случай флебита должен быть документирован. Обычно случаи флебита составляют 5 % и менее.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 381; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.171.202 (0.217 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||



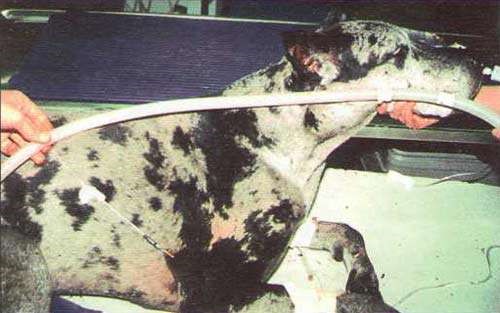
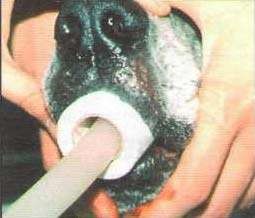 а б
а б