Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хімічні властивості сульфатної кислоти. Виявлення сульфат-іонаСодержание книги
Поиск на нашем сайте
Мета: Ознайомлення з основними властивостями сульфатної кислоти та якісними реакціями на сульфат-іон.
Для роботи необхідні: реактиви: розчини сульфатної та нітратної кислоти (1:5), натрію та кальцію гідроксид, натрію сульфату, натрію фосфату, натрію сульфіту, натрію хлориду, барію хлориду, натрію гідрокарбонату, купруму (II) сульфату, фенолфталеїну, метилового оранжевого, лакмусу. Шматочки цинку, заліза, міді, порошкоподібні купруму (II) оксид і феруму (III) оксид; обладнання і хімічний посуд: пробірки, газовідвідна трубка.
Хід роботи:
Дослід 1. Дія кислот на індикатори Випробуйте дію розбавленої сульфатної кислоти на розчини індикаторів лакмусу та метилового оранжевого. Що спостерігаєте? Зробіть висновок:___________________ ____________________________________________________________________
Будьте обережні із сульфатною кислотою, бо вона ушкоджує шкіру, тканини та спричиняє опіки. Напишіть рівняння дисоціації сульфатної кислоти. ________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дослід 2. Взаємодія кислоти з металами
У три пробірки з розбавленою сульфатною кислотою покладіть по шматочку цинку, магнію й міді. Що відбувається у кожній з пробірок? Зробіть висновки й запишіть рівняння ____________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ __________________________________________________________________________ __________________________________________________________________________
Дослід3. Взаємодія кислоти з основами
а) У пробірку з розчином лугу додайте 2-3 краплі фенолфталеїну. Потім у цю ж пробірку долийте розчину сульфатної кислоти до зміни забарвлення індикатора. Зробіть висновки із спостережень, напишіть рівняння реакцій у молекулярній та іонній формах. ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
б) Добудьте нерозчинний гідроксид взаємодією розчинної солі купруму (II) з лугом. До осаду купруму (II) гідроксиду долийте розчин сульфатної кислоти. Які ознаки реакції? Напишіть рівняння реакцій у молекулярній та іонній формах. Зробіть висновок про взаємодію розбавленої кислоти з розчинними та нерозчинними основами й про умови проведення зазначених реакцій. ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Дослід 4. Взаємодія кислоти з солями До концентрованого розчину натрію гідрокарбонату долийте розчин сульфатної кислоти, закрийте пробірку газовідвідною трубкою, кінець якої опустіть у пробірку з вапняною водою? Напишіть рівняння реакцій у молекулярній та іонній формах. ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Дослід 5. Якісна реакція на сульфати Налийте у пробірку по 1 мл розчинів таких солей: натрію сульфату, натрію нітрату, натрію хлориду. Додайте в кожну пробірку по краплі розчинної солі барію (хлориду або нітрату). Що спостерігаєте? Долийте у пробірки розчину нітратної або хлоридної кислоти. Що спостерігаєте в кожній з пробірок? Запишіть рівняння відповідних реакцій у молекулярній та іонній формах. Зробіть висновки про властивості сульфатної кислоти, спільні з іншими кислотами, та про відмінність її та сульфатів від інших кислот та їх солей. ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Висновок:___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата "_____ " 20 _ року ЛАБОРАТОРНА РОБОТА № 3
Добування карбон (1Y)оксиду і вивчення його властивостей. Якісна реакція на карбонат-іон.
Мета: Навчитися одержувати карбон (1Y)оксид у лабораторії, познайомитися з якісною реакцією на карбонат-іон.
Хід роботи. Дослід №1. Добування діоксиду вуглецю і вивчення його властивостей.
Реактиви і прилади. Карбонат кальцію (мармур або крейда), розчин лакмусу, вапняна вода, дистильована вода; кусочок свічки, металева ложечка для спалювання, 2 пробірки, 2 склянки, прилад для добування діоксиду вуглецю.
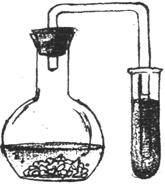
Хід досліду: 1. Складіть прилад, як показано на мал.1.
Мал. 1. Прилад для добування діоксиду вуглецю.
У колбу приладу (місткістю 100 мл) покладіть 2-3 г мармуру і вилийте 15-20 мл хлоридної кислоти. Опустіть газовідвідну трубку майже до дна пробірки, в яку налито 5 мл дистильованої води. Пропускайте газ із приладу через воду протягом 10-20 сек., після чого в пробірку з дистильованою водою добавте кілька краплин розчину лакмусу. Поясніть свої спостереження. Які іони є в розчині? Напишіть рівняння реакції добування діоксиду вуглецю та реакцію між вуглекислим газом і водою. ________________________________________________________________________________________________________________________________________________________________________________________________________________________ ________________________________________________________________________________________________________________________________________________
Дослід №2. Ознайомлення з властивостями карбонатів і гідрокарбонатів. Якісна реакція на карбонат-іон. Реактиви і прилади. Гідрокарбонат натрію, карбонат натрію, карбонат кальцію, 20%-на соляна кислота, 20%-на оцтова кислота, дистильована вода, вапняна вода; пробірки.
Хід досліду: 1. В 2 пробірки насипте (щоб тільки вкрилось дно пробірки) карбонат натрію та карбонат кальцію. В кожну пробірку долийте 3-4 краплі розчину хлоридної кислоти. Який газ виділяється? Повторіть те ж саме з оцтовою кислотою. Напишіть молекулярні і іонні скорочені рівняння реакцій між кислотами та карбонатами. Які реакції є якісними на карбонат-іон? ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Висновок:________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата "___"______________ 20___ року Практична робота № 1. Розпізнавання сполук неметалів. Мета: Навчитися визначати неорганічні речовини за допомогою якісних реакцій.
Реактиви і прилади: розчини солей, хлоридна та сульфатна кислоти, індикатори, пробірки.
Завдання 1. 1. Визначити, яка речовина міститься в кожній з чотирьох пробірок (кристалічні речовини): Варіант 1 – сульфат натрію, карбонат кальцію, гідроксид кальцію, хлорид кальцію; Варіант 2 – карбонат натрію, сульфат натрію, сульфіт натрію, хлорид натрію; Варіант 3 – сульфатна кислота, сульфат натрію, сульфіт натрію, хлоридна кислота; Варіант 4 – нітратна кислота, нітрат натрію, хлорид натрію, сульфід натрію.
|
|||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1455; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.216 (0.009 с.) |