
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослідження кінетики контракції біологічних тканинСодержание книги
Поиск на нашем сайте Мета роботи: дослідити розвиток контракції желатину у воді при різних температурах. Прилади та матеріали: посудинка з пробкою-капіляром, годинник, вимірювальний мікроскоп, термостат, штатив, желатин у гранулах. Теоретичні відомості
Більшість біологічних тканин - гелі або драглисті речовини. Вони мають багато пор і у рідині збільшують свій об'єм і вагу. Поглинання рідини гелем називають набуханням. Різні види гелів вибірково набухають у рідинах, кожен з них має певний розчинник, у якому набухання максимальне. Хоча об'єм гелів при набуханні збільшується, він завжди менший, ніж сумарний об'єм гелю і розчинника до набухання. А це означає, що при набуханні відбувається стискування системи, так звана контракція або стрикція. Як і у випадку поверхневого натягу рідин, контракцію забезпечують сили молекулярного зчеплення. Зменшення об'єму набухаючого гелю, в порівнянні з сумою його початкового об'єму та об'єму поглинутого розчинника, пояснюється упорядкуванням молекул розчинника навколо міцели гелю, утворенням навколо міцели оболонки із більш щільним розміщенням молекул. Крім того, згідно з сучасним положенням колоїдної хімії, розчинник не тільки адсорбується міцелою, а й проникає всередину її. Обидва процеси можуть відбуватися одночасно і обумовити зменшення об'єму системи. Явище контракції властиве також і білкам живих тканин. Залежно від фізико-хімічної структури тканин і патологічного стану характер контракції може змінюватися.
Для вивчення контракції користуються спеціальною посудинкою з притертою пробкою, крізь яку проходить капіляр (рис.1):
Рис. 1.
У посудинку поміщують біологічну тканину, наливають розчин тих речовин, вплив яких на контракцію досліджується. Зміну сумарного обєму системи "тканина-рідина" контролюють за положенням меніска в капілярі посудинки. Посування меніска спостерігають за допомогою вимірювального мікроскопа, обладнаного окуляр-мікрометром. Вивчення кінетики контракції можливе тільки при постійній температурі, інакше термічне розширення скла посудинки і речовин в ній зіпсують виміри. Тому посудинку вміщують у водяний термостат. У даній роботі контракцію досліджують на желатині – гелі тваринного походження, та воді − кращому розчиннику для желатину. Порядок виконання роботи:
1. Помістить гранули желатину у посудинку для вимірювання контракції, залийте посудинку до краю водою і закрийте пробкою з капіляром. 2. Відсмоктуючи воду капіляра, установіть меніск на його середині. 3. Помістіть посудинку у термостат і встановіть температуру, вказану викладачем. Наведіть на меніск об'єктив мікроскопа і визначайте положення меніска на шкалі окуляр-мікрометра через кожні 5 хвилин (досліди припинить тоді, коли положення меніска залишається незмінним 5-10 хв.). 4. Встановіть на термостаті температуру на 5-10°С вище початкової і повторіть п.п. 1-3. Результати вимірювань занесіть у таблицю:
Остаточний результат подайте у вигляді графіка, де на осі абсцис відкладено час у хвилинах, а на осі ординат - зміщення меніска для обох значень температури. Порівняйте обидві криві і поясніть різницю.
Дайте відповіді на запитання:
1. У чому полягає явище контракції тканин, який його механізм? 2. Чому при дослідженні контракції посудинку з тканиною треба поміщати у термостат? 3. Чи зміниться форма графіка, якщо стан контракції желатину фіксувати кожні 3 хвилини?
Лабораторна робота № 7 ВИЗНАЧЕННЯ МОЛЯРНОЇ МАСИ ГЛЮКОЗИ МЕТОДОМ ОСМОМЕТРІЇ Прилади та матеріали: термометр, посудина з водою, осмометрична трубка, терези з набором різноваг, штангенциркуль, порошок глюкози. Мета роботи: вивчення явища осмосу і оволодіння одним із методів вивчення молярних мас складних біологічних сполук. Теоретичні відомості
Фізично однорідні (гомогенні) суміші двох або декількох речовин називають розчинами. Фізична однорідність досягається рівномірним перемішуванням молекул в наслідок їх теплового руху. В цьому відношення розчини відрізняються від механічних сумішей, в яких перемішується не молекули, а макроскопічні частинки речовини. Від хімічних сполук розчини відрізняються тим, що в хімічні сполуки речовини вступають в строго визначених масових пропорціях, тоді як в розчинах відносні кількості речовин можуть змінюватися у більш-менш широких межах. Але розчини не є і суто механічними сумішами молекул - за рахунок взаємодії молекул по деяким ознакам розчини наближаються до хімічних сполук. Сукупність всіх речовин у складі розчину утворює групу компонентів розчину. Якщо однієї речовини в розчині більше, ніж інших, то вона називається розчинником, а решта речовин − розчиненими речовинами. Найбільш часто застосовуються рідкі розчини, що складаються з двох речовин. Кількісно розчини характеризуються концентрацією, яка визначає відносний вміст компонентів в розчині. Розрізняють вагові (масові), молярні та об'ємні концентрації. Вагова концентрація − це відношення ваги даного компонента до загальної ваги розчину. Як правило вагова концентрація виражається в процентах. У теоретичних дослідженнях більш зручна молярна концентрація, яка визначається відношенням числа молів фіксованого компонента до загального числа молів розчину. Об’ємною концентрацією компонента розчину називається його кількість в кілограмах (грамах) чи молях в одиниці об'єму розчину. Якщо два однотипні двокомпонентні розчини різної концентрації відокремити один від одного пористою перегородкою, через яку можуть проходити молекули і розчинника, і розчиненої речовини, то, завдяки явищу дифузії, буде відбуватися вирівнювання концентрації обох розчинів до однакової величини. Існують перегородки, які проникні для молекул розчинника, але непроникні для молекул розчиненої речовини. Такі перегородки або мембрани називають напівпроникними. До них відносяться різні оболонки і тканини рослинного і тваринного походження. Для водного розчину цукру такою напівпроникною мембраною є, наприклад, бичачій міхур, кишкова тканина та деякі штучні полімерні плівки. Пори в таких мембранах досить широкі для проходження через них молекул води, але не достатньо великі для більших за розміром молекул цукрози. При умові що два розчини різної концентрації відокремлені один від одного напівпроникною мембраною, вирівнювання концентрації розчину не буде відбуватись, точніше воно буде відбуватись до певного моменту. Наприклад, коли розчин відокремлено від чистого розчинника напівпроникною мембраною, то спочатку молекули розчинника переходять в область, зайняту розчином, але згодом цей процес припиняється. При цьому в зоні розчину рідина знаходиться в умовах збільшеного тиску, порівняно з зоною розчинника, що проявляється у зміщенні рівнів розчину і розчинника на величину h (рис. 1,2). Явище проникнення молекул розчинника крізь напівпроникну мембрану в зону розчину називається осмосом. Різниця тисків між розчином і розчинником по різні сторони напівпроникної мембрани, при який осмос припиняється, називається осмотичним тиском. Осмос відбувається також і в тих випадках, коли напівпроникна перегородка відокремлює два розчини різної концентрації.

Напівпроникна мембрана Рис. 1 Рис. 2
Якщо, наприклад, тваринний міхур, наповнений спиртом, міцно зав'язати і опустити у воду, то він почне роздуватись і навіть може лопнути під дією сил осмотичного тиску. Якщо ж міхур заповнити водою і опустити в спирт, то, навпаки, він буде стискуватись. Справа в тому, що стінки міхура проникні для води, але непроникні для спирту. Аналогічні явища набухання і розриву оболонок спостерігаються при зануренні у воду насіння рослин, фруктів та овочів. Ними пояснюються "оживлення" пониклих квітів, опущених у воду. Слід підкреслити, що причиною осмосу є розчинена речовина, яка ніби "всмоктує" розчинник крізь напівпроникну мембрану. З точки зору термодинаміки виникнення додаткового (осмотичного) тиску в розчині зумовлено необхідністю підвищення хімічного потенціалу молекул розчинника в зоні розчину, оскільки він знижується в присутності розчиненої речовини. А рівність хімічного потенціалу в різних частинах системи (розчинник – напівпроникна мембрана - розчин) є необхідною умовою досягнення системою термодинамічної рівноваги. Як показує дослід, для слабких (розбавлених) розчинів величина осмотичного тиску для даної температури не залежить від природи розчинника і розчиненої речовини, а залежить тільки від молярної об'ємної концентрації останньої. Тим більше, залежність осмотичного тиску від абсолютної температури Т, об'єму V, який займає розчин, маси т і молярної маси μ розчиненої речовини еквівалентна рівнянню Клапейрона-Менделєєва:
де R =8,31 Дж/(моль∙К) - універсальна газова стала, що вказує на ідентичність поведінки молекул розчиненої речовини в слабкому розчині з поведінкою молекул ідеального газу. Іншими словами, осмотичний тиск відіграє роль парціального тиску розчиненої речовини в об'ємі розчину. Співвідношення (1) для осмотичного тиску розчиненої речовини носить назву закону Вант-Гоффа (1887). При дисоціації розчиненої речовини за рахунок збільшення числа частинок, відбувається збільшення осмотичного тиску і навпаки - при групуванні молекул розчиненої речовини в певні комплекси (асоціації), осмотичний тиск зменшується. Осмос відіграє важливу роль в житті рослин і тварин. Ним у значній мірі визначається розподіл води і розчинених в ній речовин у тканинах, завдяки властивості напівпроникності мембран рослинних і тваринних клітин. Величина осмотичного тиску в рослинних клітинах може досягати 2-4 атм, а інколи і 20 атм. Тільки завдяки цьому вода з грунту може поступати по стовбурах дерев на значну висоту. Наявність осмотичного тиску в клітинах живого організму робить їх більш пружними, здатними відновлювати свою форму і протидіяти зовнішньому тиску. В біології це, зумовлене осмосом явище, відоме як тургор клітин. Величина осмотичного тиску крові людини складає 7-8 атм. Однак різниця осмотичних тисків крові і лімфи, а лише вона визначає перерозподіл води між лімфою і кров'ю, складає всього 0,03-0,04 атм. Взагалі, завдяки наявності складних механізмів регулювання, клітини мають лише незначно підвищений або рівний осмотичний тиск, по відношенню до внутрішніх рідин організму, що їх омивають. Падіння осмотичного тиску в клітинах, наприклад при обезводненні організму, приводить до їх сплющення (колапс клітин). Обезсолювання організму може привести до набухання і розриву клітин (осмотичний шок клітин). Різні кровозамінники і фізіологічні розчини підбирають таким чином, щоб вони зумовлювали осмотичний тиск, відповідний внутрішнім рідинам організму, як кажуть, були б ізотонічними або ізоосмотичними по відношенню до них. Так званий онкотичний тиск складає частку загального осмотичного тиску і зумовлюється високомолекулярними компонентами розчину. Онкотичний тиск відіграє найважливішу роль в утворенні міжклітинної рідини, а також в фільтраційних процесах в клітинних мембранах або в стінках капілярів, наприклад при утворенні первинною сечі в ниркових нефронах та фільтрації в них крові. Метод вимірювання
Осмотичний тиск вимірюють за допомогою осмометрів. Принцип їх дії пояснюється на рис. 2. У посудину з розчинником занурюється менша за розмірами посудина з досліджуваним розчином (осмометрична трубка), контактна поверхня якої з розчином має напівпроникну мембрану. Осмотичний тиск Pосм розчиненої речовини викликає підвищення рівня рідини в розчині до такої величини h, доки додатковий гідростатичний тиск в осмометричній трубці
(ρ - густина розчину, g =9,81 м2/с - прискорення вільного падіння) не компенсує осмотичний тиск
∆P=Pосм (3)
Розрізняють статичний та динамічний методи вимірювань осмотичного тиску. Перший базується на вимірюванні устаткованого значення величини h, що потребує досить тривалого проміжку часу, доки перепад рівнів поверхонь розчину і розчинника встановиться остаточно. Другий метод зводиться до вимірювання швидкостей v всмоктування і видавлювання розчинника в розчин чи з нього при різних значеннях величини надлишкового гідростатичного тиску ∆P з наступною інтерполяцією одержаних даних до v =0 при ∆P=Pосм. В роботі використовується статичний метод. Головне практичне застосування осмометрії - визначення молярних мас таких хімічних сполук, які не можуть бути одержані в газоподібному стані, наприклад білків та полімерів. Застосуємо закон Вант-Гоффа для визначення молярної маси μ глюкози. З рівності надлишкового гідростатичного (2) і осмотичного (1) тисків одержимо:
Таким чином, визначення молярної маси μ, глюкози зводиться до вимірів розчиненої маси т глюкози, об'єму V і густини ρ та температури Т розчину, різниці рівнів поверхонь розчину і розчинника h. Реальні розчини внаслідок дисоціації молекул розчиненої речовини, при відсутності зворотного процесу асоціації молекул, завжди мають осмотичний тиск Р´осм більший, ніж осмотичний Росм ідеального розчину. Відношення Р´осм/Росм=r (5)
називається осмотичним коефіцієнтом. Осмотичний коефіцієнт зростає із підвищенням концентрації розчину. Порівнюючи вирази (1) і (5), можна задати осмотичний коефіцієнт r як відношення теоретичної молярної маси μm до експериментальною молярної маси μе розчиненої речовини
r= μm / μе (6)
Порядок виконання роботи:
1. Уважно ознайомтесь з лабораторною установкою. 2. Зважте задану викладачем масу глюкози т і розчиніть її в трубці осмометра. 3. Виміряйте різницю h рівній після того, як вона перестане змінюватись. 4. Виміряйте штангенциркулем внутрішній діаметр осмотичної трубки d іза формулою
визначте додатковий об'єм 5. За формулою
визначте масову концентрацію (парціальну густину) розчиненої глюкози. 6. Виміряйте за допомогою термометра температуру розчину t і перерахуйте її в температуру Т за шкалою Кельвіна: Т= t+273. 7. За формулою (4) обчисліть молярну масу μ глюкози. 8. Порівняйте одержану молярну масу глюкози з її значенням згідно хімічній формулі (С6Н12О6) і, використовуючи формулу (6), визначте осмотичний коефіцієнт r.
Результати вимірювань і розрахунків занесіть до таблиці:
Дайте відповіді на запитання:
1. Дайте визначення явища осмосу. Що таке осмотичний тиск? 2. Сформулюйте закон Вант-Гоффа. 3. Який тиск більший для даного розчину - онкотичний чи осмотичний? Лабораторна робота № 8
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 406; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.011 с.) |







 , (1)
, (1) , (2)
, (2) звідки
звідки  (4)
(4)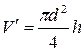
 , на який збільшиться розчин, після осмотичного всмоктування розчинника через напівпроникну мембрану. Початковий об'єм води в трубці осмометра
, на який збільшиться розчин, після осмотичного всмоктування розчинника через напівпроникну мембрану. Початковий об'єм води в трубці осмометра  визначається в залежності від типорозміру трубки осмометра. За формулою V =
визначається в залежності від типорозміру трубки осмометра. За формулою V = 



