

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
|
Термодинамічні константи хімічних речовин
| Речовина
|  , , 
|  , , 
|  , , 
| | Al2O3(корунд)
| –1676,0
| –1582,0
| 50,92
| | Al2S3(к)
| –509,0
| –23,0
| 96,20
| | Al(OH)3(к)
| –1315,0
| –1157,0
| 71,10
| | AlCl3(к)
| – 704,6
| – 629,0
| 109,29
| | AgCl (к)
| – 126,78
| – 109,54
| 96,23
| | BaCO3(к)
| – 1217
| – 1137,2
| 112,13
| | BaO(к)
| – 553.9
| – 525,4
| 70,30
| | CH4(г)
| – 74,85
| – 50,85
| 186,27
| | C2H2(г)
| 226,75
| 209,21
| 200,82
| | C2H4(г)
| 52,30
| 68,14
| 219,45
| | C2H6(г)
| – 84,67
| – 32,93
| 229,49
| | CH3COOH(р)
| – 484,09
| – 389,36
| 159,83
| | C2H5OH(г)
| – 234,80
| – 167,96
| 281,38
| | C2H5OH(р)
| – 276,98
| – 174,15
| 160,67
| | C6H6(р)
| 49,03
| 124,38
| 173,26
| | С6H12О6(к)
| – 1273
| – 919,5
| 212,13
| | CCl4(р)
| – 132,84
| – 62,66
| 216,19
| | CaBr2(к)
| – 674,9
| – 656,1
| 130,00
| | CaC2(к)
| – 59,9
| – 64,9
| 69,96
| | CaCl2(к)
| – 796,3
| – 748,9
| 108,37
| | CO(г)
| –110,5
| –137,1
| 197,55
| | CO2(г)
| –393,5
| –394,4
| 213,66
| | СаО(к)
| –635,5
| –604,2
| 38,07
| | CaCO3(к)
| –1207
| –1129,6
| 91,71
| | Ca(OH)2(к)
| – 985,12
| – 897,52
| 83,39
| | Ca3(PO4)2(к)
| – 4123,6
| – 3887,6
| 235,98
| | CuO(к)
| –162,0
| –129,9
| 42,63
| | Cu(NO3)2(к)
| – 307,11
| – 114,22
| 191,30
| | CuSO4(к)
| – 770,9
| – 661,8
| 109,20
| | CrO3 (к)
| – 590,36
| – 513,44
| 73,22
| | Cr2O3 (к)
| – 1140,56
| – 1058,97
| 81,17
| | FeCl3 (к)
| – 399,70
| – 334,20
| 130,10
| | FeO (к)
| – 264,85
| – 244,30
| 60,75
| | Fe2O3 (к)
| – 822,16
| – 740,34
| 87,45
| | Fe3O4 (к)
| – 1117,13
| – 1014,17
| 146,19
| | HBr (г)
| – 36,38
| – 53,43
| 198,58
| | HCl (г)
| – 92,31
| – 95,30
| 186,79
| | HF (г)
| – 273,30
| – 275,41
| 173,67
| | Речовина
|  , , 
|  , , 
|  , , 
| | HI (г)
| 26,36
| 1,58
| 206,48
| | H2O (г)
| – 241,8
| – 228,61
| 188,72
| | H2O (р)
| – 286,0
| – 237,23
| 69,95
| | H2O2 (р)
| – 187,86
| – 120,52
| 109,60
| | H2S(г)
| –21,0
| –33,8
| 205,70
| | KBr(к)
| – 392,2
| – 379,2
| 95,94
| | KCl (к)
| – 436,68
| – 408,93
| 82,55
| | KClO3(к)
| – 391,20
| – 289,80
| 142,97
| | KNO3(к)
| – 492,46
| – 392,75
| 132,88
| | MgCl2(к)
| – 644,80
| – 595,30
| 89,54
| | MgO (к)
| – 601,8
| – 569,6
| 27,07
| | NH3 (г)
| – 45,94
| – 16,48
| 192,66
| | NH4Cl (к)
| – 314,22
| – 203,22
| 95,81
| | NH4NO3(к)
| – 365,43
| – 183,93
| 151,04
| | (NH4)2SO4
| – 1180,0
| – 901,3
| 220,08
| | NO(г)
| 90,3
| 80,6
| 210,64
| | NO2(г)
| 33,0
| 51,5
| 240,06
| | NiO (к)
| – 239,7
| – 211,6
| 37,99
| | NaBr (к)
| – 361,41
| – 349,34
| 86,82
| | NaCl (к)
| – 411,12
| – 384,13
| 72,13
| | Na2CO3(к)
| – 1130,80
| – 1048,20
| 138,80
| | NaNO3(к)
| – 466,70
| – 365,97
| 116,50
| | P2O5 (к)
| – 1507,20
| – 1371,7
| 140,30
| | Pb(NO3)2(к)
| – 451,70
| – 258,90
| 217,90
| | РbО (черв.)
| –219,3
| –189,1
| 66,11
| | РbO2 (к)
| –276,6
| –218,3
| 71,92
| | SO2 (г)
| – 296,90
| – 300,21
| 248,07
| | SO3 (г)
| – 395,85
| – 371,17
| 256,69
| | SnO2(к)
| – 580,8
| – 519,3
| 52,30
| | TiO2 (к)
| – 943,9
| – 888,6
| 50,33
| | ZnO (к)
| – 348,11
| – 320,7
| 43,51
| | ZnS(к)
| – 205,6
| – 200,9
| 57,66
|
Примітка. Значення  і і  для простих речовин дорівнюють нулю; для простих речовин дорівнюють нулю;
к – кристалічний, г – газоподібний, р – рідкий.
Додаток 2
Добуток розчинності при 25 0С (n – кількість йонів)
| Сполука
| ДР,
(г-йон/л)n
| Сполука
| ДР,
(г-йон/л)n
| Сполука
| ДР,
(г-йон/л)n
| | AgBr
AgCN
AgCl
AgI
AgBrO3
Ag2CrO4
Ag2SO4
Al(OH)3
Ag2S
BaSO3
BaSO4
| 5,0·10-13
1,6·10-14
1,7·10-10
8,1·10-17
6,0·10-5
4,4·10-12
1,2·10-5
4,0·10-33
2,5·10-25
9,5·10-10
1,5·10-9
| Ca(OH)2
CaSO4
Cd(OH)2
Co(OH)2
CuCl
CuІ
Fe(OH)2
Hg2Br2
Hg2Cl2
Hg2І2
HgS
| 6,0·10-6
2,4·10-5
1,7·10-14
2,5·10-16
3,2·10-7
1,1·10-12
1,4·10-15
4,0·10-23
1,0·10-18
4,0·10-29
1,6·10-52
| Hg2SO4
Ni(OH)2
PbBr2
PbСl2
PbІ2
Pb(OH)2
PbSO4
TIBr
TICl
Zn(OH)2
ZnS
| 6,2·10-7
1,3·10-16
4,5·10-6
1,5·10-5
8·10-9
5·10-16
1,6·10-8
3,6·10-6
1,8·10-4
4,3·10-17
1,3·10-23
|
Додаток 3
Розчинність кислот, основ і солей у воді
| Аніони
| Катіони
| 
| 
| 
| 
| 
| 
| 
| 
| 
| 
| 
| 
| 
| 
| 
| 
|
| Р
| Р
| –
| Р
| М
| Н
| Н
| Н
| –
| Н
| Н
| Н
| Н
| Н
| 
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| Р
| 
| Р
| Р
| Р
| Р
| М
| Н
| Н
| Р
| Р
| –
| Н
| Н
| Н
| М
| Н
| 
| Р
| Р
| Р
| Н
| Р
| Р
| Р
| Р
| Р
| Р
| М
| Р
| Р
| Р
| Р
| 
| Р
| Р
| Р
| Н
| Р
| Р
| Р
| Р
| Р
| Н
| Н
| Р
| ?
| Р
| ?
| 
| Р
| Р
| Р
| Н
| –
| –
| –
| Н
| Н
| Н
| Н
| Н
| –
| –
| –
| 
| Р
| Р
| Р
| Н
| Н
| Н
| М
| М
| ?
| Н
| Н
| Н
| ?
| ?
| –
| 
| Р
| Р
| Р
| М
| Н
| М
| Р
| Р
| Р
| –
| Н
| Р
| Р
| Р
| Р
| 
| Р
| Р
| Р
| Н
| Н
| Н
| Н
| Н
| Н
| ?
| Н
| Н
| ?
| ?
| ?
| 
| Н
| Р
| Р
| ?
| Н
| Н
| Н
| Н
| ?
| ?
| Н
| Н
| ?
| ?
| ?
| 
| Р
| Р
| Р
| Н
| Н
| Н
| Н
| Н
| Н
| Н
| Н
| Н
| Н
| Н
| Н
|
Примітка: Р – розчиняється, M – мало розчиняється, Н – практично не розчиняється, риска – сполука розкладається водою або не існує,? – немає достовірних відомостей про існування сполуки
Додаток 4
Значення ебуліоскопічних та кріоскопічних констант
Деяких розчинників
| Розчинник
| KЕ
| Kкр
| Розчинник
| KЕ
| Kкр
| Розчинник
| KЕ
| Kкр
| | вода
| 0,52
| 1,86
| фенол
| 3,6
| 7,39
| Тетрахлорометан (ССl4)
| 5,3
| 2,98
| | бензол
| 2,57
| 5,1
| анілін
| 2,6
| 5,87
| ацетатна кислота
| 3,1
| 3,9
| | ацетон
| 1,48
| 2,4
| етанол
| 1,16
| –
| нітробензен
| 5,27
| 6,90
| | хлороформ
| 3,88
| 4,9
|
|
|
| сірковуглець
| 2,37
| –
|
Додаток 5
Стандартні електродні потенціали металів у водних розчинах
| Електродна пара
| φ0, В
| Електродна пара
| φ0, В
| Електродна пара
| φ0, В
| | Li+/Li
| –3,045
| Ti2+/Ti
| –1,630
| Sn2+/Sn
| –0,136
| | Rb+/Rb
| –2,925
| Ti3+/Ti
| –1,208
| Pb2+/Pb
| –0,126
| | K+/K
| –2,924
| Mn2+/Mn
| –1,192
| Fe3+/Fe
| –0,037
| | Cs+/Cs
| –2,923
| V2+/V
| –1,175
| 2H+/H2
| 0,000
| | Ra2+/Ra
| –2,916
| Nb3+/Nb
| –1,100
| Sb3+/Sb
| +0,240
| | Ba2+/Ba
| –2,905
| Cr2+/Cr
| –0,852
| Bi3+/Bi
| +0,317
| | Sr2+/Sr
| –2,888
| Zn2+/Zn
| –0,763
| Co3+/Co
| +0,330
| | Ca2+/Ca
| –2,864
| Cr3+/Cr
| –0,744
| Cu2+/Cu
| +0,345
| | Na+/Na
| –2,711
| Ga3+/Ga
| –0,560
| Cu+/Cu
| +0,520
| | Ac3+/Ac
| –2,600
| Fe2+/Fe
| –0,440
| Hg22+/2Hg
| +0,850
| | La3+/La
| –2,522
| Cd2+/Cd
| –0,403
| Ag+/Ag
| +0,799
| | Ce3+/Ce
| –2,483
| In3+/In
| –0,338
| Pb4+/Pb
| +0,840
| | Y3+/Y
| –2,372
| Ti3+/Ti
| –0,368
| Hg2+/Hg
| +0,852
| | Mg2+/Mg
| –2,363
| Tl+/Tl
| –0,336
| Pd2+/Pd
| +0,915
| | Be2+/Be
| –1,847
| Co2+/Co
| –0,277
| Pt2+/Pt
| +0,963
| | U3+/U
| –1,798
| Ni2+/Ni
| –0,234
| Au3+/Au
| +1,498
| | Al3+/Al
| –1,663
| Mo3+/Mo
| –0,200
| Au+/Au
| +1,691
|
Додаток 6
Стандартні окисно-відновні потенціали деяких
Окисно-відновних систем у водних розчинах
| Система
| φ0 , В
| AgCl + ē = Ag + Cl 
| + 0,222
| Ag  + ē = Ag + ē = Ag
| + 0,800
| As 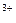 +3ē = As +3ē = As
| + 0,300
| Br  + 2ē = 2Br + 2ē = 2Br 
| + 1,087
| BrO  + 3H + 3H  O + 6ē = Br O + 6ē = Br  + 6OH + 6OH 
| + 0,610
| Cl  + 2ē = 2Cl + 2ē = 2Cl 
| + 1,359
| 2HClO + 2H  + 2ē = Cl + 2ē = Cl  + 2H + 2H  O O
| + 1,630
| ClO  + 6H + 6H  + 6ē = Cl + 6ē = Cl  + 3H + 3H  O O
| + 1,450
| ClO  + 3H + 3H  O + 6ē = Cl O + 6ē = Cl  + 6OH– + 6OH–
| + 0,630
| CrO  + 4H + 4H  O + 3ē = Cr O + 3ē = Cr 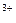 + 8OH + 8OH 
| – 0,125
| CrO  + 4H + 4H  + 3ē = CrO + 3ē = CrO  + 2H2O + 2H2O
| + 0,945
| Cr2O  + 14H + 14H  + 6ē = 2Cr + 6ē = 2Cr 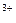 + 7H2O + 7H2O
| + 1,333
| Cu  + ē = Cu + ē = Cu 
| + 0,158
| F  + 2ē = 2F + 2ē = 2F 
| + 2,870
| Fe 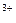 + ē = Fe + ē = Fe 
| + 0,771
| Fe(CN)  + ē = Fe(CN) + ē = Fe(CN) 
| + 0,356
| FeO  + 8H + 8H  + 3ē = Fe + 3ē = Fe 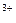 + 4H + 4H  O O
| + 1,700
| 2H  + 2ē = H + 2ē = H 
| + 0,000
| H  + 2ē = 2H + 2ē = 2H 
| – 2,251
| H  O O  – 2ē = O – 2ē = O  + 2H + 2H 
| – 0,682
| H  O O  + 2ē = 2OH + 2ē = 2OH 
| + 0,880
| H  O O  + 2H + 2H  + 2ē = 2H + 2ē = 2H  O O
| + 1,776
| Hg  + 2ē = Hg + 2ē = Hg
| +0,854
| I  + 2ē = 2I + 2ē = 2I 
| + 0,536
| HIO + H  + 2ē = I + 2ē = I  + H + H  O O
| + 0,990
| 2IO  + 12H + 12H  + 10ē = I + 10ē = I  + 6H + 6H  O O
| + 1,190
| IO  + 3H + 3H  O + 6ē = I O + 6ē = I  + 6OH + 6OH 
| + 0,260
| MnO  + 4H + 4H  + 2ē = Mn + 2ē = Mn  + 2H + 2H  O O
| + 1,228
| MnO  + 4H + 4H  + 2ē = MnO + 2ē = MnO  + 2H + 2H  O O
| + 2,257
| MnO  + ē = MnO + ē = MnO 
| + 0,564
| | Система
| φ0 , В
| MnO  + 2H + 2H  O + 3ē = MnO O + 3ē = MnO  + 4OH + 4OH 
| + 0,600
| MnO  + 8H + 8H  + 5ē = Mn + 5ē = Mn  + 4H + 4H  O O
| + 1,507
| MnO  + 4H + 4H  + 3ē = MnO + 3ē = MnO  + 2H + 2H  O O
| + 1,692
| HNO  + H + H  + ē = NO + H + ē = NO + H  O O
| + 1,004
| NO  + 2H + 2H  + 2ē = NO + 2ē = NO  + H + H  O O
| + 0,838
| NO  + 2H + 2H  + ē = NO + ē = NO  + H + H  O O
| + 0,772
| NO  + 4H + 4H  + 3ē = NO + 2H + 3ē = NO + 2H  O O
| + 0,957
| 2NO  + 12H + 12H  + 10ē = N + 10ē = N  + 6H + 6H  O O
| + 1,24
| NO  + 10H + 10H  + 8ē = NH + 8ē = NH 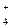 + 3H + 3H  O O
| + 0,880
| Ni(OH)  + ē = Ni(OH) + ē = Ni(OH)  + OH + OH 
| + 0,49
| O  + 2H + 2H  + 2ē = O + 2ē = O  + H + H  O O
| + 2,075
| O  + 2H + 2H  O + 4ē = 4OH O + 4ē = 4OH 
| + 0,401
| P + 3H  O + 3ē = PH O + 3ē = PH  + 3OH + 3OH 
| – 0,890
| H  PO PO  + 2H + 2H  + 2ē = H + 2ē = H  PO PO  + H + H  O O
| – 0,276
| Pb  + 2ē = Pb + 2ē = Pb 
| + 1,694
| Pb  + 2ē = Pb + 2ē = Pb
| – 0,130
| PbO  + 4H + 4H  + 2ē = Pb + 2ē = Pb  + 2H + 2H  O O
| + 1,455
| PbO  + SO + SO  + 4H+ + 2ē = PbSO + 4H+ + 2ē = PbSO  + 2H + 2H  O O
| + 1,685
| PtCl  + 2ē = PtCl + 2ē = PtCl  + 2Cl– + 2Cl–
| + 0,720
| S + 2ē = S 
| + 0,480
| SO  + H + H  O + 2ē = SO O + 2ē = SO  + 2OH + 2OH 
| – 0,932
| SO  + 4H + 4H  + 2ē = H + 2ē = H  SO SO  + H + H  O O
| + 0,172
| SO  + 8H + 8H  + 6ē = S + 4H + 6ē = S + 4H  O O
| + 0,357
| SO  + 8H + 8H  + 8ē = S + 8ē = S  + 4H + 4H  O O
| + 0,149
| SO  + 10H + 10H  + 8ē = H + 8ē = H  S + 4H S + 4H  O O
| + 0,31
| S  O O  + 2ē = 2SO + 2ē = 2SO 
| + 2,010
| Sn  + 2ē = Sn + 2ē = Sn 
| + 1,151
| Tl 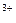 + 2ē = Tl + 2ē = Tl 
| + 1,280
| V 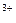 + ē = V + ē = V 
| – 0,255
| Sn  + 2ē = Sn + 2ē = Sn
| – 0,14
|
ЗМІСТ
| Правила роботи в хімічній лабораторії……………………………………..........
|
| |
Рекомендована література.......................................................................................
|
| | Змістовий модуль 1. Будова речовин та закономірності перебігу хімічних реакцій……………………………………………………….
|
| |
|
| |
Лабораторна робота № 1. Визначення теплового ефекту реакції.......................
|
| | Лабораторна робота № 2........................................................................................ Досліди до теми: Швидкість хімічних реакцій. Каталіз................................
Досліди до теми: Хімічна рівновага.................................................................
|
| | Змістовий модуль 2. Розчини електролітів і неелектролітів…….
|
| |
Лабораторна робота № 3........................................................................................
Досліди до теми: Електролітична дисоціація....................................................................
Досліди до тем: Йонні реакції в розчинах електролітів. Добуток розчинності малорозчинних речовин.....................................................................
Досліди до тем: Йонний добуток води. Водневий показник як кількісна характеристика кислотності-основності розчинів. Гідроліз солей.....................
Досліди до теми: Твердість води та способи її усунення..............................
|
| | Змістовий модуль 3. Електрохімічні процеси. Конструкційні матеріали
|
| |
Лабораторна робота № 4. Окисно-відновні реакції..............................................
|
| | Лабораторна робота № 5. Гальванічні елементи..................................................
|
| | Лабораторна робота № 6. Електроліз розчинів. Акумулятори...........................
|
| | Лабораторна робота № 7. Корозія металів. Методи захисту від корозії.............
|
| |
|
| | Лабораторна робота № 8.........................................................................................
Досліди до теми: Легкі конструкційні метали (алюміній, магній, титан).....
Досліди до теми: Конструкційні метали – залізо, кобальт, нікель................
Досліди до теми: Конструкційні метали – мідь, хром....................................
|
| |
Додатки.....................................................................................................................
|
|
|



 ,
, 
 ,
,  ,
, 
 і
і  для простих речовин дорівнюють нулю;
для простих речовин дорівнюють нулю;

























 + ē = Ag
+ ē = Ag
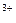 +3ē = As
+3ē = As
 + 2ē = 2Br
+ 2ē = 2Br  + 3H
+ 3H  + 4H
+ 4H  + 2H2O
+ 2H2O
 + 14H
+ 14H  + ē = Cu
+ ē = Cu  + ē = Fe(CN)
+ ē = Fe(CN) 
 + ē = MnO
+ ē = MnO 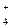 + 3H
+ 3H  + ē = Ni(OH)
+ ē = Ni(OH)  + 2H
+ 2H  + 2ē = Pb
+ 2ē = Pb  + 2ē = PtCl
+ 2ē = PtCl 
 + 2OH
+ 2OH  O
O  + 2ē = 2SO
+ 2ē = 2SO 


