
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослід 5. Забарвлення індикаторів у різних середовищахСодержание книги
Поиск на нашем сайте
Налийте по 3 пробірки дистильованої води, розчинів хлоридної кислоти та натрій гідроксиду. Згрупуйте пробірки по 3 так, щоб у групі були лужний, кислий і нейтральний розчини. У першу групу пробірок додайте фенолфталеїн, у другу – лакмус, у третю – метилоранж. Результати досліду запишіть у таблицю 3.2.
Таблиця 3.2
Дослід 6. Гідроліз солей а) Залежність характеру середовища розчинів від природи солей. У п’ять пробірок налийте по 1 мл дистильованої води і додайте лакмус. Внесіть у першу пробірку натрій карбонат, у другу – алюміній сульфат, у третю – натрій сульфат, у четверту – натрій ортофосфат. П’ята пробірка служить для порівняння отриманих кольорів. Які з випробуваних солей піддалися гідролізу? Складіть рівняння реакцій гідролізу. _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
б) Взаємне посилення гідролізу солі слабкої основи сіллю слабкої кислоти. Налийте в пробірку 5-6 крапель розчину алюміній сульфату і додайте такий же об’єм розчину натрій карбонату. Порівняйте спостереження з дослідом 2а. Відзначте виділення бульбашок газу (якого?) і утворення осаду (якого?) та характер середовища. Напишіть молекулярне і йонно-молекулярні рівняння гідролізу солі. ____________________________________________________________________________________________________________________________________________ ______________________________________________________________________ Досліди до теми: Твердість води та способи її усунення Дослід 7. Визначення твердості води. Спосіб заснований на реакції між хлоридною кислотою і гідрогенкарбонатами: Ca(HCO3)2 + 2HCl → CaCl2 + 2H2O + 2CO2. При титруванні кислотою доданий у воду індикатор метиловий оранжевий змінить забарвлення, якщо в розчині з’явиться надлишок кислоти. Відміряйте циліндром у дві колби по 100 мл водопровідної води і додайте в кожну по 2-3 краплі метилового оранжевого. Одна колба – контрольна. В іншу приливайте із бюретки розчин із молярною концентрацією хлоридної кислоти 0,1 моль/л поки, від однієї краплі кислоти забарвлення із жовтого зміниться в оранжеве. Титрування повторюють 2-3 рази, обчислюють середній показник. Розрахунок тимчасовою твердості води (
____________________________________________________________________________________________________________________________________________ Завдання для самоконтролю до теми "Розчини" 1. Що називається розчином? Наведіть способи вираження вмісту розчиненої речовини в розчині. 2. Для процесів розчинення твердих речовин і газів у рідинах поясніть: – позитивне чи негативне значення має ентальпія розчинення; – позитивне чи негативне значення має ентропія розчинення; – як впливає підвищення температури на розчинність, користуючись принципом Ле-Шателье; – як впливає підвищення температури на розчинність за допомогою формули Гіббса; – як і чому впливає тиск на розчинність газів у рідинах, сформулюйте закон Генрі. 3. Які властивості розчинів називаються колегативними? 4. Які речовининазивають електролітами? Назвіть типи електролітів та наведіть приклади. 5. Який процес називають електролітичною дисоціацією? 6. На що вказує ступінь дисоціації? Як обчислити константу дисоціації? 7. Дайте визначення з точки зору теорії електролітичної дисоціації поняттям „кислоти, основи, солі”. 8. Що таке основність кислоти, кислотність основи? Напишіть рівняння ступінчастої дисоціації двохосновної кислоти та двокислотної основи. 9. Яка величина є кількісною характеристикою кислотності середовища? 10. Поясніть, чи відрізняються температури кристалізації розчинів, які містять у 1000 г води: а) 0,7 моль сахарози С12Н22О11 і 0,7 моль глюкози С6Н12О6; б) 100 г сахарози С12Н22О11 і 100 г глюкози С6Н12О6; в) 0,5 моль сахарози С12Н22О11 і 150 г глюкози С6Н12О6; г) 9 г карбаміду СО(NH2)2 і 9 г глюкози С6Н12О6; д) 0,2 моль гліцерину С3Н5(ОН)3 і 50 г глюкози С6Н12О6. 11. У радіатор автомобіля налили 9 л води і 2 л етиленгліколю С2Н6О2 (ρ = 1,11 г/мл). При якій найнижчій температурі можна після цього залишати автомобіль на відкритому повітрі, не побоюючись, що вода в радіаторі замерзне? Ккр.(Н2О) = 1,86. 12. Обчисліть осмотичний тиск розчину, який містить в 1,5 л води 135 г глюкози C6H12O6 при 00С. 13. Обчисліть температуру кипіння розчину, який містить 2 г нафталіну C10H8 в 20 г естеру, якщо температура кипіння естеру 35,50C, а його ебуліоскопічна константа 2,16. 14. При 315 К тиск насиченої пари над водою становить 8,2 кПа (61,5 мм. рт. ст.). На скільки знизиться тиск пари при цій температурі, якщо в 540 г води розчинити 36 г глюкози C6H12O6? 15. Знайдіть масу NaNO3, необхідну для приготування 300 мл 0,2 моль/лрозчину. 16. Скільки грамів Na2CO3 міститься в 500 мл розчину з молярною концентрацією солі 0,25 моль/л? 17. Чому дорівнює осмотичний тиск 0,5 моль/лрозчину глюкози C6H12O6 при 250С? 18. Розрахуйте масу етиленгліколю НОСН2СН2ОН, який потрібно додати до 7 кг води, щоб приготувати розчин, що буде замерзати при температурі 262 К. 19. Константа дисоціації масляної кислоти С3Н7СООН дорівнює 1,5 ∙ 10–5. Обчисліть ступінь її дисоціації в 0,005 моль/л розчині. 20. Обчисліть об’єм води, який треба додати до 300 мл 0,2 моль/л розчину оцтової кислоти, щоб ступінь дисоціації кислоти подвоївся? 21. Визначте, чи утвориться осад аргентум сульфату, якщо до 0,02 моль/лрозчину AgNO3 додати такий же об’єм розчину з молярною концентрацією еквівалентів H2SO4 1 моль/л? 22. Напишіть у йонно-молекулярній формі рівняння реакцій взаємодії між водними розчинами наступних речовин: а) NaHCO3 і HCl, б) FeCl3 і KOH, в) Pb(CH3COO)2 і Na2S, г) KHS і H2SO4, д) Zn(NO3)2 + KOH (надлишок), e) Ca(OH)2 + CO2, ж) Ca(OH)2 + CO2 (надлишок). 23. Обчисліть ступінь дисоціації гіпохлоритної кислоти НОСl у розчині з молярною концентрацією еквівалентів 0,2 моль/л, якщо константа дисоціації кислоти дорівнює 5,0 ∙ 10–8. 24. Обчисліть молярну концентрацію йонів Н+ у водних розчинах, якщо концентрація гідроксид-йонів складає: а) 10–4; б) 3,2·10–6; в) 7,4·10–11. 25. Обчисліть рН розчину з молярною концентрацією оцтової кислоти 0,01 моль/л, у якому ступінь її дисоціації дорівнює 0,04. 26. Які з перерахованих нижче солей піддаються гідролізу: ZnBr2, K2S, Fe2(SO4)3, MgSO4, Cа(NO3)2, K2CO3, Na3PO4, NaCl. Для кожної із солей, що гідролізується, напишіть у молекулярній та йонно-молекулярній формі рівняння гідролізу, укажіть реакцію середовища розчину солі. 27. В який колір буде забарвлений лакмус у водних розчинах KCN, NH4Cl, K2SO3, NaNO3, FeCl3, Na2CO3, Na2SO4? Відповідь поясніть. 28. Обчисліть рН розчинів, у яких концентрація йонів Н+ (моль/л) дорівнює: а) 4,6 · 10–7; б) 8,1 · 10–3; в) 2,7· 10–10. 29. Обчисліть тимчасову твердість води, в 1 л якої міститься 0,146 г магній гідрогенкарбонату. 30. Що таке тимчасова і постійна твердість? В яких одиницях вона вимірюється? 31. Які незручності зв’язані із застосуванням твердої води в паросиловому господарстві?
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 394; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.007 с.) |

 ) здійснюють за формулою:
) здійснюють за формулою: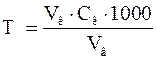 мг-екв/л, де
мг-екв/л, де  – об’єм розчину кислоти, який витрачений на титрування, мл;
– об’єм розчину кислоти, який витрачений на титрування, мл;  –молярна концентрація еквівалентів розчину хлоридної кислоти, моль/л;
–молярна концентрація еквівалентів розчину хлоридної кислоти, моль/л;  – об’єм води, мл.
– об’єм води, мл.


