
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Модуль 2. Закономірності перебігу хімічних процесівСодержание книги
Поиск на нашем сайте
Мета модуля – формування розуміння закономірностей перебігу реакцій і управління ними: енергетика, швидкість і рівновага взаємодіючих систем. За модулем студенти повинні вміти: – Обчислювати тепловий ефект хімічної реакції, зміну енергії Гіббса та ентропії за наслідком із закону Гесса, передбачати напрямок реакції. – Передбачати характер зміни ентропії в реакції за рівнянням та агрегатним станом вихідних речовин і продуктів. – Розраховувати критерій можливості процесів за різними температурами (зміну енергії Гіббса за відомими значеннями зміни ентальпії та ентропії). – Обчислювати швидкість прямої та зворотної реакцій, зміну швидкості (прискорення чи сповільнення) реакцій при зміні концентрацій речовин, тиску, температури. – Визначати напрямок зсуву рівноваги реакції при впливі зовнішніх факторів: концентрації вихідних речовин або продуктів, температури, тиску тощо. Література: [1] c. 74-110, [2] c. 119-155, [3] c. 130-149, 159-178, [4] c. 76-103, [5] c. 175-224. Лабораторна робота № 1 Визначення теплового ефекту реакції Мета роботи: визначити дослідним та розрахунковим методами тепловий ефект реакції нейтралізації хлоридної кислоти натрій гідроксидом та обчислити відносну похибку досліду. Обладнання та реактиви: калориметр, циліндр, термометр, розчин із молярною концентрацією натрій гідроксиду 1 моль/л, розчин із молярною концентрацією хлоридної кислоти 1 моль/л. Хід роботи 1. Зважте внутрішню склянку калориметра. 2. Відміряйте циліндром 50 мл розчину натрій гідроксиду (NaOH), внесіть його в склянку і визначте температуру. 3. Відміряйте циліндром 50 мл розчину хлоридної кислоти (HCl). 4. Термометр опустіть у розчин хлоридної кислотиі визначте температуру. 5. Розчин кислоти вилийте в розчин лугу і простежте за зміною температури. Запишіть кінцеву максимальну температуру розчину. 6. Отримані дані занесіть у таблицю 2.1.
Таблиця 2.1
7. Виконайте розрахунки: 7.1. Теплоти, що виділяється чи поглинається в калориметрі, за формулою: Q = (mp · Cp + mск · Сск) · DT, де mp – маса розчину, г; Cp – питома теплоємність розчину дорівнює питомій теплоємності води, тобто 4,184 Дж/(г·К); mск – маса склянки, г; Сскла – питома теплоємність скла дорівнює 0,753 Дж/(г·К). Q = ___________________________________________________________________ 7.2. Кількості моль-еквівалентів кислоти, що приймає участь в реакції. ____________________________________________________________________________________________________________________________________________ 7.3. Теплоти нейтралізації ( ____________________________________________________________________________________________________________________________________________ 7.4. Теплового ефекту ____________________________________________________________________________________________________________________________________________ 8. Визначте відносну похибку досліду за формулою:
9. Висновок _______________________________________________________________________________________________________________________________
Завдання для самоконтролю до теми "Хімічна термодинаміка"
1. Що вивчає термохімія? 2. Дайте визначення тепловому ефекту реакції. Назвіть типи хімічних реакцій за тепловим ефектом? 3. Сформулюйте закон Гесса та його наслідки. 4. Які рівняння називаються термохімічними? 5. Як визначити тепловий ефект реакції за стандартними ентальпіями утворення та стандартними ентальпіями згоряння? 6. Від чого залежить тепловий ефект реакції? 7. Які параметри стандартного стану? 8. Що характеризує ентропія? 9. За значенням якої термодинамічної функції можна визначити напрямок перебігу процесу для ізольованих та неізольованих систем? 10.Порівняйте а) Fe2O3(к) + 3CO(г) = 2Fe(к) + 3CO2(г); б) Fe2O3(к) + 3C(графіт) = 2Fe(к) + 3CO(г); в) Fe2O3(к) + 3Н2(г) = 2Fe(к) + 3Н2O(г). 11. Обчисліть значення а) Cu(к) + ZnO(к) = CuO(к) + Zn(к); б) FeO(к) + CO(г) = Fe(к) + CO2(г); в) 3Fe3O4(к)+ 8Al(к)= 9Fe(к) + 4Al2O3(к); г) FeO(к) + 1/2C(графіт) = Fe(к) + 1/2CO2(г). 12. Обчисліть значення 13. Визначте знак зміни ентропії а) 2NO(г) + O2(г) = 2NO2(г); б) 2H2S(г) + 3O2(г) = 2H2O(p) + 2SO2(г); в) CO2(к) = CO2(г); г) 2N2(г) + O2(г) = 2N2O(г); д) NH4NO3(к) =N2(г) + 2H2O(г) + ½O2(г). Лабораторна робота № 2 Досліди до теми: Швидкість хімічних реакцій. Каталіз
|
|||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 174; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.55.63 (0.005 с.) |

 ) для 1 моль еквівалента кислоти.
) для 1 моль еквівалента кислоти. реакції нейтралізації одного еквівалента сильної кислоти (чи лугу) за скороченим йонним рівнянням: Н+(р) + ОН–(р) = Н2О(р), якщо
реакції нейтралізації одного еквівалента сильної кислоти (чи лугу) за скороченим йонним рівнянням: Н+(р) + ОН–(р) = Н2О(р), якщо 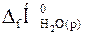 =–286,0 кДж/моль;
=–286,0 кДж/моль;  =–230,2 кДж/моль;
=–230,2 кДж/моль;  = 0.
= 0. ._____________________________________________
._____________________________________________ реакцій відновлення ферум (ІІІ) оксиду різними відновниками при 298 К та визначте, якою із речовин можна найбільш ефективно і повно відновити залізо із оксиду Fe2O3 за умови 1100 К.
реакцій відновлення ферум (ІІІ) оксиду різними відновниками при 298 К та визначте, якою із речовин можна найбільш ефективно і повно відновити залізо із оксиду Fe2O3 за умови 1100 К. реакцій та визначте, які з них можливі:
реакцій та визначте, які з них можливі: наступних процесів за рівняннями:
наступних процесів за рівняннями:


