
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация и номенклатура ферментов
КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ФЕРМЕНТОВ 1. В названии большинства ферментов содержится суффикс «аза», присоединенный к названию субстрата реакции (например: уреаза, сахараза, липаза, нуклеаза) или к названию химического превращения определенного субстрата (например: лактатдегидрогеназа, аденилатциклаза, фосфоглюкомутаза, пируваткарбоксилаза). Однако в употреблении сохранился ряд тривиальных, исторически закрепленных названий ферментов, которые не дают представления ни о субстрате, ни о типе химического превращения (например трипсин, пепсин, ренин, тромбин и др.). 2. Для того чтобы систематизировать имеющиеся в природе ферменты, Международный союз биохимии и молекулярной биологии (IUBMB) в 1961 г. разработал номенклатуру, согласно которой все ферменты делятся на шесть основных классов в зависимости от типа катализируемой химической реакции. Каждый класс состоит из многочисленных подклассов и подподклассов, в зависимости от преобразуемой химической группы субстрата, донора и акцептора преобразуемых группировок, наличия дополнительных молекул и т.д. Каждый из шести классов имеет свой порядковый номер, строго закрепленный за ним: 1-й класс - оксидоредуктазы; 2-й класс - трансферазы; 3-й класс - гидролазы; 4-й класс - лиазы; 5-й класс - изомеразы; 6-й класс - лигазы. Эта классификация необходима для точного определения фермента: для каждого фермента имеется кодовое число. Например, фермент маладегидрогеназа имеет систематическое название L-малат: NAD-оксидоредуктаза и кодовое число - 1.1.1.38. Первая цифра означает номер класса ферментов (в данном случае цифра 1 свидетельствует, что фермент относится к классу оксидоредуктаз); вторая цифра указывает на тип катализируемой реакции (в данном примере окислению подвергается гидроксильная группа); третья цифра означает наличие кофермента (в данном случае - кофермент NAD+), последняя цифра - это порядковый номер фермента в данной подгруппе. 3. Характеристика основных классов ферментов с примерами катализируемых ими реакций. 1. Оксидоредуктазы катализируют различные окислительно-восстановительные реакции. Класс делится на подклассы: а) дегидрогеназы катализируют реакции дегидрирования (отщепления водорода с переносом электронов от дегидрируемого субстрата на другой акцептор). В качестве акцепторов электронов используются коферменты NAD+, NADP+, FAD, FMN. К этому подклассу относятся ферменты малатдегидрогеназа (рис. 2.5), изоцитратдегидрогеназа, сукцинатдегидрогеназа, α-кетобутиратдегидрогеназа и др.;
б) оксидазы - катализируют реакции окисления с участием молекулярного кислорода (рис. 2.6);
в) оксигеназы (гидроксилазы) катализируют реакции окисления путем включения атома кислорода в гидроксильную группу молекулы субстрата. Реакция протекает с участием молекулярного кислорода, один атом которого присоединяется к субстрату, а второй участвует в образовании молекулы воды (рис. 2.7).
Коферменты реакции: тетрагидробиоптерин (Н4БП) и дигидробиоптерин (Н2БП) 2. Трансферазы - катализируют реакции переноса функциональных групп. В зависимости от переносимой группы подразделяются на подклассы: аминотрансферазы (рис. 2.8), ацилтрансферазы, метилтрансферазы, гликозилтрансферазы, киназы (фосфотрансферазы) (рис. 2.9).
ПФ - кофермент пиридоксальфосфат
АТФ является донором остатка фосфорной кислоты 3. Гидролазы катализируют реакции гидролиза (расщепления ковалентной связи с присоединением молекулы воды по месту разрыва). Разделяются на подклассы в зависимости от субстрата. Названия образуются в зависимости от молекулы субстрата или конкретной гидролизуемой химической связи: протеазы, амилазы, гликозидазы, нуклеазы, эстеразы, фосфатазы и др. Пример схемы реакции гидролиза молекулы белка приведен на рис. 2.10.
4. Лиазы - к лиазам относятся ферменты, отщепляющие от субстратов негидролитическим путем определенные группы, такие, как СО2, Н2О, NH2 SH2 и др., или присоединяющие (например, молекулу воды) по двойной связи. Реакция декарбоксилирования (отщепления молекулы CO2) приведена на рис. 2.11, а реакция присоединения молекулы воды (гидратазная реакция) - на рис. 2.12.
ПФ-кофермент пиридоксальфосфат
5. Изомеразы катализируют различные внутримолекулярные превращения (рис. 2.13).
6. Лигазы (синтетазы) катализируют реакции усложнения молекулы за счет присоединения друг к другу двух молекул с образованием ковалентной связи; при этом используется энергия АТФ или других макроэргических соединений (рис. 2.14).
15) Понятие об изоферментах (на примере лактатдегидрогеназы и креатинкиназы) Изоферменты - ϶ᴛᴏ молекулярные формы одного и того же фермента͵ возникшие в результате небольших генетических различий в первичной структуре фермента. Изоферменты определяют скорость и направление реакции благодаря разному сродству к субстрату и лигандам. Могут располагаться в различных тканях. К примеру, димерный фермент креатинкиназа (КК) представлен тремя изоферментными формами, составленными из двух типов субъединиц˸ M (мышца) и B (мозг). Креатинкиназа-1 состоит из субъединиц типа B и локализуется в головном мозге, креатинкиназа-2 – по одной М и В субъединице, активна в миокарде, креатинкиназа-3 содержит две М-субъединицы, специфична для скелœетной мышцы. Также существует пять изоферментов лактатдегидрогеназы (ЛДГ) – фермента͵ участвующего в обмене пировиноградной кислоты. Отличия между ними заключаются в разном соотношении субъединиц Н (сердце) и М (мышца) в четвертичной структуре белка. Лактатдегидрогеназы типов 1 (ЛДГ-1), имеющая четыре субъединицы Н (Н4) и ЛДГ-2 (H3M1) присутствуют в тканях с аэробным обменом (миокард, мозг, корковый слой почек), обладают высоким сродством к молочной кислоте (лактату) и превращают его в пируват. ЛДГ-4 (H1M3) и ЛДГ-5 (М4) находятся в тканях, склонных к анаэробному обмену (печень, скелœетные мышцы, кожа, мозговой слой почек), обладают низким сродством к лактату и катализируют превращение пирувата в лактат. В тканях с промежуточным типом обмена (селезенка, поджелудочная железа, надпочечники, лимфатические узлы) преобладает ЛДГ-3 (H2M2). C медицинской точки зрения появление в плазме крови изоферментов характерных для определённой ткани говорит о поражении клеток этого органа. К примеру, ЛДГ-1, ЛДГ-2 и КК-2 появляются при инфаркте миокарда, ЛДГ-5, ЛДГ-4 при травмах мышечной ткани.
|
||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 142; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.171.20 (0.007 с.) |
 Рис. 2.5. Реакция дегидрирования малата
Рис. 2.5. Реакция дегидрирования малата Рис. 2.6. Реакция, катализируемая ферментом цитохромоксидазой
Рис. 2.6. Реакция, катализируемая ферментом цитохромоксидазой Рис. 2.7. Реакция гидроксилирования фенилаланина.
Рис. 2.7. Реакция гидроксилирования фенилаланина. Рис. 2.8. Реакция, катализируемая ферментом АЛТ (Аланин-а-кетоглутаратаминотрансфераза), относящимся к классу трансфераз, подклассу аминотрансфераз.
Рис. 2.8. Реакция, катализируемая ферментом АЛТ (Аланин-а-кетоглутаратаминотрансфераза), относящимся к классу трансфераз, подклассу аминотрансфераз. Рис. 2.9. Реакция, катализируемая ферментом протеинкиназа, относящимся к классу трансфераз, подклассу фосфотрансфераз.
Рис. 2.9. Реакция, катализируемая ферментом протеинкиназа, относящимся к классу трансфераз, подклассу фосфотрансфераз. Рис. 2.10. Реакция гидролиза молекулы белка
Рис. 2.10. Реакция гидролиза молекулы белка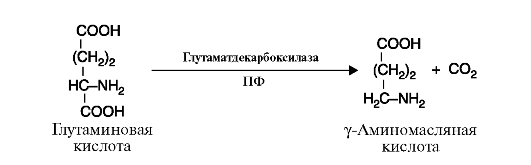 Рис. 2.11. Реакция декарбоксилирования (отщепления молекулы CO2)
Рис. 2.11. Реакция декарбоксилирования (отщепления молекулы CO2) Рис. 2.12. Реакция присоединения молекулы воды к фумарату
Рис. 2.12. Реакция присоединения молекулы воды к фумарату Рис. 2.13. Реакция, катализируемая ферментом фосфоглюкоизомераза
Рис. 2.13. Реакция, катализируемая ферментом фосфоглюкоизомераза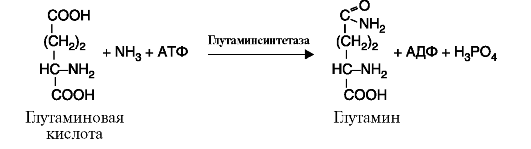 Рис. 2.14. Реакция, катализируемая ферментом глутаминсинтетазой
Рис. 2.14. Реакция, катализируемая ферментом глутаминсинтетазой


