
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Класифікації йонів на аналітичні групи (угрупування)
При проведенні систематичного аналізу студентам слід знати найбільш поширені схеми класифікацій катіонів та аніонів на групи (угрупування). Для проведення систематичного ходу аналізу іони поділяють на аналітичні групи. Цей поділ базується на відношенні окремих катіонів і аніонів до дії певних реагентів та на різній розчинності сполук цих іонів у воді, кислотах, лугах або інших розчинах. Аналітична група — це така група іонів, яка з певним реактивом дає подібні аналітичні реакції. Існує кілька класифікацій катіонів на аналітичні групи (сульфідна,кислотно-лужна і аміачно-фосфатна). Класичною вважається сульфідна (сірководнева) класифікація катіонів на групи. Вона логічна, тісно пов’язана з Періодичною системою елементів, базується на використанні властивостей різних сполук елементів – сульфідів, карбонатів, хлоридів, аміакатів, полісульфідів тощо. Нижче приводяться три найбільш поширені класифікації катіонів на групи – сульфідна (табл. 6). Фундаментом якісного аналізу аніонів є класифікація їх на групи, що базується на різній розчинності відповідних солей барію чи аргентуму (табл. 7). Таблиця 6 Сірководнева (сульфідна) класифікація катіонів на групи
Таблиця 7 Класифікація аніонів на групи
Обладнання, необхідне для проведення якісного аналізу.
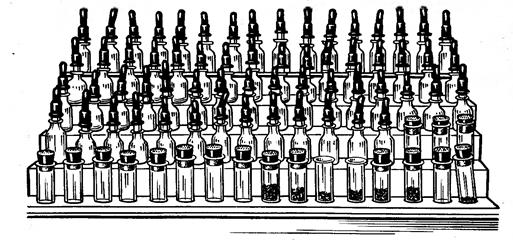
1.11.1. Реактивні склянки. Найзручніше користуватись невеликими склянками місткістю 20-50 мл, в яких зберігаються розчини всіх потрібних реагентів. Зручно такі склянки використовувати в комплекті з піпетками, поміщеними в щільну гумову пробку (рис.6). Таким чином вміст склянок досить надійно ізолюється від повітря, пилу, бруду тощо. Відбирати вміст склянки можна лише за допомогою піпетки. Не слід наливати розчин прямо зі склянки. Після відбору розчину піпеткою її треба повернути на місце, щоб не переплутати пробок із піпетками з різних склянок. Останнє може призвести до забруднення реактивів. Не слід також торкатися піпеткою стінок пробірки, предметного скла і т.п., так як при цьому також можливе забруднення.
Рис.6 Штатив з набором реактивів
Склянки з реактивами розміщуються у визначеному порядку в штативі для реактивів. Кожен штатив встановлюється на робочому столі і служить для індивідуальної роботи. Категорично забороняється виймати склянки з штатива, так як це може призвести до порушення порядку в їх, розміщенні. Склянки з недостатньо стійкими, отруйними, дурнопахнучими, сухими речовинами, а також концентровані кислоти та основи зберігаються у витяжній шафі і служать для загального користування.
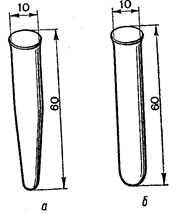
Пробірки. Для індивідуальної роботи студенту надається комплект пробірок – як звичайних, так і центрифужних (рис. 7), які зберігаються в штативі. Пробірки перед використанням ретельно миють, а тоді ополіскують дистильованою водою. В деяких випадках вимиті пробірки сушать. При дослідженні реакцій, що супроводжуються виділенням газів (CO2, SO2, H2S), отвір пробірки закривають пробкою з газовідвідною трубкою. Кінець останньої занурюють у розчин реагенту.
Рис. 7. Центрифужна (а) і звичайна (б) пробірки Стакани та тиглі. Випаровування розчинів зразків, висушування препаратів, їх розчинення зручно проводити в хімічних стаканах (рис. 8) чи фарфорових чашках (тиглях). Скляні стакани не можна нагрівати на відкритому вогні. Краще це робити на електричній плитці, попередньо поклавши на нагрівник шматок азбестової матерії. Прожарювання, плавлення зразків проводять лише у фарфорових тиглях у муфельних печах.
Рис. 8. Хімічний стакан
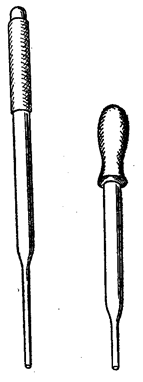
Піпетки. Піпетки (рис. 9) використовуються для відбору певної частини (аліквоти) розчинів досліджуваної речовини чи реагенту, інколи – для відділення розчину над осадом. Гумовою грушею заповнюють піпетку, попередньо занурену носиком у відповідний розчин. Невірне користування піпеткою може бути причиною багатьох неправильних висновків стосовно складу досліджуваної речовини. Тому слід пам'ятати й дотримуватись найпростіших правил: ü Піпетки перед використанням ретельно миють, а тоді промивають дистильованою водою. ü Після роботи не слід класти піпетку на стіл чи штатив, а негайно її вимити й помістити в чисту пробірку.
Рис. 9. Піпетки для якісного аналізу
Миття посуду. Хімічний посуд повинен бути чистим. Його миють йоржиками розчинами соди, лугу, миючими засобами. Полоскання здійснюють теплою, тоді холодною та дистильованою водою. Посуд вважається чистим, якщо з внутрішньої частини вода витікає, не залишаючи краплин. При наявності краплин посуд слід мити знову. Іноді для миття використовують хромову суміш, якою заливають посуд. Залишки хромової суміші добре промивають водою. При роботі з хромовою сумішшю слід бути дуже обережним. Висушують посуд у сушильній шафі.
1.12. Загальна характеристика п ершої аналітичної групи катіонів
До першої аналітичної групи відносять катіони К+, Na+, NH4+, Mg2+. Більшість солей цих катіонів добре розчинні у воді, тому перша аналітична група катіонів не має групового реагента. У водних розчинах всі катіони першої аналітичної групи безбарвні. Хімічні елементи, катіони яких входять до першої аналітичної групи, розміщені в ІА групі. При утворенні катіонів вони легко віддають по одному електрону, утворюючи електронну структуру інертного газу, наприклад: +11Na Is2 2s2 2p6 3s1 = [Ne] 3s1 Na - e- →Na+. Віддаючи електрони, атоми s1-елементів виявляють сильні відновні властивості, що підтверджується від'ємними значеннями окисно-відновних потенціалів у межах 3,0 - 2,7 В. Внаслідок втрати електронів атоми стають катіонами, які з переважною більшістю неметалів утворюють типові іонні сполуки, що добре розчиняються у воді. Катіони першої аналітичної групи характеризуються низькими значеннями відносних електронегативностей і малими іонними радіусами. З гідроксогрупою (ОН-) катіони К+ і Na+ утворюють сильні луги – їдкий натрій (NaОН) і їдкий калій (КОН). Гідроксид амонію (NH4ОН) – слабка основа з константою дисоціації 1,8 ∙ 10-5. Катіон амонію NH4+ також віднесено до першої аналітичної групи катіонів, оскільки він утворює добре розчинні у воді солі, як і йони лужних металів. Треба знати, що солі амонію, на відміну від солей К+ і Na+, розкладаються при нагріванні і, відповідно, можуть бути видалені з суміші прокалюванням розчину. Метал магній відноситься до другої групи періодичної системи, у всіх сполуках має ступінь окиснення +2 і відрізняється від інших катіонів першої аналітичної групи деякими властивостями. Так, гідроксид Mg(ОН)2, на відміну від NaОН, КОН і NH4ОН, погано розчинний у воді, і є досить слабкою основою. Іон Mg2+ є перехідним між катіонами першої і другої груп. Основний карбонат (MgОН)2СО3, як і карбонати катіонів другої групи, погано розчинний у воді, однак добре розчиняється в надлишку солей амонію і при дії карбонату амонію (NH4)2СО3 в присутності хлориду амонію NH4Cl не випадає в осад. Тому Mg2+ залишається в розчині разом з катіонами К+, Na+, NH4+.
Катіони першої аналітичної групи беруть участь в біохімічних і агрохімічних процесах. Вони можуть знаходитися у ґрунті, як в рухомому (доступному для засвоєння рослинами), так і у зв’язаному вигляді. У водній витяжці з ґрунту йони К+, Na+, NH4+, Mg2+ знаходяться у вигляді легкорозчинних солей (хлоридів, сульфатів, нітратів, карбонатів тощо). Для лужних ґрунтів характерний підвищений вміст солей натрію (Na2SO4, NaCl, NaHCO3). При цьому навіть незначний вміст у ґрунті гідрокарбонату натрію є дуже шкідливим для рослин і приводить до їх загибелі. Іони К+ і NH4+, на противагу катіону Na+, необхідні для мінерального живлення рослин. Магній міститься в зеленому пігменті рослин – хлорофілі. Тому незначний вміст солей Mg2+ у ґрунті сприяє нормальному розвитку рослин. Катіони І-ої аналітичної групи входять до складу важливих мінеральних добрив. Калій вносять у ґрунт у вигляді калійної селітри, сульфату, хлориду й інших солей. Йон NH4+ міститься в амонійній селітрі, сульфаті і хлориді амонію, в амофосі NH4H2PO4 і диамофосі (NH4)2НРО4. Натрій – складова частина чилійської селітри (NaNО3). Магній входить до складу доломіту СаСО3∙МgСО3, який використовують як вапняне і магнезіальне добриво. Крім того, сполуки натрію і калію (хлориди, фосфати, гідрокарбонати, складні органічні речовини) є складовими частинами тканин та фізіологічних розчинів тварин. 0,9%-ний розчин NaCl (фізіологічний розчин) використовують при втратах крові та біологічних дослідженнях. Гідрокарбонат натрію й оксид магнію служать для нейтралізації надлишкової кислотності шлункового соку. Броміди калію і натрію використовуються для заспокоювання нервової системи. Відомо, що солі амонію утворюються при загниванні білків, а тому наявність їх у природних водах свідчить про забруднення.
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 117; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.125.171 (0.016 с.) |

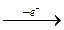 [Ne] 3s°,
[Ne] 3s°,


