
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Техніка виконання аналітичних реакцій виявлення.Стр 1 из 9Следующая ⇒
Рекомендовано до друку Методичною радою ЛНАУ Протокол № ___ від ___________2010 р.
Укладач к.х.н. Я.С. Грицик, к.т.н. О.Т. Мазурак, к.х.н. Шкумбатюк Р.С., к.х.н. Уйгелій Г.Ю.
Рецензенти: д.т.н. С.В. Мякота
Редактор
Коректор
© Львівський національний аграрний університет, 2010 ЗМІСТ
ТЕОРЕТИЧНА ЧАСТИНА Предмет аналітичної хімії
Аналітична хімія – це наука про методи якісного і кількісного дослідження речовин. Аналітична хімія складається з двох розділів: перший розділ – якісний аналіз, суть якого полягає у виявленні елементів (чи іонів) з яких складається досліджувана речовина; другий розділ – кількісний аналіз, суть якого полягає у визначенні кількісного складу речовини. Використовуючи методи кількісного аналізу, можна визначити, наприклад, кількісні співвідношення між елементами в молекулах, процентний вміст якогось компоненту в речовині, вміст мікроелементів в ґрунті, зробити аналіз сільськогосподарських ядів (отрутохімікатів), кормів, щоб правильно скласти раціони тварин, визначити кількісний вміст діючої речовини у добриві тощо.
Методи якісного аналізу
Треба пам’ятати, що якісний аналіз завжди передує кількісному. В цих методичних рекомендаціях вивчатиметься лише якісний аналіз, причому будемо розглядати тільки методи аналізу неорганічних речовин, оскільки аналіз органічних сполук вивчає органічна хімія. В аналітичній хімії використовуються різні методи якісного і кількісного дослідження речовин. Їх поділяють на: а) хімічні; б) фізичні; в) фізико-хімічні. Хімічні методи аналізу базуються на хімічній взаємодії досліджуваного йона чи речовини реагентом, в результаті чого утворюється сполука, що має певні хімічні властивості чи зовнішні ознаки (наприклад, колір), по яких судять про наявність у розчині досліджуваного йона. Наприклад, йон Fe3+ у розчині легко виявити з допомогою роданіду калію (чи амонію). Утворюється роданід феруму (ІІІ) Fe(SCN)3 червоно-кров’янистого кольору: Fe3+ + 3 KSCN → Fe(SCN)3↓ + 3K+, а з комплексною сполукою К4[Fe(CN)6] йон Fe3+ утворює осад синього кольору Fe4[Fe(CN)6]3: 4Fe 3+ + 3K4[Fe (CN)6] → Fe4[Fe(CN)6]3↓ + 12K+ Фізичні методи дослідження ґрунтуються на певній залежності між хімічним складом і фізичними властивостями речовин. Серед фізичних методів дослідження важливе значення мають оптичні методи, які поділяються на: а) спектральний; б) люмінесцентний; в) рефрактометричний. Спектральний аналіз характеризується високою чутливістю, це швидкий метод аналізу.
Про наявність того чи іншого елемента судять по характерних для нього лініях спектру, а кількісне визначення проводять за інтенсивністю цих ліній. Спектральним методом можна виявити дуже незначні кількості речовини (10-6 - 10-8 г). Люмінесцентний аналіз полягає у спостереженні явища люмінесценсії (випромінювання світла) досліджуваними речовинами, яке викликається дією на речовину ультрафіолетових променів. Атоми речовини, поглинувши певну кількість енергії, переходять у збуджений стан. Такий стан характеризується значно вищим запасом енергії, ніж нормальний. При переході атомів із збудженого стану до нормального спостерігається люмінесценсія за рахунок надлишкової енергії. Спостерігаючи характер люмінесцентного світіння і вимірюючи його інтенсивність, можна судити про склад досліджуваної речовини. Рефрактометричний аналіз базується на залежності між концентрацією розчиненої речовини, її молекулярною будовою і показником заломлення. За показником заломлення можна встановити хімічну природу речовини, її концентрацію або ступінь чистоти. Фізико – хімічні методи ґрунтуються на дослідження будь-якої фізичної властивості досліджуваної речовини, яка змінюється в результаті хімічної реакції. Найважливішим методом є хроматографічний. Цей метод дозволяє розділити суміші речовин на окремі компоненти і зробити якісний і кількісний аналіз цих компонентів. Методи аналізу в залежності від кількості досліджуваної речовини, об’єму розчину й техніки виконання класифікують наступним чином (табл. 1): Крім того, речовини, що входять до складу аналізованого зразку, в залежності від їх вмісту, ділять на макро-(> 0,01%) та мікро-(< 0,01%) компоненти.
Таблиця 1 Класифікація методів аналізу
Для проведення аналізу макрометодом беруть порівняно великі кількості речовини, наприклад 1 - 10 г сухої речовини або 10-100 мл розчину. При цьому реакції виконуються в звичайних пробірках, осади відокремлюють від розчину фільтруванням і промивають їх на паперових фільтрах. При аналізі сухої речовиничи розчину мікрометодом беруть у 100-1000 разів менше, ніж при макроаналізі (біля 1 мг сухої речовини або 0,1 мл розчину). Реакції при цьому виконуються мікрокристалокопічним або крапельним способом.
Реакції з виділенням газу. Такі реакції проводять у пробірці або газовій камері. 1.4.1. У пробірку вносять невеликий об’єм (до 1 мл) розчину досліджуваної речовини піпеткою, не торкаючись при цьому стінок пробірки. Тоді добавляють рівний об’єм розчину реагенту і спостерігають аналітичний ефект (виділення газу). Ідентифікацію газу проводять за його фізичними (колір, запах) чи хімічними властивостями. В останньому випадку пробірку закривають пробкою з газовідвідною трубкою, кінець якої занурюють у пробірку з розчином відповідного реагенту. В деяких випадках наносять розчин реагенту на фільтрувальний папір, який підносять до отвору пробірки.
2.4.2. Іноді зручніше такі реакції проводити в газовій камері. Складають газову камеру з двох однакових скляних посудин (чашки Петрі, годинникові скла). На внутрішню частину одної посудини ставлять папірці, змочені розчином реагенту (або індикаторні папірці). На нижню частину другої посудини вносять розчини досліджуваної речовини та реагенту. Складають камеру і спостерігають аналітичний ефект на фільтрувальному (чи індикаторному) папері.
Екстракційна реакція. Такі реакції найзручніше проводити в пробірці з пришліфованою пробкою чи ділильній лійці (рис. 4). Для цього вносять невеликий об’єм розчину досліджуваної речовини піпеткою і, при необхідності, створюють кисле чи лужне середовище. Тоді добавляють близький об’єм розчину реагенту й суміш перемішують. Після цього доливають органічного розчинника (екстрагента), закривають посудину пробкою і струшують. Фіксують зміну кольору однієї з фаз. При необхідності фази розділяють у ділильній лійці.
Метод забарвлення полум’я. Платинову чи ніхромову дротинку (рис. 5) з спіраллю опускають в концентровану хлоридну кислоту і прокалюють в полум’ї пальника. Тоді на петлю розпаленої дротинки поміщають порошок аналізованої речовини і вносять її у мало забарвлене (аналітичне) полум’я пальника (спиртівки). Фіксують зміну забарвлення полум’я, по чому судять про присутність (відсутність) визначуваного компоненту в досліджуваній речовині.
Рис. 4. Ділильна лійка
Рис. 5. Дротина для дослідження речовин методом забарвлення полум’я
Приклади визначення деяких речовин таким методом приводяться в таблиці 3. Таблиця 3 Виявлення речовин за їх здатністю забарвлювати полум’я
Метод забарвлення перлів. Платинову чи ніхромову дротинку із спіраллю опускають в розчин концентрованої хлоридної кислоти і прокалюють у полум’ї пальника. Тоді на петлю розпаленої дротинки поміщають небагато сухої бури (можна гідрофосфату натрію-амонію) і визначуваної речовини і нагрівають у полум’ї пальника (спиртівки) до розплавлення й утворення склоподібної маси (перла). Фіксують колір перла й роблять висновок про присутність (відсутність) визначуваного компоненту в досліджуваній речовині.
Колір перлів сполук деяких елементів приводиться в табл. 4.
Таблиця 4 Колір перлів сполук деяких елементів.
Таблиця 6 Сірководнева (сульфідна) класифікація катіонів на групи
Таблиця 7 Класифікація аніонів на групи
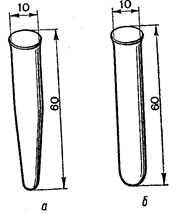
Пробірки. Для індивідуальної роботи студенту надається комплект пробірок – як звичайних, так і центрифужних (рис. 7), які зберігаються в штативі. Пробірки перед використанням ретельно миють, а тоді ополіскують дистильованою водою. В деяких випадках вимиті пробірки сушать. При дослідженні реакцій, що супроводжуються виділенням газів (CO2, SO2, H2S), отвір пробірки закривають пробкою з газовідвідною трубкою. Кінець останньої занурюють у розчин реагенту.
Рис. 7. Центрифужна (а) і звичайна (б) пробірки Стакани та тиглі. Випаровування розчинів зразків, висушування препаратів, їх розчинення зручно проводити в хімічних стаканах (рис. 8) чи фарфорових чашках (тиглях). Скляні стакани не можна нагрівати на відкритому вогні. Краще це робити на електричній плитці, попередньо поклавши на нагрівник шматок азбестової матерії. Прожарювання, плавлення зразків проводять лише у фарфорових тиглях у муфельних печах.
Рис. 8. Хімічний стакан
Піпетки. Піпетки (рис. 9) використовуються для відбору певної частини (аліквоти) розчинів досліджуваної речовини чи реагенту, інколи – для відділення розчину над осадом. Гумовою грушею заповнюють піпетку, попередньо занурену носиком у відповідний розчин. Невірне користування піпеткою може бути причиною багатьох неправильних висновків стосовно складу досліджуваної речовини. Тому слід пам'ятати й дотримуватись найпростіших правил:
ü Піпетки перед використанням ретельно миють, а тоді промивають дистильованою водою. ü Після роботи не слід класти піпетку на стіл чи штатив, а негайно її вимити й помістити в чисту пробірку.
Рис. 9. Піпетки для якісного аналізу
Миття посуду. Хімічний посуд повинен бути чистим. Його миють йоржиками розчинами соди, лугу, миючими засобами. Полоскання здійснюють теплою, тоді холодною та дистильованою водою. Посуд вважається чистим, якщо з внутрішньої частини вода витікає, не залишаючи краплин. При наявності краплин посуд слід мити знову. Іноді для миття використовують хромову суміш, якою заливають посуд. Залишки хромової суміші добре промивають водою. При роботі з хромовою сумішшю слід бути дуже обережним. Висушують посуд у сушильній шафі.
1.12. Загальна характеристика п ершої аналітичної групи катіонів
До першої аналітичної групи відносять катіони К+, Na+, NH4+, Mg2+. Більшість солей цих катіонів добре розчинні у воді, тому перша аналітична група катіонів не має групового реагента. У водних розчинах всі катіони першої аналітичної групи безбарвні. Хімічні елементи, катіони яких входять до першої аналітичної групи, розміщені в ІА групі. При утворенні катіонів вони легко віддають по одному електрону, утворюючи електронну структуру інертного газу, наприклад: +11Na Is2 2s2 2p6 3s1 = [Ne] 3s1 Na - e- →Na+. Віддаючи електрони, атоми s1-елементів виявляють сильні відновні властивості, що підтверджується від'ємними значеннями окисно-відновних потенціалів у межах 3,0 - 2,7 В. Внаслідок втрати електронів атоми стають катіонами, які з переважною більшістю неметалів утворюють типові іонні сполуки, що добре розчиняються у воді. Катіони першої аналітичної групи характеризуються низькими значеннями відносних електронегативностей і малими іонними радіусами. З гідроксогрупою (ОН-) катіони К+ і Na+ утворюють сильні луги – їдкий натрій (NaОН) і їдкий калій (КОН). Гідроксид амонію (NH4ОН) – слабка основа з константою дисоціації 1,8 ∙ 10-5. Катіон амонію NH4+ також віднесено до першої аналітичної групи катіонів, оскільки він утворює добре розчинні у воді солі, як і йони лужних металів. Треба знати, що солі амонію, на відміну від солей К+ і Na+, розкладаються при нагріванні і, відповідно, можуть бути видалені з суміші прокалюванням розчину. Метал магній відноситься до другої групи періодичної системи, у всіх сполуках має ступінь окиснення +2 і відрізняється від інших катіонів першої аналітичної групи деякими властивостями. Так, гідроксид Mg(ОН)2, на відміну від NaОН, КОН і NH4ОН, погано розчинний у воді, і є досить слабкою основою. Іон Mg2+ є перехідним між катіонами першої і другої груп. Основний карбонат (MgОН)2СО3, як і карбонати катіонів другої групи, погано розчинний у воді, однак добре розчиняється в надлишку солей амонію і при дії карбонату амонію (NH4)2СО3 в присутності хлориду амонію NH4Cl не випадає в осад. Тому Mg2+ залишається в розчині разом з катіонами К+, Na+, NH4+. Катіони першої аналітичної групи беруть участь в біохімічних і агрохімічних процесах. Вони можуть знаходитися у ґрунті, як в рухомому (доступному для засвоєння рослинами), так і у зв’язаному вигляді. У водній витяжці з ґрунту йони К+, Na+, NH4+, Mg2+ знаходяться у вигляді легкорозчинних солей (хлоридів, сульфатів, нітратів, карбонатів тощо). Для лужних ґрунтів характерний підвищений вміст солей натрію (Na2SO4, NaCl, NaHCO3). При цьому навіть незначний вміст у ґрунті гідрокарбонату натрію є дуже шкідливим для рослин і приводить до їх загибелі. Іони К+ і NH4+, на противагу катіону Na+, необхідні для мінерального живлення рослин. Магній міститься в зеленому пігменті рослин – хлорофілі. Тому незначний вміст солей Mg2+ у ґрунті сприяє нормальному розвитку рослин. Катіони І-ої аналітичної групи входять до складу важливих мінеральних добрив. Калій вносять у ґрунт у вигляді калійної селітри, сульфату, хлориду й інших солей. Йон NH4+ міститься в амонійній селітрі, сульфаті і хлориді амонію, в амофосі NH4H2PO4 і диамофосі (NH4)2НРО4. Натрій – складова частина чилійської селітри (NaNО3). Магній входить до складу доломіту СаСО3∙МgСО3, який використовують як вапняне і магнезіальне добриво. Крім того, сполуки натрію і калію (хлориди, фосфати, гідрокарбонати, складні органічні речовини) є складовими частинами тканин та фізіологічних розчинів тварин. 0,9%-ний розчин NaCl (фізіологічний розчин) використовують при втратах крові та біологічних дослідженнях. Гідрокарбонат натрію й оксид магнію служать для нейтралізації надлишкової кислотності шлункового соку. Броміди калію і натрію використовуються для заспокоювання нервової системи. Відомо, що солі амонію утворюються при загниванні білків, а тому наявність їх у природних водах свідчить про забруднення. ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА ЯКІСНІ РЕАКЦІЇ НА КАТІОНИ 2.1. Якісні реакції катіонів I аналітичної групи (Na +, K +, NH 4 +, Mg 2+) Реакції виявлення йона N a + Дослід 1. Реакція з калій гексагідроксостибіатом (V) К [ Sb (ОН)6 ]. Калій гексагідроксостибіат (V) у нейтральному середовищі утворює з іонами Натрію білий кристалічний осад натрій гексагідроксостибіату(V) за рівнянням NaCl + К[Sb(ОН)6] = Na[Sb(OH)6]↓ + KC1 Na+ + [Sb(OH)6]- = Na[Sb(OH)6]↓ Для безпомилкового виявлення іона Na+ необхідно дотримуватися таких умов: реакцію треба виконувати лише в нейтральному середовищі(pH=7), бо у кислому середовищі реагент K[Sb(OH)6] утворює ортосурмяну кислоту за реакцією: K[Sb(OH)6] + HCl = H3SbO4 + KCl + 2H2O, яка розкладається і утворюється аморфний осад метасурмяної кислоти: H3SbO4 → HSbO3↓ + H2O. Такий осад не свідчить про наявність у розчині катіона Na+. У сильнолужному середовищі осад Na[Sb(OH)6] розчиняється з утворенням середньої солі Na3SbO4: Na[Sb(OH)6] + 2NaOH = Na3SbO4 + 4H2O. Отже, якщо досліджуваний розчин кислий, його нейтралізують KOH (або K2CO3), якщо ж лужний – слабкою кислотою (ацетатною). Виконання досліду. До 2-3 крапель розчину солі Na+ додають рівний об’єм реактива K[Sb(OH)6] і потирають скляною паличкою внутрішню поверхню стінок пробірки, щоб попередити утворення пересиченого розчину Na[Sb(OH)6] і прискорити випадання осаду. Оскільки розчинність осаду Na[Sb(OH)6] при нагріванні сильно зростає, то реакцію виконують на холоді (15-20 оC). Іноді охолоджують пробірку з розчином проточною водою з крана. Дослід 2. Реакція з цинк-ураніл ацетатом Zn (U 02)3(CH 3 COO)8. Цинк-ураніл ацетат у розчині ацетатної кислоти утворює з іонами натрію жовтий кристалічний осад за рівнянням Na+ + Zn (UО2)3 (CH3COO)8 + СН3СОО-+ 9Н2О = = NaZn(UО2)3(CH3COO)9 ∙ 9H2O↓ Реакція є специфічною і досить чутливою (0,01 мкг), аналогічну реакцію дають іони Li+. Запишіть повне іонне рівняння реакції. Виконання досліду. Беруть 2 - 3 краплі розчину солі натрію, підкислених оцтовою кислотою, добавляють 4 - 5 крапель розчину реактиву і потирають об стінки пробірки скляною паличкою при охолодженні розчину в струмені води. Випадання кристалічного зеленувато-жовтого осаду свідчить про наявність йонів Натрію. Дослід 3. Проба на забарвлення полум'я. Солі натрію забарвлюють полум'я газового пальника у жовтий колір. Проба на забарвлення полум'я характеризується високою чутливістю. Виконання досліду. Дослід виконують, вносячи крупинки сухої солі Натрію на платиновій дротинці в полум'я пальника, і спостерігають появу інтенсивного яскраво-жовтого забарвлення, яке має зберігатися впродовж декількох секунд. Реакції виявлення йона К+ Дослід 4. Реакція з натрій гексанітрокобальтатом (ІІІ). Комплексна сполука Na3[Co(NО2)6], яку називають натрій гексанітрокобальтатом (Ш), або кобальтинітритом, у нейтральному середовищі утворює з іонами Калію жовтий кристалічний осад калій-натрій кобальтинітриту: 2 KCI + Na3[Co (NO2)6] = K2Na[Co(NО2)6]↓ + 2NaCl 2 К+ + Na+ + [Co(NО2)6]3- = K2Na[Co(NО2)6] ↓ Реактив Na3[Co(NO2)6] повинен бути свіжоприготовленим, оскільки при зберіганні він розкладається з виділенням іонів Co2+ рожевого забарвлення і такий розчин непридатний для використання. Виконання досліду. До 2-3 крапель розчину солі K+ додайте 3 краплі реактива Na3[Co(NO2)6] і потріть скляною паличкою внутрішню стінку пробірки. Випадає жовтий кристалічний осад K2Na[CO(NO2)6]. Досліджуваний розчин повинен мати pH не більше 7, бо в лужному середовищі реактив Na3[Co(NO2)6] легко розкладається з утворенням темно-бурого аморфного осаду Co(OH)3: Na3[Co(NO2)6] + 3NaOH = Co(OH)3↓ + 6NaNO2, а в сильнокислому утворюєтсья нестійка кислота H3[Co(NO2)6]: 2Na3[Co(NO2)6] + 6HCl = 2H3[Co(NO2)6] + 6NaCl, яка в момент утворення розкладається з виділенням оксидів нітрогену: 2H3[Co(NO2)6] + 4HCl = 2CoCl2 + 5NO↑ + 7NО2↑ + 5H2O. В ацетатній кислоті ані реактив, ані утворений осад не розчиняються. Потирання скляною паличкою стінок пробірки попереджує утворення пересиченого розчину і прискорює випадання осаду. Дослід 5. Реакція з натрій гідрогентартратом NaHC 4 H 4 О6. Натрій гідрогентартрат NaHC4H4О6 утворює з іонами Калію білий кристалічний осад калій гідрогентартрату: КСl + NaHC4H4O6 = КНС4Н4О6↓ + NaCl K++HC4H4O6- = KHC4H4O6↓ Виконання досліду. У пробірку вносять 4-5 крапель розчину солі Калію і стільки ж розчину реактиву. Розчин охолоджують і потирають об внутрішні стінки пробірки скляною паличкою для прискорення утворення осаду. Середовище має бути нейтральним або слабкокислотним. Чутливість реакції — 50 мкг, граничне розбавляння 1:1000. Катіони NH4+ перешкоджають визначенню, тому їх усувають прожарюванням проби. Дослід 6. Проба на забарвлення полум'я. Солі Калію при внесенні в полум 'я газового пальника забарвлюють його у фіолетовий колір. Виконання досліду. На кінчику платинової дротинки вносять краплю солі Калію в полум'я газового пальника і спостерігають за забарвленням полум'я. Навіть сліди сполук Натрію маскують фіолетове забарвлення йонів Калію. Тому його забарвлення потрібно спостерігати крізь синє кобальтове скло, яке затримує жовті промені Натрію.
Реакції катіонів амонію NH 4 +
Дослід 7. Реакція з гідроксидами лужних металів. Сильні основи NаОН, КОН при нагріванні виділяють із розчинів солей амонію газуватий амоніак, який можна виявити за характерним запахом або за допомогою кислотно-основних індикаторів: NH4+ + ОН- = NH3↑ + Н2O Реакція з лугами дуже чутлива ( 0,01мкг) і дає змогу виявити іони амонію за наявності всіх інших катіонів. Виконання досліду. У пробірку вносять кілька крапель розчину солі амонію і добавляють 3 - 4 краплі 2Мрозчину лугу. До отвору пробірки підносять змочений водою червоний лакмусовий папірець і нагрівають пробірку. Спостерігають посиніння лакмусового папірця, оскільки амоніак, що виділяється, сполучаючись з водою, утворює амоній гідроксид, який забарвлює лакмусовий папірець у синій колір Дослід 8. Реакція з реактивом Несслера. Реактив Несслера — це суміш комплексної солі K2[HgI4] з КОН. Він утворює з солями амонію червоно-бурий осад йодиду дийододимеркуріату [Hg2I2NH2]І: NH4C1+ 2 К2 [HgI4] + 2 КОН = [Hg2I2NH2]І(т) + + 5КІ + КС1 + 2Н2O. NH4+ + 2 [HgI4]2- + 2ОН- = [Hg2I2NH2]І↓ + 5I- + 2Н2O. З надлишком лугу утворюється йодид оксодимеркурамонiю, структуру якого можна зобразити так: NH3 + 2K2[HgI4] + KOH = [NH2HgI2]I↓+ 5KI + H2O Реакція характеризується високою чутливістю (0,25 мкг), тому її використовують для перевірки повноти виділення амоніаку з реакційної суміші, в біохімічному аналізі — для визначення залишкового Нітрогену в крові, а в екологічних дослідженнях — для аналізу стічних вод, харчових продуктів тощо. Виконання досліду. До 1 - 2 крапель розчину амонійної солі добавляють 4 краплі реактиву Несслера і спостерігають утворення бурого осаду. За незначного вмісту солей амонію в пробі (сліди) з'являється жовте забарвлення. Дослід 9. Термічний розклад солей амонію. Якщо солі амонію в розчині видалити, їх потрібно відокремити, оскільки катіон NH4+ заважає виявленню йонів К+, утворюючи осади з Na3[Co(NО2)6], NaHC4H4О6 і Na2Pb[Cu(NО2)6]. Крім цього, солі амонію, гідролізуючи, утворюють мінеральні кислоти, що розкладають K[Sb(OH)6] з виділенням осаду метасурмяної кислоти HSbО3. Йони NH4+ заважають також виявленню йонів Na+ дією з гексагідроксостибіатом калію. Для видалення катіона NH4+ використовують властивість солей амонію при високих температурах легко розкладатися та випаровуватися, утворюючи газоподібні продукти, наприклад: NH4C1 (NH4)2CO3 (NH4)3PО4 NH4NО3 Виконання досліду. Досліджуваний розчин переливають у фарфорову чашку, обережно випарюють до сухого вигляду і прожарюють на піщаній бані до повного видалення солей амонію. Для перевірки повноти видалення цих солей беруть кілька кристалів сухого залишку, переносять у пробірку, добавляють кілька крапель води і 1 - 2 краплі реактиву Несслера. Утворення бурого осаду свідчить про неповне видалення катіона NH4+, тому продовжують прожарювати. Реакції виявлення йона Mg 2+ Для вивчення реакцій Mg2+ беруть розчин хлориду MgCl2 або сульфату магнію MgSO4. Реакції Mg2+ сильно відрізняються від реакцій інших катіонів 1- ї групи. Винятком є реакція з гексагідроксостибіатом калію, при якій йон Mg2+ утворює осад Mg[Sb(OH)6]2, що зовні не відрізняється від Na[Sb(OH)6] отже, Mg2+ заважає виявленню Na+.
Дослід 10. Реакція з л угами NaOH або КОН. Луги NaOH і КОН виділяють із розчинів солей Mg2+ білий аморфний осад гідроксиду: MgCl2 + 2КОН = Mg(ОН)2↓ + 2КС1 Mg2+ +2ОН- = Mg(ОН)2↓ У ході аналізу цю реакцію використовують для відділення Mg2+ від інших катіонів І-ої групи, гідрооксиди яких добре розчинні у воді. Водний аміак осаджує іони Mg2+ не повністю. У присутності ж солей NH4+ дисоціація NH4OH настільки пригнічується, що осад гідрооксиду магнію Mg(OH)2 не випадає (через недостачу іонів ОН- у розчині). Виконання досліду. До 2-3 крапель розчину солі Mg2+ додають стільки ж розчину їдкого калію КОН; зверніть увагу на аморфний характер осаду Mg(OH)2. В іншій пробірці до 2 крапель розчину солі Mg2+ долийте спочатку 2 краплі насиченого розчину хлориду амонію NH4C1, a потім 2 краплі розчину аміаку. Переконайтеся, що осад не випадає. Очевидно, що гідроксид магнію розчиняється не тільки в кислотах, але також і в солях амонію. Підтвердіть це рівняннями відповідних реакцій. Дослід 11. Реакція з гідрофосфатом натрію Na2HPО4. Гідрофосфат натрію Na2HPО4 у присутності гідроксиду й хлориду амонію утворює із солями Mg2+ білий кристалічний осад фосфату магнію-амонію: MgCl2 + Na2HPО4 + NH4OH = MgNH4PО4 ↓ +2NaCl + H2О Хлорид амонію додають, щоб запобігти утворенню осаду Mg(OH)2, внаслідок взаємодії MgCl2 з NH4OH. Фосфат амонію розчинний у мінеральних кислотах і навіть в оцтовій кислоті, тому реакцію виконують у нейтральному або слаболужному розчині. Виконання досліду. До 2 - 3 крапель розчину солі Mg2+ додають 2 краплі розчину, хлориду амонію й 4 краплі реактиву Na2HPО4. Потім додають 2 н. NH4OH до лужної реакції (проба з лакмусовим папірцем), або до появи запаху аміаку). Розчин перемішують скляною паличкою після додавання кожної краплі реактиву. З розведених розчинів осад випадає не відразу: появу його можна прискорити збовтуванням або потиранням паличкою об стінки пробірки. Іноді дають розчину постояти 15 - 20 хв. Реакція з гідрофосфатом натрію досить чутлива й найчастіше використовується для виявлення Mg2+ у ході систематичного аналізу. Катіони інших аналітичних груп (крім 1-й групи) заважають виявленню Mg2+, оскільки теж утворюють із гідрофосфатом натрію нерозчинні фосфати, тому їх необхідно видалити. Дослід 12. Реакція з розчинними карбонатами (Na 2 C О3 або К2СО3). Розчинні карбонати Na2CО3 і К2СО3 виділяють із розчинів солей Mg2+ білий аморфний осад основного карбонату: 2MgCl2 + 2Na2CO3 + Н2О = (MgOH)2СО3↓ + 4NaCl + СО2 ↑ 2Mg2+ + 2СО32- + Н2О = (MgOH)2 CО3 ↓ + CО2 ↑ Виконання досліду. До 2-3 крапель розчину солі Mg2+ додають однаковий об’єм розчину карбонату натрію Na2CО3. Переконайтеся, що осад (MgOH)2CО3 розчиняється в кислотах. Карбонат амонію також частково осаджує іони Mg2+ у вигляді основної солі: 2MgCl2 + 2(NH4)2CO3 + H2O →← (MgOH)2CO3 ↓ + 4NH4Cl + CO2↑ Однак ця реакція оборотна, і рівновага її сильно зміщена вліво. Якщо ж до розчину попередньо додати небагато хлориду амонію, то осад гiдроксокарбонату магнію (MgOH)2CО3 не утвориться. Переконайтес, що осад основного карбонату магнію розчинний у солях амонію. Розчинність (MgOH)2CО3 у надлишку солей амонію використовують для відділення Mg2+ від катіонів 2-й групи, що осаджуються карбонатом амонію. Іон Mg2+, що залишається при цьому в розчині, відносять до 1-й аналітичної групи. Дослід 13. Реакція з хромогеном чорним (еріохромом чорним Т). Органічний барвник хромоген чорний спеціальний ЕТ-00, що має склад C20H13O7N3S, утворює з іонами Mg2+ комплекс винно-червоного кольору. Виконання досліду. До 4-5 крапель розчину сол
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 94; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.234.83 (0.154 с.) |



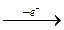 [Ne] 3s°,
[Ne] 3s°,
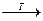 NH3 + HCl
NH3 + HCl


