Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Серотонин и его функции и метаболизмСодержание книги
Поиск на нашем сайте
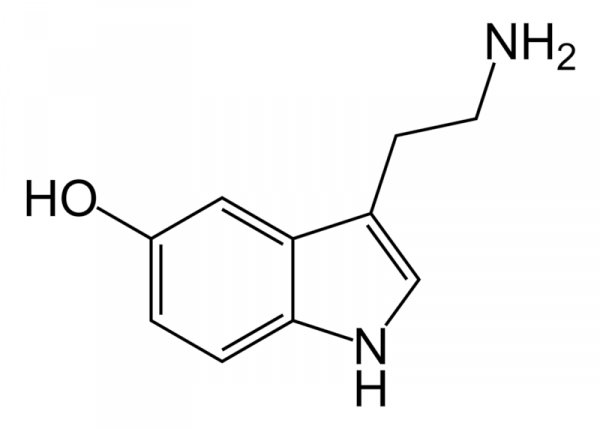
Рисунок 7. Молекулярная стуктура серотонина. Серотонин (5-Ht) является важным нейротрансмиттером, обнаруженным в нейронах, которые распространяются в различные области центральной нервной системы, он является одним из самых универсальных биолигандов-биорегуляторов широкого спектра действия, осуществляющих хеморегуляцию деятельности клеток организма на разных уровнях и в разных тканях. Функция этого медиатора в последние десятилетия полностью исследована. Более 95% 5-H t (серотонина) в организме синтезируется в энтерохромаффинных клетках кишечника, а оставшаяся часть синтезируется в ядрах шва головного мозга, нейроэндотелиальных клетках, выстилающих легкое, и в кровяных тельцах (тромбоцитах) (Cooper et al., 2003) Незаменимая аминокислота триптофан является предшественником 5-HT (серотонина). Поступая с пищей, более 95 % триптофана метаболизируется в печени по киноурениновому пути, становясь недоступным для синтеза серотонина, на который расходуется не более 1 % триптофана. Фермент, опосредующий превращение триптофана в N-формилкиноуренин – триптофан-2,3-диоксигеназа (TDO), является скорость лимитирующим этапом киноуренинового пути (Myint, 2012). Изменения активности данного фермента существенно влияют на концентрацию триптофана в крови и его доступность для синтеза серотонина. Синтез серотонина зависит от конкретного действия и лимитирующей стадии фермента триптофангидроксилазы, который передает гидроксильную группу бензильному кольцу триптофана (рис 8.). Последующее декарбоксилирование декарбоксилазами аминокислот приводит к образованию 5-Ht.
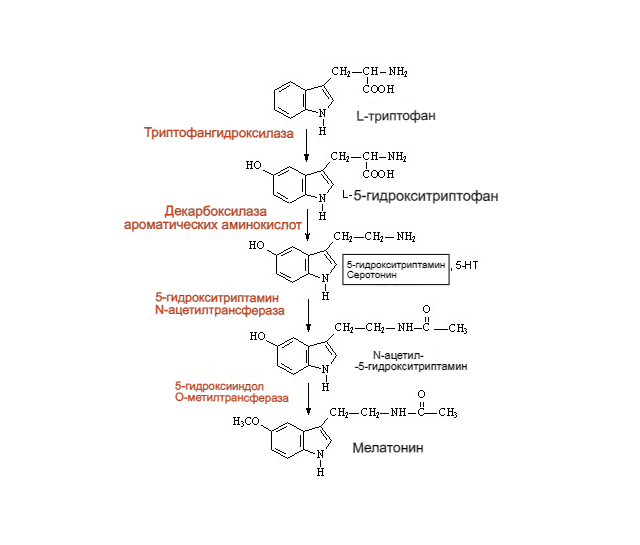
Рисунок 8. Схема образования серотонина. Изначально триптофан под действием фермента триптофангидроксилазы получает ОН-группу по 5-положению в основном индольном фрагменте, превращаясь в 5-гидрокситриптофан (5- Htp в англоязычных источниках). Затем 5-Нтр путём отщепления –СООН группы декарбоксилазой ароматических аминокислот превращается в собственно серотонин. Дальнейший метаболизм серотонина разветвлён и зависит от «ферментного набора» ткани и органа, где соответственно протекает (Squires et al., 2010). Однако, наибольшую значимость имеет путь, ведущий к мелатонину. Фермент N-ацетилтрансфераза превращает серотонин в N-ацетилсеротонин, а затем 5-гидроксииндол-О-метилтрансфераза превращает ОН-группу в CH3O-, осуществляя таким образом финальную стадию синтеза мелатонина (N-ацетил-5-гидрокситриптамина).
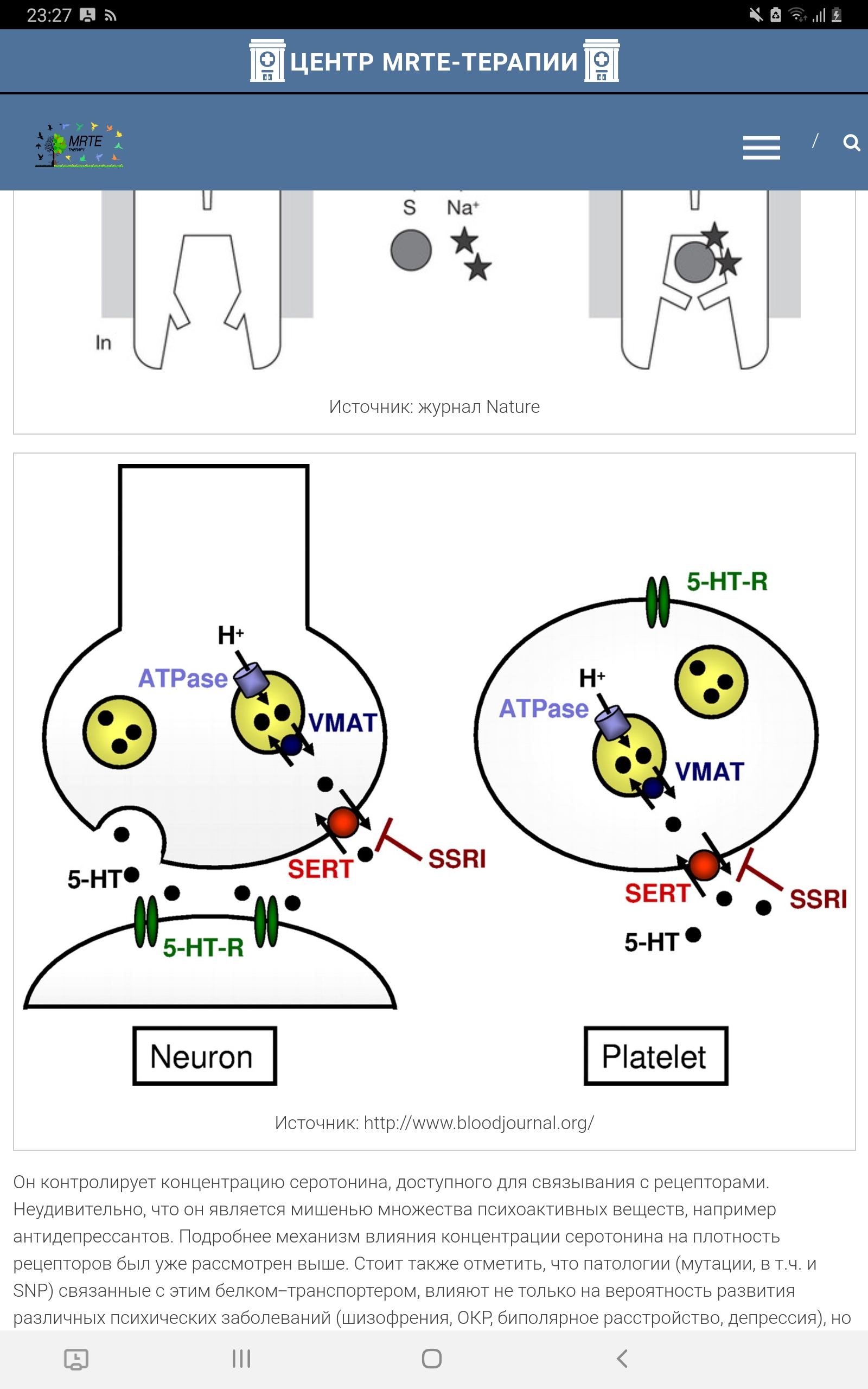
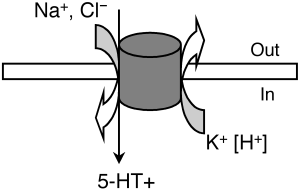
Транспортёр серотонина Особое значение имеет инактивация высвобожденного 5-Нt, где ведущая роль принадлежит транспортеру обратного захвата серотонина – 5-Htt. Транспортёр серотонина - это внутриклеточный белок, являющийся продуктом гена Slc6a4. Он относится к семейству белков-транспортёров моноаминов. Его физиологической функцией является обратный захват и транспорт серотонина из синаптической щели обратно в выделивший его пресинаптический нейрон. Локализованный на пресинаптической мембране серотонинергических нейронов, он выступает регулятором серотонинергической нейропередачи во всем организме, и механизм его действия заключается в поглощении нейротрансмиттера в синапсе (Копытов с соавт., 2012). Интересно, что многие представляют себе этот белок в качестве свободно находящегося в цитоплазме фермента (вроде моноаминоксидазы), который «цепляет» молекулы серотонина и закачивает их обратно. Такое представление в корне неверно: этот белок заякорен на клеточной мембране. Этот белок является Na/Cl-зависимым транспортёром, переносящим серотонин вместе с ионами натрия внутрь клетки.
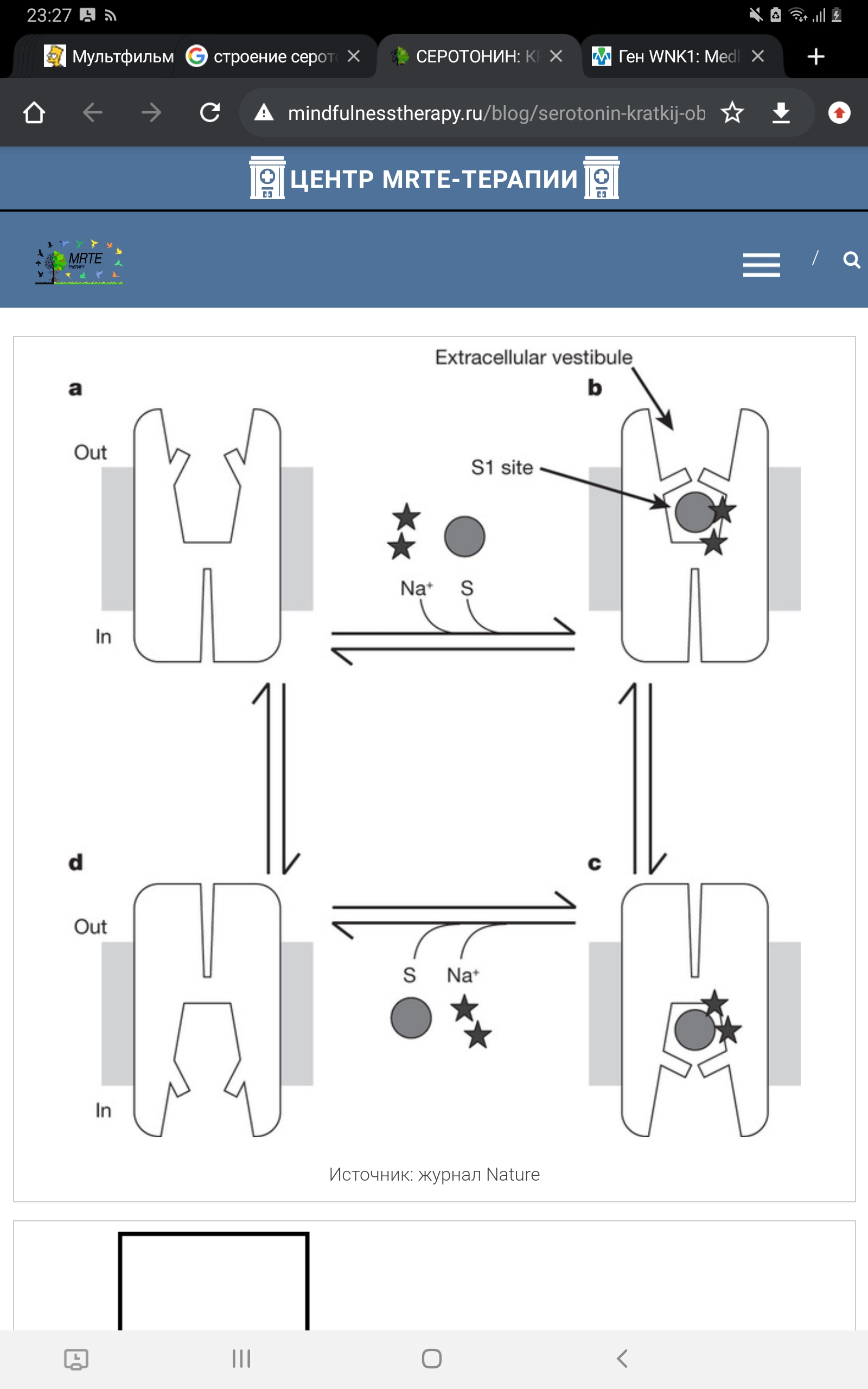
Рисунок 9. Схема движения ионов с функцией переносчика серотонина. 5-HT, 5-гидрокситриптамин. 5-Htt кодируется геном Slc6a4 (англ. solute carrier family 6 member 4), расположенным на 17-й хромосоме в области q11.1-q12. В ранних исследованиях был найден полиморфизм в промоторной области гена, кодирующего 5-Htt, называемый 5-Httlpr (англ. HTT gene-linked promoter region). 5-Httlpr представлен длинным состоящими из 16 повторов (long, L) и коротким из 14 повторов (short, S) аллелями (Murphy et al., 2004)., различающимися наличием/отсутствием участка из 44 нуклеотидных оснований. Данный полиморфизм (полиморфизм типа «вставка /отсутствие вставки») является функциональным: присутствие длинного аллеля обеспечивает более высокий уровень экспрессии гена и большую интенсивность метаболизма серотонина по сравнению с коротким аллелем, а наличие короткого аллеля локуса 5-Httlpr связано со снижением обратного захвата серотонина, что пролонгирует длительность действия освобожденного серотонина (Копытов с соавт., 2012). У человека и обезьян промотор гена 5-Н tt содержит расположенные в –1000 п.н. от сайта инициации транскрипции вариабельные повторы элементов длиной 22 п.н. (5-Httlpr полиморфизм). Было показано, что S-аллель связан со сниженной экспрессией гена в культуре клеток и с более высокой активностью миндалевидного тела в ответ на эмоциональные стимулы (Dannlowski et al., 2008). Во многих работах показана связь полиморфизма 5-Httlpr с тревожностью, депрессией и биполярным расстройством (Karg et al., 2011), однако только часть исследователей обнаруживает взаимосвязь между серотониновыми транспортерами и тревожностью (Sen et al., 2004), а другие исследователи преимущественно не находят такой взаимосвязи (Schinka et al., 2004).
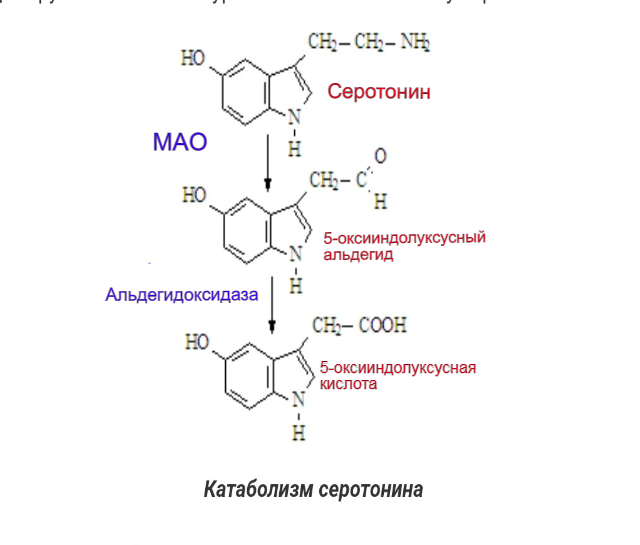
Дальнейшее изучение гена Slc6a4, кодирующего белок транспортер серотонина, выявило еще один функциональный полиморфизм. Первоначально был найден полиморфный участок 5-Httlpr в промоторной области гена, состоящий из 16 (long, L) или 14 (short, S) повторяющихся элементов, описанный выше. Второй полиморфизм, STin2VNTR, выявлен позже и обусловлен изменением числа тандемных повторов во втором интроне с двумя частыми (10 и 12 повторов) и одним редким (9 повторов) аллелями. Этот полиморфизм выполняет роль аллель-зависимого усилителя экспрессии гена, то есть усиливающий эффект полиморфизма зависит от количества повторов в аллеле, и является разным для аллелей 9, 10 и 12 (Морозова c cоавт., 2013) Катаболизм серотонина Серотонин, захваченный из синаптической щели назад в нейрон или глиальную клетку, разрушается с помощью фермента моноаминоксидазы типа А (МАО-А), дезаминирующая активность которого у больных психическими расстройствами повышена по сравнению с нормой серотонина (Максимова с соавт., 2007).
МАО - это митохондриальные ферменты, содержащие флавин, катализирующие окислительное дезаминирование нейромедиаторов и биогенных амидов в головном мозге и периферических тканях. На основании селективности к субстрату и селективности ингибитора были обозначены две формы МАО: МАОА и МАО-Б, которые соответствуют двум различным генам. Обычно MAOA катализирует окисление серотонина (5-Ht), тогда как MAO-Б действует на 2-фенилэтиламин и бензиламин. Дофамин, норадреналин, адреналин, триптамин и тирамин окисляются обеими формами фермента у большинства видов (Youdim, Bakhle, 2006), тогда как норадренергические нейротрансмиттеры предпочтительно дезаминируются ферментами МАО-А. По своему строению эти белки сходны между собой, их аминокислотные последовательности совпадают примерно на 70 %. В то же время эти два фермента различаются по своим функциям. Субстратами для МАО-А являются адреналин, норадреналин, серотонин, гистамин, а также многие фенилэтиламиновые и триптаминовые ПАВ. Субстратами МАО-Б являются фенилэтиламин и дофамин. Т.е. это ферменты, осуществляющий катаболизм моноаминов посредством их окислительного дезаминирования. МАО метаболизирует как эндогенные моноамины — нейромедиаторы и гормоны, так и экзогенные — попадающие в организм с пищей или в лекарствах и психоактивных веществах. Исследования показали, что активность МАО определяется генетически и не изменяется в течение жизни в физиологических условиях. MAO-A и Б кодируются отдельными генами, расположенными на Х-хромосоме. Каждый ген состоит из 15 экзонов с разными коровыми промоторными областями, но с идентичной организацией интрон-экзон, что указывает на то, что MAO-A и Б происходят от дупликации общего предкового гена.
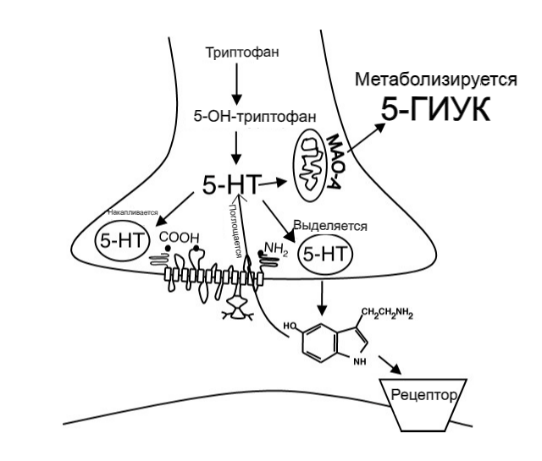
Метаболизм 5-Ht происходит под действием моноаминоксидазы A (MAO-A) с образованием метаболита 5-гидроксииндолуксусной кислоты (5-HIAA). Поскольку MAO-A является внутриклеточным ферментом, 5-Ht должен быть поглощен внутри клетки до того, как на него будут воздействовать, и как Sert, так и транспортер норадреналина (Net) способствуют этому поглощению (Stoltenberg et al., 2002). Ткани или клетки, которые вносят значительный вклад в метаболизм 5-Ht, включают клетки легких, кишечника и эндотелия артериальной системы, но любая клетка, которая может принимать 5-Ht и обладает MAO-A, может метаболизировать 5-Ht.
Рисунок 11. Серотонинергический синапс и обращение с 5-гидрокситриптамином (5-Ht) в результате синтеза, хранения, высвобождения, поглощения и метаболизма. 5-HIAA, 5-гидроксииндолуксусная кислота Рецепторы к серотонину Поразительная полифункциональность серотонина обусловлена, прежде всего, наличием многочисленных рецепторов, опосредующих воздействие этого медиатора на нейроны (Попова, Науменко, 2010). К настоящему времени с помощью молекулярно-биологических методов выявлено и клонировано 14 различных типов генов и контролируемых ими серотонергических (5-Нt) рецепторов, экспрессирующихся в мозге млекопитающих. Классификация 5-Н t рецепторов основана на трех принципах: 1) особенностях первичной структуры; 2) механизмах трансдукции сигнала; 3) на фармакологическом профиле (селективные агонисты и антагонисты рецептора). Таблица. Общая характеристика типов серотониновых рецепторов. (Qi et al., 2014)
По этим принципам 5-Нt рецепторы классифицированы в 8 основных типов и 7 подтипов. Большинство 5-Н t рецепторов принадлежат к суперсемейству рецепторов, сопряженных с G -белками.
Каждый из них представляет собой полипептидную цепь, содержащую семь трансмембранных доменов, образующих совместно с внеклеточными петлями и N-концом участок связывания медиатора. Третья цитоплазматическая петля и С-конец осуществляют сопряжение с G -белком. При связывании медиатора происходит изменение конформации рецептора, приводящее к диссоциации G-белка на β-, γ- и α-субъединицы. Эти субъединицы обладают каталитической активностью, благодаря которой способны изменять внутриклеточные процессы.
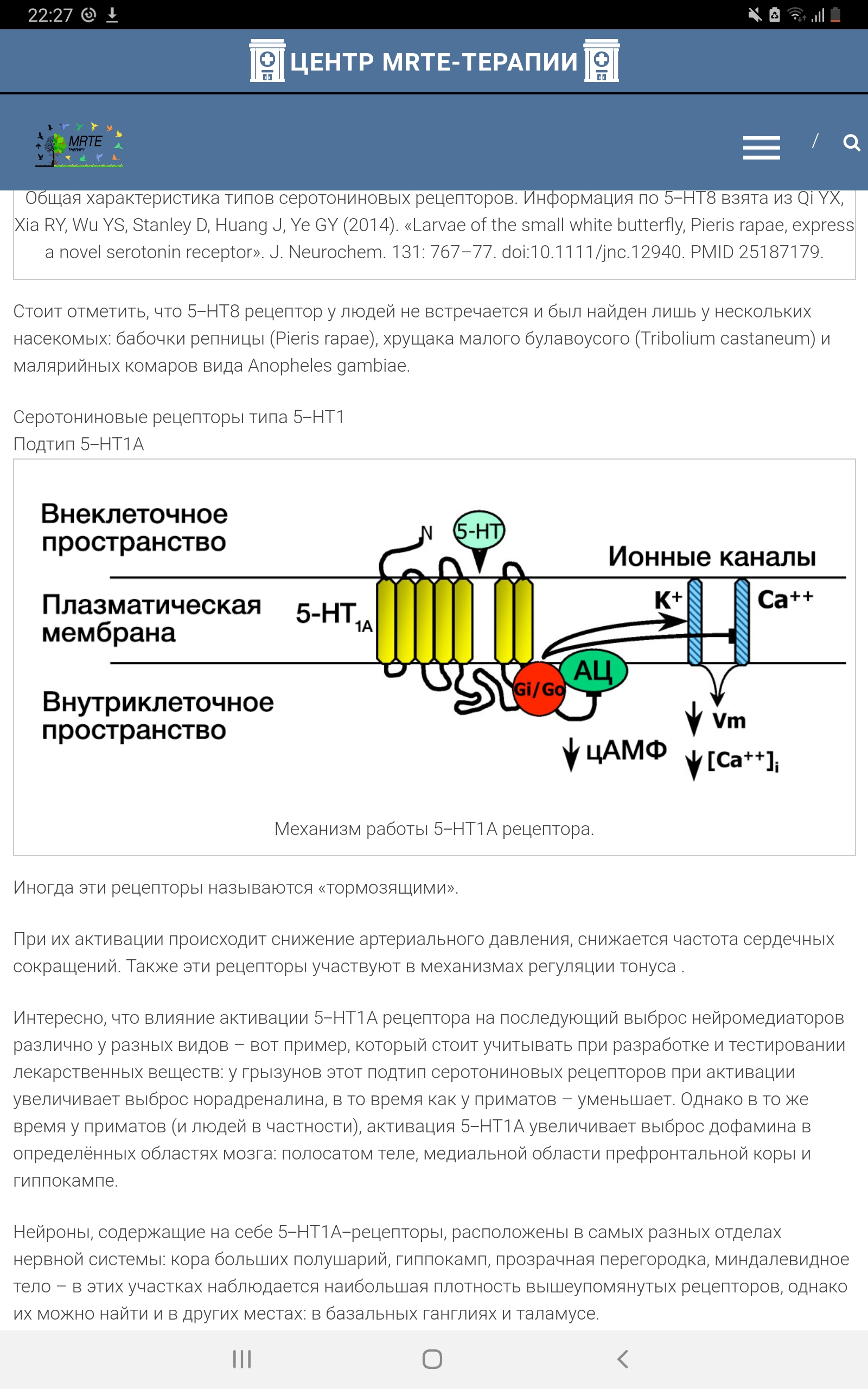
Каждый из типов и подтипов рецепторов характеризуется уникальным контролирующим геном, спектром сродства к разнообразным агонистам и антагонистам серотонина, специфическим распределением в мозге и определенным спектром функций, которые он регулирует. Среди такого разнообразия серотониновых рецепторов привлекает внимание 5-Нt1а подтип. Это обусловлено рядом причин, основными из которых являются: 1) ключевая роль в ауторегуляции 5-Ht системы в мозге (Popova, Naumenko, 2013). 5-Н t 1а рецепторы отличаются от других видов 5-Н t рецепторов тем, что они локализованы как пост-, так и пресинаптически на 5-Н t нейронах, и в зависимости от локализации могут оказывать прямо противоположное действие; 2) экспериментальные данные о вовлечении 5-Н t 1а рецепторов в регуляцию разнообразных форм как нормального, так и патологического поведения; 3) многочисленные данные об участии 5-Н t 1а рецепторов в механизме патологической тревожности и депрессии (Kaufman et al., 2015), подтвержденные клинической эффективностью агонистов 5-Н t 1а рецепторов как анксиолитиков и антидепрессантов; 4) наличие селективных агонистов и антагонистов 5-Нt1а рецепторов. Из-за многообразия функций 5-Н t 1а рецепторов встает вопрос об их генетической и посттранляционной регуляции, связи предрасположенности к патологическому поведению с особенностями генетического контроля, плотности и функциональной активности этих рецепторов. В этом обзоре будут обсуждены данные литературы и собственных исследований, касающиеся генетических подходов к исследованию 5-Н t 1а рецепторов и их участия в регуляции поведения. Рецепторы типа 5-НТ1 В центральной нервной системе (ЦНС) млекопитающих обнаружены серотониновые рецепторы типа 5-Ht1 и пять их подтипов – A, B, D, E, F, представляющие собой протеины, содержащие 365-422 аминокислотных остатка. Эти рецепторы связаны с ингибиторным G-белком, подавляющим аденилатциклазу, за счёт чего подавляется активность внутриклеточных процессов. К примеру, один из относительно новых анксиолитиков - буспирон - способен стимулировать избирательно один из подтипов серотониновых рецепторов (5-Нt1а -рецептор) и имитировать воздействие на него серотонина, вызывая тормозный эффект. 5-Нt1а серотониновый рецептор 5-Нt1а рецептор является эволюционно одним из самых древних. Считается, что он образовался около 800 млн. лет назад, задолго до появления позвоночных животных. Он обнаружен у насекомых (Dacks et al., 2006), плоских червей, круглоротых (Hill et al., 2003) и всех классов позвоночных животных. 5-Нt1а подтип относится к группе рецепторов 5-НТ1 типа, которая также включает в себя 5-Нt1а, 5-Ht1b, 5-Ht1d, 5-Ht1e и 5-Ht1f подтипы, проявляющие от 40 до 63 % структурной гомологии с 5-Нt1а рецептором. Рецепторы 5-Нt1 типа сопряжены с Gi -белком и при активации ингибируют аденилатциклазу – фермент, катализирующий превращение АТФ в цАМФ, что является сигналом для активации цАМФзависимых протеинкиназ, которые в свою очередь активируют различные белки (в том числе факторы транскрипции). Кроме того, активация 5-Н t 1 рецепторов приводит к открытию К+ каналов и гиперполяризации мембраны. Имеются данные о том, что активация рецептора 1А подтипа в культурах клеток может приводить к активации фосфолипазы С. 5-Нt1а рецептор представляет собой полипептидную цепь, образующую семь трансмембранных доменов и состоящую из 422 аминокислотных остатков у крысы и 421 – у человека. Этот рецептор характеризуется коротким внутриклеточным С-концом и длинной третьей внутриклеточной петлей, на которой локализован сайт фосфорилирования протеинкиназой С. Была показана связь между фосфорилированием и десенситизацией рецептора, что дало основание полагать, что функция 5-Нt1а рецепторов находится под контролем 5-Н t 2 рецепторов, вторичным посредником которых является протеинкиназа С (Zhang et al., 2001). Кроме того, в третьей цитоплазматической петле имеются два сайта связывания с кальмодулином, связывание которого является сигналом для интернализации рецептора (Turner et al., 2004). Еще одной особенностью структуры рецептора А подтипа является наличие «лейциновых застежек» (leucine zipper), посредством которых, возможно, осуществляются белок-белковые взаимодействия между 5-Нt1а и 5-Нt2 рецепторами. Все эти особенности структуры 5-Нt1а рецептора приоткрывают возможные пути воздействия на его экспрессию, в том числе другими 5-Н t рецепторами. Факторы, влияющие на экспрессию рецептора, могут, по-видимому, действовать и на уровне транскрипции. В 1999 году была описана структура промотора гена 5-Нt1а рецептора. Было показано, что основной сайт инициации транскрипции локализован в положении –967 п. н. от стартового кодона AUG. У крыс этот сайт ассоциирован с выше расположенными TATA-боксами, однако у мышей TATA-боксы отсутствуют. Принимая во внимание сходство этих животных в экспрессии рецептора и ее регуляции, авторы предположили, что TATA-боксы не играют существенной роли в регуляции транскрипции гена 5-Нt1а рецептора. Кроме того, в промоторе было обнаружено наличие селективного энхансера (enhancer) (между –426 и –117 п.н.), неселективного (между –1519 и –426 п.н.) и сильного селективного сайленсера (silencer) (между –1590 и –1519 п.н.) (Ou et al., 2000). Из этих элементов наиболее интересным является сайленсер, поскольку в случае его делеции транскрипция гена усиливается более чем в 10 раз. Поэтому было предположено, что регуляция экспрессии гена 5-Нt1а рецептора на уровне транскрипции осуществляется, вероятно, в основном за счет репрессии (Ou et al., 2001). Таким образом, наряду с генетическим контролем интенсивности синтеза 5-Ht1а рецепторов существуют и другие уровни регуляции их функциональной активности.
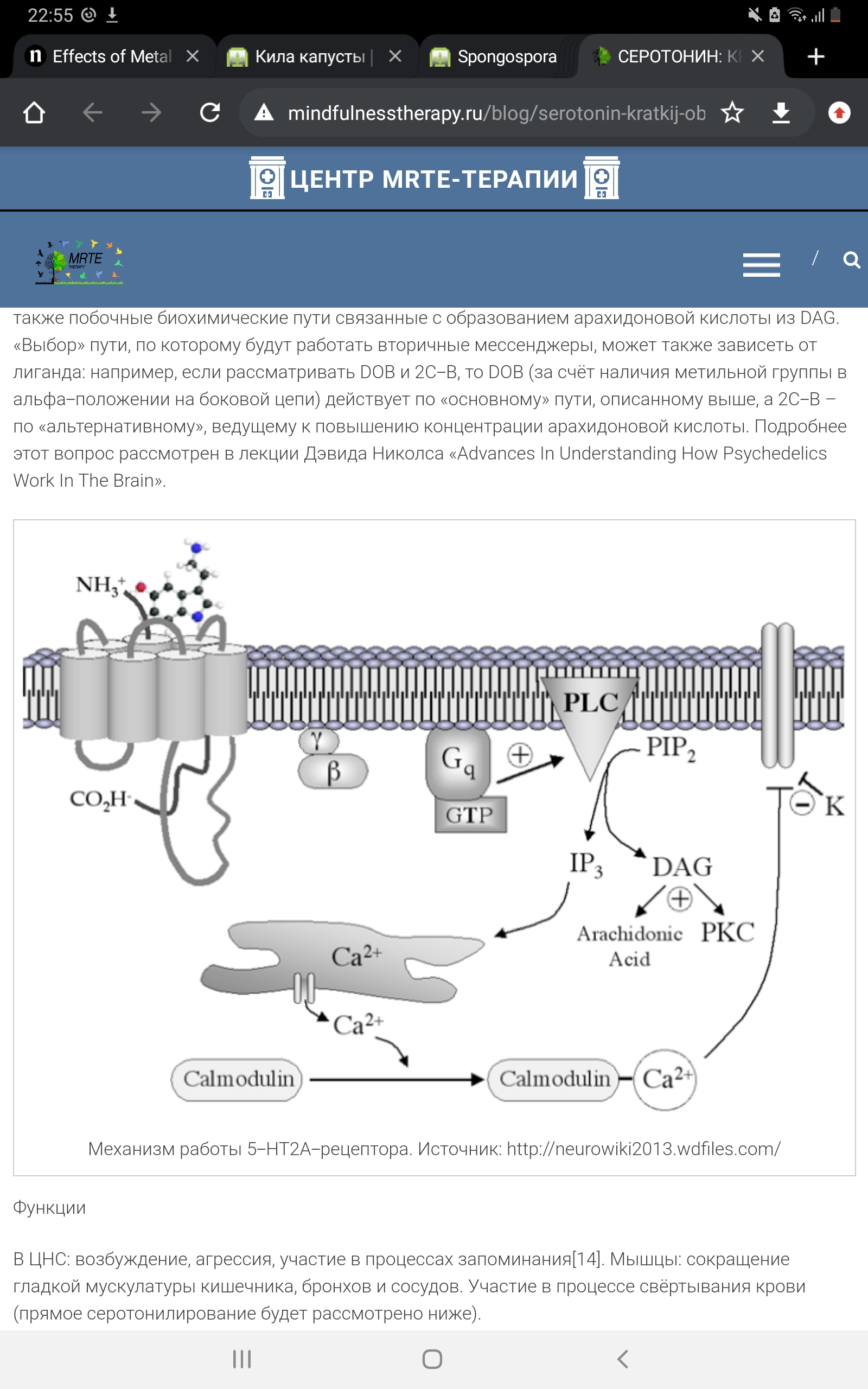
В последние годы к выявленным ранее механизмам регуляции 5-Нt1а рецептора добавлены новые, связанные с олигомеризацией и взаимодействием 5-НТ рецепторов. Было установлено, что 5-Нt1а рецептор существует в мозге в нескольких формах: как 5-Нt1а мономер, 5-Нt1а / 5-Нt1а гомодимер и гетеродимер, связанный с другими рецепторами (Woehler et al., 2009; Kobe et al., 2012; Renner et al., 2012). Новые данные о роли димеризации в регуляции функциональной активности 5-Нt1а рецептора получены при изучении взаимодействия 5-Нt1а и 5-Нt7 рецепторов (Renner et al., 2012; Popova, Naumenko, 2013; Naumenko et al., 2014). Оказалось, что гетеродимер 5-Нt1а/5-Н t 7, не оказывая влияния на функциональные свойства 5-Нt7 рецептора, модулирует два основных фактора десенситизации 5-Нt1а рецепторов: ослабляет их функциональную активность и увеличивает интенсивность интернализации. Таким образом, ключевой регулятор 5-Н t системы мозга, 5-Нt1а рецептор, сам зависит от 5-Нt7 рецепторов, которые, образуя с ним димерные комплексы, ведут к функциональной инактивации. Это совершенно новая и важнейшая роль 5-Н t 7 рецептора и его взаимодействия (cross-talk) с 5-Нt1a рецептором позволяет по-новому взглянуть на проблему механизма депрессии и действия антидепрессантов группы ингибиторов обратного захвата серотонина. Рецепторы типа 5-Н t 2 В отличие от первого типа, они являются возбуждающими. Рецепторы 5-Нt2 увеличивают чувствительность нейрональной мембраны к стимулам. Они уменьшают поступление ионов калия (К+) в клетку и облегчают посредством данного эффекта возникновение деполяризации, в этом отношении они оказывают эффект, противоположный 5-Нt1 -рецепторам. Механизм работы 5-Нt2а -рецептора.
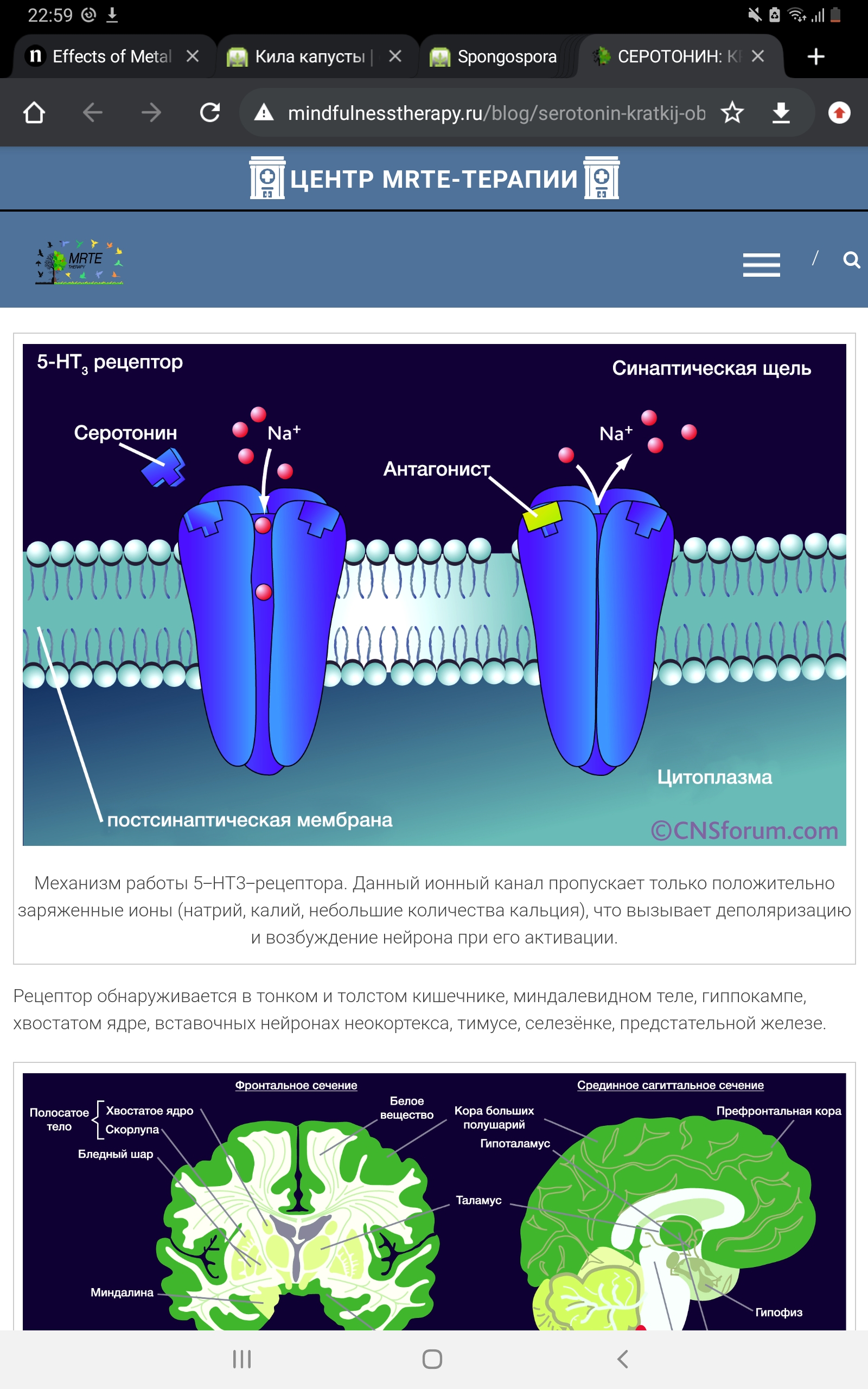
Механизм работы 5-Н t 2а -рецептора При активации рецептора бета- и гамма-субъединицы «высвобождают» Gq -субъединицу, активирующую фосфолипазу С (PLC), которая, в свою очередь, превращает фосфатидилинозитолбисфосфат (PIP2) в диацилглицерол (DAG) и инозитолтрифосфат (IP3). DAG активирует протеинкиназу С (PKC), а IP3 запускает кальмодулин-зависимый механизм высвобождения кальция из эндоплазматического ретикулума. Существуют также побочные биохимические пути, связанные с образованием арахидоновой кислоты из DAG. «Выбор» пути, по которому будут работать вторичные мессенджеры, может также зависеть от лиганда: например, если рассматривать DOB и 2C-B, то DOB (за счёт наличия метильной группы в альфа-положении на боковой цепи) действует по «основному» пути, описанному выше, а 2C-B – по «альтернативному», ведущему к повышению концентрации арахидоновой кислоты. 5-Нt3 -рецептор. Данный вид рецепторов является уникальным в своём роде – это единственный не-метаботропный тип. 5-Нt3 -рецептор представляет собой лиганд-зависимый ионный канал, состоящий из пяти различных субъединиц (5- Ht 3 a, 5- Ht 3в, 5- Ht 3с, 5- Ht 3 d, 5- Ht 3 e). Он может быть представлен в виде гомопентамера, состоящего исключительно из одних 5-Нt3а -субъединиц, либо гетероментамера – когда в его составе, помимо обязательно наличествующей 5-Нt3а -субъединицы, находятся субъединицы других подтипов. Интересно, что по уровню гомологии субъединицы можно разделить на 2 группы: первая включает в себя 5- Ht 3 a и 5- Ht 3в, вторая 5- Ht 3с, 5- Ht 3 d и 5- Ht 3 e. Каждая субъединица состоит из четырёх участков(М1-М4), представляющих собой аминокислотную цепь, уложенную в форме альфа-спиралей, которые пересекают клеточную мембрану. N-конец аминокислотной цепи субъединицы локализован на внешней стороне клеточной мембраны и осуществляет связывание лигандов, трансмембранные участки (а конкретнее – аминокислотная петля, связывающая М2 и М3-участки) непосредственно задействованы в механизме открытия ионного канала. Также присутствует внутриклеточная петля между М3 и М4-участками, участвующая в транспортировке и регуляции работы субъединицы.
Данный ионный канал пропускает только положительно заряженные ионы (натрий, калий, небольшие количества кальция), что вызывает деполяризацию и возбуждение нейрона при его активации. 5- Ht 3 рецептор оказывает стимулирующее влияние на функцию GABA-ергических нейронов в гиппокампе и новой коре головного мозга. Потому что GABA является ингибирующим нейротрансмиттером, что приводит в итоге к уменьшению его активности. Нейрофизиологические свойства указывают на то, что сам 5-Нt3 -рецептор не является G-белок-связанным рецептором. Активность ионного канала регулируется ионами кальция и магния (Ca2+ и Mg 2+). 5-Нt4 -рецептор 5-Нt4 -рецептор, вероятно, является родственным 5-Нt1 -типу. Через влияние на транспорт ионов 5-Нt4 -рецепторы ингибируют гиперполяризацию нейронов и вследствие этого увеличивают их чувствительность. Периферические и центрально расположенные 5-Нt4 - рецепторы играют значимую роль как пресинаптические гетерорецепторы на холинергических окончаниях нервных клеток. Стимуляция этих нейронов приводит к облегчению выделения ацетилхолина. Данный вид рецепторов является метаботропным, при активации повышающим количество цАМФ в клетке, что в свою очередь запускает каскад реакций, ведущий к выбросу нейромедиаторов. Ранее он считался «кардиоспецифичным» рецептором, так как изначально был обнаружен в наибольших концентрациях в предсердных отделах проводящей системы сердца. Вклад мутаций гена этого рецептора в развитие шизофрении достаточно противоречив, однако их связь с возникновением биполярного расстройства подтверждёна достоверно. 5-Нt5 и 5-Нt6 -рецепторы На сегодняшний день всё ещё немногое известно о функции 5-Нt5 и 5-Нt6 -рецепторов. Установлено, что оба рецептора стимулируют активность аденилциклазы. Среди всех рецепторов серотонина тип 5- Ht 5 является наименее изученным. Пока известно лишь то, что в геноме человека представлено 2 подтипа – 5-Нt5а и 5-Нt5в. Однако, ген второго подтипа является псевдогеном, т.к. в его последовательности содержится стоп-кодон, что делает его нефункциональным. У грызунов гены обоих подтипов рецептора являются функциональными. 5-Нt7 -рецепторы 5-Нt7 -рецептор осуществляет свое действие через влияние на активность аденилциклазы. Эти метаботропные серотониновые рецепторы также запускают процессы высвобождения нейромедиаторов путём запуска каскада реакций фосфорилирования через цепь вторичных мессенджеров, т.е. являются «возбуждающими». Изначально они были идентифицированы в качестве подтипа 5-Нt1 -рецепторов, однако позже, благодаря изучению их структуры и аминокислотной последовательности, были выделены в отдельный тип. Этот рецептор играет очень большую роль в определении биоритма. Новые данные о роли димеризации в регуляции функциональной активности 5-Нt1а рецептора получены при изучении взаимодействия 5-Нt1а и 5-Нt7 рецепторов (Renner et al., 2012; Popova, Naumenko, 2013; Naumenko et al., 2014). Оказалось, что гетеродимер 5 -Нt1а / 5-Нt7, не оказывая влияния на функциональные свойства 5-Нt7 рецептора, модулирует два основных фактора десенситизации 5-Нt1а рецепторов: ослабляет их функциональную активность и увеличивает интенсивность интернализации. Таким образом, ключевой регулятор 5-Нt системы мозга, 5-Нt1а рецептор, сам зависит от 5-Нt7 рецепторов, которые, образуя с ним димерные комплексы, ведут к функциональной инактивации. Это совершенно новая и важнейшая роль 5-Нt7 рецептора и его взаимодействия (cross-talk) с 5-Нт1a рецептором позволяет по-новому взглянуть на проблему механизма депрессии и действия антидепрессантов группы ингибиторов обратного захвата серотонина.
ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ Объекты исследования В качестве удобного объекта для изучения влияния стрессовых факторов на организм были выбраны крысы. Крысы являются основными модельными организмами в исследованиях стресса и нейроповедения. В нашей работе стрессовым фактором выступали умеренная физическая нагрузка и гиподинамия- обездвиживание животных. Исследования проводили в виварии КГМУ на самцах и самках крыс. Крыс содержали по 2-4 особи в пластиковых клетках при естественном освещении и оптимальной температуре примерно в 20-22 С, относительной влажностью воздуха 40-60%, световом режиме 12:12, со свободным доступом к воде и пище, кормили брикетированными комбикормами. В исследуемые группы вошли крысы с известной датой рождения, без видимых мутаций. Всего было исследовано 88 крыс- 34 половозрелые самки массой 20-300г и 54 половозрелых самца маcсой 380-470г. Для сравнения полученных результатов исследования стрессовых факторов на изменение экспрессии генов серотонинэргической системы в исследуемой выборке, использовали контрольную группу. В контрольную группу, состоящую и из самок и из самцов крыс проживающие в виварие КГМУ вошло 12 крыс. Все респонденты были физиологически и психически (без “вертячки") здоровы, без видимых мутаций. В качестве материала использовалась лимфоцитарная фракция периферической крови. Методы исследования Эксперимент проводился в несколько этапов. В начале эксперимента крысы были поделены на несколько групп. Далее было осуществлена замерка показателей крыс- их вес, а также помечение их водоустойчивой краской. После чего было осуществлена основная работа- физическая нагрузка и выполнение стресс теста. В конце эксперимента был произведен забор крови для измерения изменения экспрессии генов серотонинэргической системы.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 88; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.14.208 (0.017 с.) |