Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава VIII . Молекулярная организация генома человекаСодержание книги
Поиск на нашем сайте
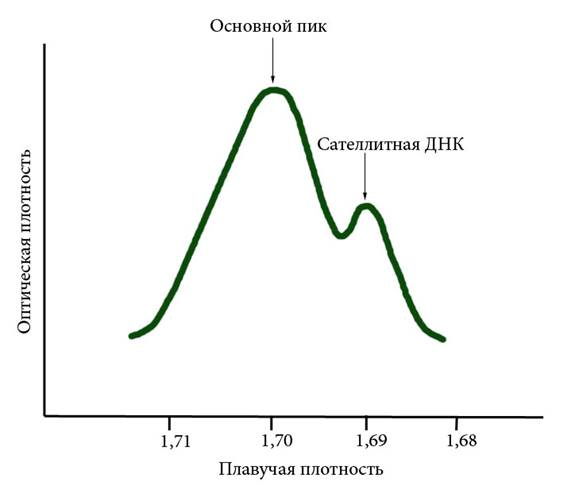
8.1 Повторяющиеся и уникальные последовательности ДНК Последовательности, однократно представленные в геноме, называются уникальными. Более половины генома человека представлено в разной степени повторяющимися последовательностями или повторами. Они могут быть более или менее равномерно распределены по геному (дисперсные повторы) или быть приуроченными к отдельным районам хромосом (консолидированные повторы). К числу последних относят так называемые сателлиты – последовательности, которые при центрифугировании в градиенте плотности составляют отдельный пик (Рисунок VIII, 1). Их назвали сателлитами (спутниками) потому, что соответствующий им пик на графике сопутствует основному. У человека, как и у всех млекопитающих, сателлитная ДНК обогащена АТ-парами и имеет меньшую плавучую плотность по сравнению с тотальной ДНК. В прицентромерных районах всех хромосом человека присутствует альфа-сателлитная ДНК или альфоидная ДНК, имеющая длину повторяющейся единицы 171 п.н. Она является основным структурным компонентом центромеры и формирует прицентромерный гетерохроматин. Некоторые различия по нуклеотидной последовательности в разных хромосомах позволяют использовать альфоидную ДНК в качестве хромосомоспецифического зонда для FISH (например, при пренатальной диагностике на интерфазных клетках). Встречается индивидуальный полиморфизм числа повторов альфоидной ДНК, не имеющий фенотипического проявления. β-сателлитная ДНК, имеющая длину повторяющейся единицы 68 п.н., присутствует в центромерных районах HSA 1, 9, 13, 14, 15, 21, 22 и Y.
Рисунок VIII, 1. Сателлитная ДНК.
Сателлит 1 (длина повторяющейся единицы 25-48 п.н.) локализован в гетерохроматиновых районах большинства хромосом, сателлиты 2 (5 п.н.) и 3 (5 п.н.) могут быть выявлены практически во всех хромосомах. Сателлиты представляют собой тандемные повторы (Рисунок VIII, 2) – повторяющиеся единицы следуют друг за другом и одинаково ориентированы. В инвертированных повторах единицы ориентированы в противоположных направлениях (Рисунок VIII, 3)
Рисунок VIII, 2. Тандемный повтор.
Рисунок VIII, 3. Инвертированный повтор.
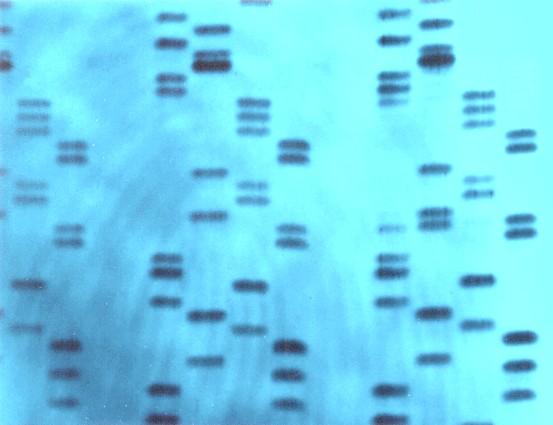
Кроме классических сателлитов в геноме человека присутствуют мини- и микросателлиты. Минисателлиты – тандемные повторяющиеся последовательности с единицей 10-60 п.н., имеющей центральный мотив ГГГЦАГГА*Г. Они локализованы более чем в 1500 сайтах и отличаются значительной вариабельностью из-за часто происходящего неравного кроссинговера, что, собственно, характерно для всех тандемных повторов. При блот-гибридизации по Саузерну фрагментированной ДНК с минисателлитными зондами выявляется индивидуальный рисунок – геномный фингерпринт, который может быть использован для идентификации личности и установления отцовства (Рисунок VIII, 4).
Рисунок VIII, 4. Пример геномного фингерпринта. Фотография Science Photo Library.
Микросателлиты – короткие тандемные повторы с длиной повторяющейся единицы 1-6 п.н. Отличаются значительным полиморфизмом и большим числом равномерно распределенных по геному локусов (около 100000). Эти обстоятельства сделали микросателлиты универсальными маркерами для генетического картирования, идентификации личности, установления родства. Поскольку микросателлиты имеют приемлемую для ПЦР-амплификации длину и с двух сторон фланкированы уникальной ДНК (где можно расположить индивидуальные праймеры), процедура определения аллелей таких полиморфных маркеров достаточно проста и поддается автоматизации (Рисунок VIII, 5). Используя разные флуорохромы, можно одновременно в одной пробирке анализировать полиморфизм сразу нескольких микросателлитных локусов. Анализ длин амплифицированных фрагментов обычно проводят при помощи капиллярного электрофореза с лазерным сканированием, что позволяет выявить различия до одного нуклеотида.
Рисунок VIII, 5. Результаты анализа длин аллелей одного микросателлитного локуса в пределах семьи.
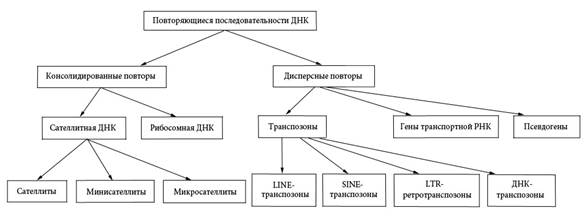
К консолидированным повторам относят также гены рРНК, образующие кластеры (группы повторяющихся единиц) в районах вторичной перетяжки короткого плеча хромосом группы D (HSA 13-15) и группы G (HSA 21 и 22). В отличие от консолидированных повторов дисперсные повторы расположены поодиночке, в разных участках генома. Одна и та же повторяющаяся единица может находиться в тысячах различных сайтов. К дисперсным повторам относят гены транспортной РНК (VI, 1), транспозоны (VI, 9) и псевдогены – не содержащие интронов копии генов, как правило, возникшие путем обратной транскрипции. Из числа транспозонов в геноме человека наиболее широко представлены длинные интерсперсные повторы (LINE) – 850000 копий и 21% генома, короткие интерсперсные повторы (SINE) – 1500000 копий и 13 % генома, ретротранспозоны с длинными концевыми повторами (LTR) – 443000 копий и 8% генома, и ДНК-транспозоны – 300000 копий и 3% генома (VI, 9). К группе LINE относят последовательности длиной около 5 т.п.н., которые содержат промотор, узнаваемый РНК-полимеразой II, ген обратной транскриптазы и иногда гены РНКазы H. На 3’-конце находится сигнал полиаденилирования (ААТААА) и полиА-хвост. У человека имеется только одно семейство повторов LINE – L1. Короткие интерсперсные повторы (SINE) представляют собой последовательности до 500 п.н. и содержат обратные транскрипты фрагментов тРНК, рРНК и мяРНК (VI, 1). У приматов, в том числе и у человека, значительная часть SINE представлена Alu-повторами, имеющими длину 280 п.н. и не содержащими генов. На рисунке VIII, 6 приведена схема классификации уникальных и повторяющихся последовательностей.
Рисунок VIII, 6. Повторяющиеся последовательности генома человека.
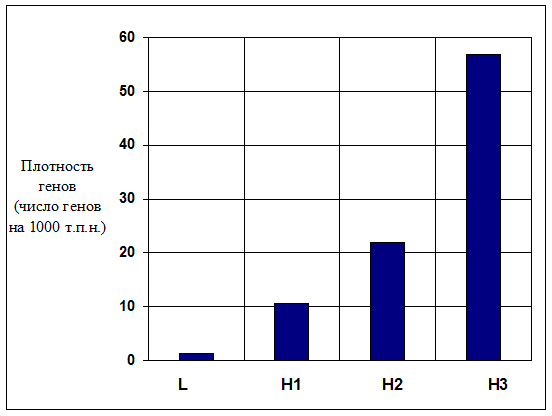
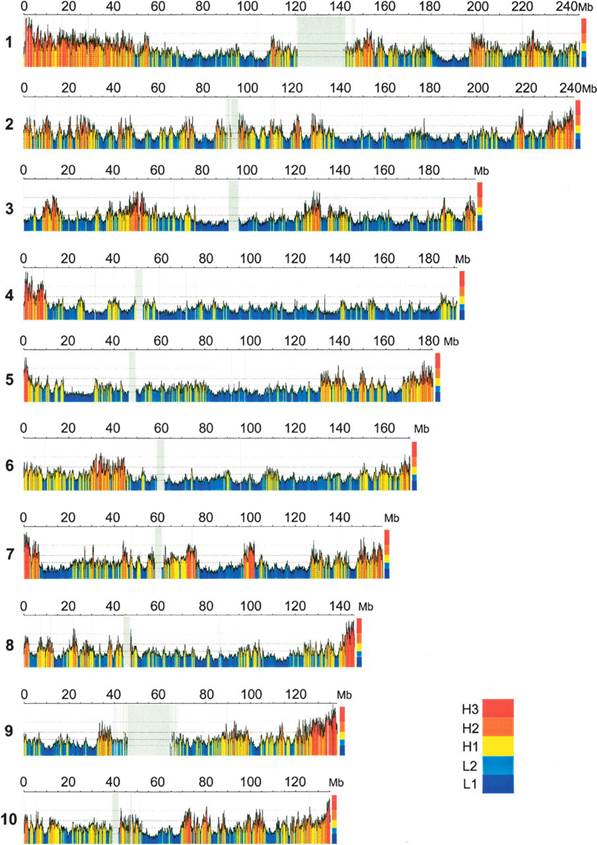
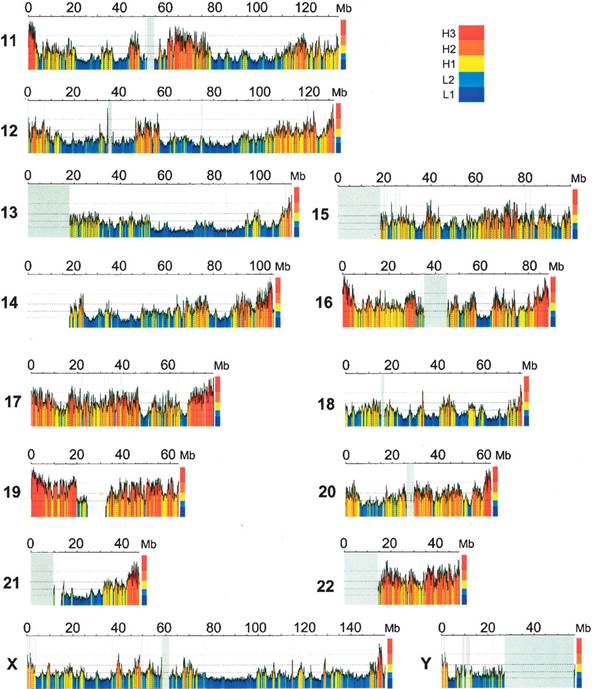
8.2 Композиционная гетерогенность Неоднородность распределения по геному ГЦ- и АТ-обогащенных районов, другими словами, композиционная гетерогенность ДНК, является одной из наиболее важных характеристик молекулярной организации геномов. Более сорока лет назад Бернарди и сотрудники при исследовании генома мыши Mus musculus обнаружили, что комплекс ДНК и серебра может быть разделен с помощью равновесного центрифугирования в градиенте плотности Cs2SO4 по частоте сайтов на молекуле ДНК, связавших серебро. Это открытие позволило с высокой точностью разделять ДНК на фракции. Дальнейшее изучение этих фракций ДНК привело к открытию четкой композиционной гетерогенности ДНК. Композиционно гомогенные сегменты ДНК, принадлежащие к небольшому числу семейств, различающихся по плавучей плотности, были названы изохорами. Фракционирование ДНК по плавучей плотности при центрифугировании фрагментов ДНК в градиенте Cs2SO4 (или сахарозы) было выявлено у большого числа видов животных. Это отражает гетерогенность ДНК по нуклеотидному составу: АТ-богатые последовательности обладают большей плавучей плотностью, чем ГЦ-богатые. Относительные количества ДНК в семействах изохор формируют так называемый композиционный изохорный паттерн генома (также он называется геномным фенотипом), то есть характерный "рисунок" из изохор, являющийся специфичным для каждого отряда или семейства. У человека были выявлены два "легких" семейства изохор: L1 (1,698 г/см3) и L2 (1,700 г/см3), и три "тяжелых": H1 (1,704 г/см3), H2 (1,708 г/см3) и H3 (1,712 г/см3). У человека семейства L1 и L2 составляют свыше 62 % всего генома; Н1 – 22 %, Н2 – 9 %, семейство Н3 составляет около 3 % генома. Наибольшее значение с точки зрения структурно-функциональной организации генома имеет вопрос о связи различных семейств изохор с кодирующими последовательностями ДНК и особенностями их экспрессии. В первых исследованиях этого вопроса было показано, что большинство из 40 взятых в анализ генов человека расположены в ГЦ-богатых семействах. В последствии локализация in silico (путем компьютерного анализа) более 14000 генов человека привела авторов к тому же самому выводу, позднее подтвержденному на еще больших выборках кодирующих последовательностей. На рисунке VIII, 4 представлена диаграмма, демонстрирующая распределение плотности генов в каждом из семейств изохор у человека.
Рисунок VIII, 4. Плотность генов в различных семействах изохор у человека.
Выявление связи временных и межтканевых различий уровня экспрессии генов с ГЦ-уровнем, иными словами, распределения тканеспецифических генов и генов домашнего хозяйства относительно изохор, является не менее важным аспектом характеристики функционального значения композиционной гетерогенности геномной ДНК. Обобщая данные по структуре хроматина и распределению генов и изохор, Дж. Бернарди в 1993 году писал: «Скорее всего, наибольший уровень транскрипции встречается в семействе изохор H3, поскольку там концентрация генов, прежде всего генов домашнего хозяйства, является наибольшей». Гипотеза о высокой транскрипционной активности генов, локализованных в семействе H3, подтверждалась и исследованиями нуклеотидного контекста стартовых АУГ-кодонов. Привлечение дополнительного критерия – процентного содержания гуанина или цитозина в третьем положении кодона (ГЦ3 – уровень) – помимо молярного отношения ГЦ и АТ (ГЦ–уровень) и статистический анализ последовательностей ДНК из геномных баз данных человека и шпорцевой лягушки (Xenopus laevis) позволило установить, что гены домашнего хозяйства 1. преимущественно локализованы в ГЦ-богатых семействах изохор 2. не составляют большинства генов в ГЦ-богатых семействах изохор 3. являются не менее ГЦ3-обогащенными, чем тканеспецифические гены. Повышенное содержание кодирующих последовательностей, более высокий уровень рекомбинации, большое число ГЦ-обогащенных коротких интерспесных повторов (SINE) в тяжелых изохорах, в то время как в легких локализовано значительно меньше генов, ниже уровень рекомбинации и находятся почти исключительно ГЦ-обедненные длинные интерсперсные повторы (LINE), дает основание говорить об изохорах как структурно-функциональных единицах организации генома. Границы между тяжелыми и легкими изохорами на примере детально исследованного в отношении композиционного состава на молекулярном уровне клаcтера генов гистосовместимости (MHC) человека являются более чем композиционными структурами – временные границы репликации в фазе S клеточного цикла практически точно соответствуют физическим границам локализации изохор. Композиционное картирование - это изучение распределения по длине хромосом различных семейств изохор. Особый интерес представляет соотнесение композиционных и цитогенетических карт хромосом, выявление приуроченности фракций изохор к морфологическим (центромера, теломера) и цитохимическим (G/R-блоки) маркерам. Различают «хромосомное» композиционное картирование (методом гибридизации in situ различных фракций изохор на хромосомах в присутствии конкурирующей ДНК, которая позволяет почти полностью исключить неспецифическую гибридизацию повторов) и «молекулярное» - путем локализации генов во фракциях изохор методом ПЦР или блот-гибридизации по Саузерну. У млекопитающих было показано неоднородное распределение разных семейств изохор. Самые "тяжелые" изохоры H3 расположены в Т-дисках (преимущественно прителомерные R-диски, с наиболее ярко выраженными структурно-функциональными характеристиками этой группы) которые характеризуются наибольшей концентрацией генов, особенно генов домашнего хозяйства и онкогенов. Наблюдается общая тенденция приуроченности легких фракций к G-дискам (относительно инертные, позднореплицирующиеся, выявляемые при окрашивании красителем Гимзы) где значительно ниже концентрация генов, чем в R-дисках (обратные G-дискам, ранореплицирующиеся, относительно функционально активные) и расположены преимущественно тканеспецифические гены, а тяжелых изохор к R-дискам. Так у человека Т-диски представлены самым тяжелым семейством изохор H3 и частично семействами H2 и H1, R’-диски (R-диски за исключением из их числа Т-дисков) – семейством H1 с минорным участием семейств H2 и H3 и семействами легких изохор L1 и L2, а G-диски - семействами L1 и L2 с минорным компонентом H1. У домовой мыши мажорным компонентом Т-дисков являются изохоры семейства H2, R’-диски представлены преимущественно изохорами семейства H1 с незначительным участием L1 и L2, а G-диски – почти исключительно семействами легких изохор L1 и L2. В интерфазных ядрах было показано полярное относительно друг друга расположение наболее легких и наиболее тяжелых фракций изохор, что, по всей видимости, отражает близость наболее ГЦ-богатых теломерных районов интерфазных хромосом. На рисунке на рисунке VII, 5 показано распределение изохор по длине хромосом человека. Тонкое физическое картирование изохор на прометафазных хромосомах человека позволило построить композиционные карты высокого разрешения, совмещенные с картами контигов протяженных геномных клонов. Такие карты представлены в сети Интернет (http://bioinfo2.ugr.es/isochores), что дает возможность быстро получить композиционную характеристику любого изучаемого района или фланкирующей области любой последовательности генома человека.
А.
Б. Рисунок VIII, 5. Распределение изохор по длине хромосом человека. По материалам Genome Researches. 2006. V. 16. P: 536-541.
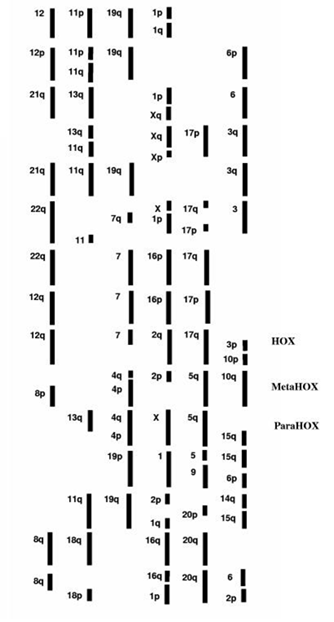
8.3 Ортология и паралогия Полагают, что в ходе ранней эволюции часто происходили дупликации генов, что привело к быстрой дивергенции и специализации ферментативных реакций, определивших разнообразие жизненных форм на Земле. Увеличение размеров геномов, возникновение новых ферментативных реакций, формирование цитоскелета, появление комплексных путей метаболизма считают прямыми следствиями генной дупликации. Понятие «гомология» применяют по отношению к двум структурам или последовательностям (нуклеотидным или аминокислотным), которые развились из одной предковой структуры или последовательности. Чтобы классифицировать различные типы гомологии принято использовать термины «ортология» и «паралогия». Ортологическими называются структуры или последовательности двух различных организмов, которые произошли из одной предковой структуры или последовательности, совсем не обязательно сохраняя функции их предшественника. Поскольку проследить эволюцию структур или последовательностей на практике не всегда представляется возможным, обычно эволюционный консерватизм структур или последовательностей служит основанием для того, чтобы считать их ортологическими. Пример ортологии - β-цепи глобина человека и домовой мыши. Понятие «паралогии» относится к структурам или последовательностям, возникшим в результате дупликации. Обычно понятие «паралогии» применяют к гомологичным структурам или последовательностям в пределах одного генома. Например, β-цепь глобина человека является паралогом α-цепи глобина и миоглобина человека, поскольку они все произошли в результате последовательных дупликаций. Для серий паралогичных районов, которые могут считаться происшедшими от одного предкового района, предложен термин «паралогон». Копаралогами называются гены, принадлежащие к одному паралогону, не зависимо от того, являются ли они между собой паралогами или нет. Общий предок районов, входящих в один паралогон, называется «протопаралогон». Два раунда крупномасштабных дупликаций произошли в ходе ранней эволюции позвоночных животных согласно так называемой гипотезе 2R (другое название – модель «один-к-четырем»). Следовательно, каждый ген должен быть представлен четырьмя гомологичными последовательностями в каждом геноме. Процессы дивергенции и специализации могли существенно изменить структурные и функциональные характеристики гомологов, а дупликации и делеции – их число. Наличие большого числа паралогичных нуклеотидных последовательностей, представленных двумя или тремя генами, свидетельствует о возможной массовой потере генов после двух раундов дупликации в соответствии с вышеизложенной гипотезой. Локализация в паралогонах и сходство последовательностей двух или нескольких молекул ДНК может служить основанием для поиска их общего предшественника, как это показано на примере генов семейства WNT (гомологов wingless-type генов дрозофилы) человека. Вопрос о том, насколько физическая кластеризация (локализация в одном хромосомном районе) отражает функциональную кластеризацию нуклеотидных последовательностей и, следовательно, возможна ли коэволюция функционально-специализированных районов хромосом, обсуждается в течение последних десяти лет. Активация отдельных районов хромосом в определенных клеточных линиях может быть объяснением природы парологичных районов. Например, гены ацетилхолинэстеразы и тироглобулина имеют гомологию нуклеотидных последовательностей и расположены вблизи от генов нейропептида Y (HSA 7) и панкреатического полипептида Y (HSA 17), соответственно. Таким образом, два гена из паралогичного района хромосомы 7 экспрессируются в клетках нервной системы, а два гена соответствующего района хромосомы 17 – в клетках иммунной системы. Анализ распределения генов, кодирующих белки, вовлеченные в различные функциональные комплексы, по длине хромосом человека позволил установить соответствие некоторых паралогонов блокам генов, вовлеченных в один каскад реакций. Таким образом, паралогия может быть связана с функциональной специализаций отдельных районов хромосом. С другой стороны, могут присутствовать механизмы, обеспечивающих дифференциальную экспрессию паралогонов в различных клеточных линиях. Данные сравнительного изучения паралогических районов хромосом человека и дрозофилы послужили основанием для гипотезы коэволюции функциональных кластеров. Гены нескольких семейств (плазминогенные активаторы, анкирины, рецепторы ростовых факторов фибробластов, адренергические рецепторы, везикулярные моноамин-транспортеры, липопротеин липазы), представленные в четырех районах хромосом человека – HSA 4p16, HSA 5q33-q35, HSA 8p12-p21, HSA 10q24-q26) – оказались представлены в геномах позвоночных, включая костистых рыб, в виде консервативных паралогонов. В то же время, у иглокожих, насекомых и нематод, указанные семейства представлены одним геном. Интересно, что у плодовой мушки Drosophila melanogaster и нематоды (круглого червя) Caenoarabditis elegans гомологи генов этих семейств сцеплены. Преполагают, что протопаралогон существует со времени происхождения многоклеточных животных. На примере гомеозисных генов семейства HOX и инсулиноподобных белков показано, что, скорее всего, тетраплоидизация имела место на рубеже цефалохордовые – черепные. В настоящее время известно 15 паралогонов человека (серий паралогических районов, имеющих происхождение от одного предкового района) (Рисунок VIII, 6), которые включают более 1700 генов, что составляет около 5% от общего числа генов человека. Большинство генов, входящих в паралогоны, представляют обширные семейства, такие как иммуноглобулины, ольфакторные рецепторы, антигены гистосовместимости и т.д.
Рисунок VIII, 6. Обобщенная карта паралогонов человека. Обращает на себя внимание тот факт, что районы хромосом расположены по четыре – в соответствии с 2R-гипотезой. По материалам FEBS Letters, 2001, V. 491, P.: 237-242.
На основании паралогии картирование генома может проводиться быстрее – зная локализацию одного представителя семейства генов и паралогию этого хромосомного района другим районам, можно предсказать три наиболее вероятных сайта локализации другого представителя того же генного семейства. Зная локализацию двух или трех генов семейства, можно предсказать соответственно два или один возможный район локализации. Наряду с традиционными морфологическими подходами к изучению эволюционных отношений и механизмов данные сравнительного картирования хромосом позволяют делать выводы о путях эволюции. В этом случае участки хромосом разных организмов можно рассматривать как морфологические структуры, которые могут проявлять отношения гомологии и аналогии между собой. Быстрый прогресс геномного картирования, преимущественно на различных видах млекопитающих, позволил применить указанный подход и выявить неожиданно высокий уровень эволюционного консерватизма хромосомных районов. Среди животных наиболее подробно феномены ортологии изучены в геномах человека и домовой мыши. Выявлено 202 района ортологии, которые включают более 1800 кодирующих последовательностей (База данных Национального Центра Биотехнологической Информации США, http://www.ncbi.nlm.nih.gov/Omim/Homology). Наиболее детальная информация об эволюционном консерватизме хромосомных районов может быть получена при сравнении полностью секвенированных геномов или хромосом различных видов. В этом случае становится возможным выявление точек разрыва ортологии хромосомных районов с точностью до нуклеотида. Сравнение полной нуклеотидной последовательности хромосомы 16 домовой мыши (хромосомы мыши Mus musculus обозначают MMU, например, - MMU 16) и генома человека позволило охарактеризовать на молекулярном уровне эволюционный консерватизм MMU 16 и HSA 3, HSA 8, HSA 12, HSA 16, HSA 21, HSA 22. Хромосома 16 была выбрана для сравнения, поскольку было известно, что есть протяженный участок ее гомологии (около 25 миллионов пар оснований) с хорошо охарактеризованной хромосомой 21 человека. В отношении кодирующих последовательностей ДНК с неизвестной функцией (ESTs) принят критерий ортологичности – более 80% гомологии нуклеотидной последовательности на протяжении более 100 пар оснований. В данной работе показан эволюционный консерватизм локализации 11 822 кодирующих последовательностей со средним значением идентичности нуклеотидной последовательности 88,1% и средней длиной ортологичных генов 198 пар оснований. В среднем на каждые 8 тысяч пар нуклеотидов приходился один консервативный маркер. Эволюционный консерватизм состава кодирующих последовательностей в ортологичных районах может быть выявлен при помощи стандартных методов физического картирования. Сравнение между собой крупномасштабных последовательностей различных геномов позволяет установить наличие консерватизма порядка расположения генов по отношению друг к другу на участках, трудно разрешимых для обычных методов. В случае, когда три последовательности в пределах короткого интервала на хромосоме расположены в том же порядке, что и гомологичные им последовательности на хромосоме другого вида, это их отношение определяется как «консерватизм синтении». Оказалось, что блоки консервативной синтении человека и домовой мыши могут включать от нескольких до нескольких сот генов, причем отмечается в среднем больший физический размер синтенных блоков человека. Суммарная длина синтенных блоков на MMU 16 – 92 миллиона пар оснований, а в ортологичных ей районах хромосом человека – 108 миллионов пар оснований. Помимо, безусловно, большого значения для теоретической биологии феномен ортологии оказался очень полезен для картирования геномов, поскольку, основываясь на консерватизме изучаемых районов, можно экстраполировать данные по картированию генома более изученного в этом отношении вида на менее изученный. Поскольку в настоящее время наиболее изученным видом является человек, выявление ортологии нуклеотидных последовательностей и хромосомных районов любого вида позвоночных животных и человека имеет особое значение.
8.4 Геномные базы данных Геномные базы данных представляют собой электронные библиотеки и служат для обобщения и хранения информации о генах, геномах, генотипах, фенотипах и любых данных, имеющих отношение к наследственности. Как правило, доступ к ним не ограничен. С любого компьютера, подключенного к сети Интернет, можно проводить поиск информации как исходя из названия гена или мутации, так и исходя из фенотипического признака (например, наследственного заболевания). Наиболее полная и упорядоченная информация по геному человека хранится на портале NCBI – www.ncbi.nlm.nih.gov, который поддерживается сотрудниками Национальных институтов здоровья США (National Institutes of Health). Поиск по фенотипам обычно начинают с базы данных OMIM (www.ncbi.nlm.nih.gov/omim), интерфейс которой показан на рисунке VIII, 7. Название фенотипического признака позволяет получить сведения о различных генах, связанных с его проявлением, их локализации на хромосомах, известных мутациях. Справа находится гиперссылка на связанные ресурсы – можно получить нуклеотидную и аминокислотную последовательности, узнать в каких тканях и на каких стадиях происходит экспрессия, есть ли альтернативный сплайсинг, существуют ли коммерческие средства диагностики. Также можно узнать названия и адреса лабораторий, где проводят молекулярные тесты для данного фенотипа.
Рисунок VIII, 7. Интерфейс базы данных OMIM.
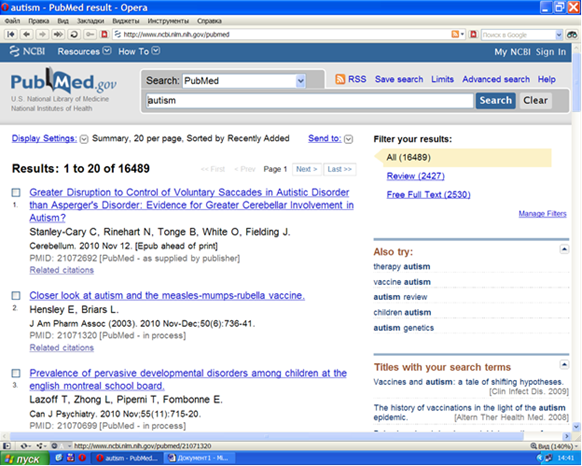
База данных PubMed (Рисунок VIII, 8) содержит названия, сведения об авторах и резюме наиболее значимых научных публикаций по биологии и медицине. Поиск проводится по ключевым словам, фамилиям авторов и выходным данным публикации.
Рисунок VIII, 8. Интерфейс базы данных PubMed.
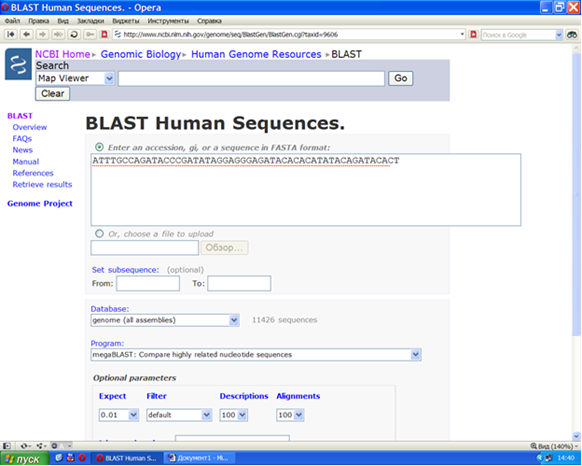
Если требуется собрать все сведения об имеющейся нуклеотидной последовательности, можно воспользоваться системой поиска BLAST (Рисунок VIII, 9). Параметры поиска можно варьировать, исходя из целей исследования. Все последовательности, имеющие гомологию с изучаемой, принципиально могут быть обнаружены таким образом. Гиперссылки в правом верхнем углу позволят получить информацию о хромосомной локализации, экспрессии, процессинге генов, имеющих гомологию с исходной последовательностью.
Рисунок VIII, 9. Интерфейс поисковой системы BLAST.
Карты хромосом с возможностью поиска по названию или символу маркера, а также по отдельным хромосомным районам, находятся в разделе MapViewer (www.ncbi.nlm.nih.gov/mapview) (Рисунок VIII, 10).
Рисунок VIII, 10. Интерфейс системы MapViewer.
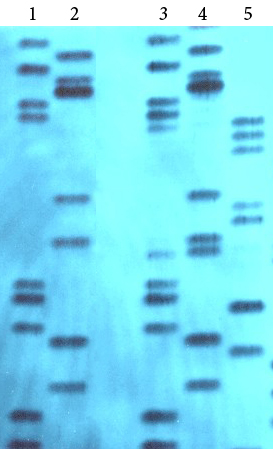
Контрольные вопросы и задания к главе VIII 1. Микросателлиты относятся к группе: А. дисперсных повторов Б. консолидированных повторов В. транспозонов. 2. На рисунке VIII, 11 представлены данные геномного фингерпринтинга. Определите родственных индивидуумов.
Рисунок VIII, 11. Данные геномного фингерпринтинга для задачи 2 к главе VIII.
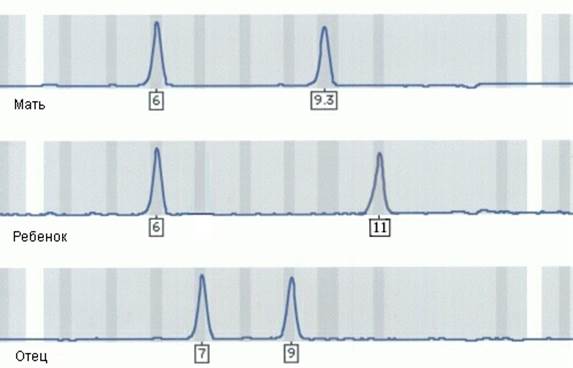
3.Формальный отец ребенка сомневается в своем биологическом отцовстве. Справедливы ли его опасения по данным микросателлитного анализа, приведенным на рисунке VIII, 12?
Рисунок VIII, 12. Данные микросателлитного анализа для задачи 3 к главе VIII.
4. Поиск по нуклеотидным последовательностям лучше проводить в системе: А. BLAST Б. OMIM В. PubMed.
Дополнительная литература к главе VIII Сингер М., Берг П. Гены и геномы: В 2-х т. Т. 1// М.: Мир. 1998. – 373 С.
|
||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 220; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.104.36 (0.016 с.) |