
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 2. Электролиз растворов солей ⇐ ПредыдущаяСтр 8 из 8
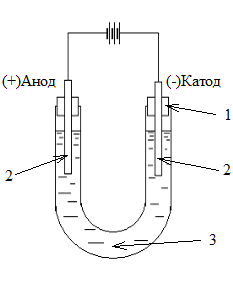
Рис. 2. Схема лабораторного электролизера. 1 – пробки; 2 – графитовые электроды; 3 – электролит.
Реактивы и оборудование. Электролизер (U-образная стеклянная трубка); источник постоянного тока; графитовые электроды, электрические провода, раствор ZnSO4 0,5 н; раствор CuSO4 0,5 н; раствор Na2SO4 0,5 н, раствор KI 0,5 н индикаторы лакмус и фенолфталеин. а) Электролиз водного раствора сульфата натрия Выполнение работы. Собрать электролизер в соответствии со схемой, приведенной на рис. 2. Заполнить электролизер раствором Na2SO4, подключить источник питания. Наблюдать изменения, происходящие на электродах и в растворах в обоих коленах электролизера. б) Электролиз водного раствора иодида калия Выполнение работы. Собрать электролизер в соответствии со схемой, приведенной на рис. 2. Заполнить электролизер раствором КI, подключить источник питания. Наблюдать изменения, происходящие на электродах и в растворах в обоих коленах электролизера. После окончания опыта в каждое колено электролизера добавить по 2-3 капли крахмала и фенолфталеина. в) Электролиз водного раствора сульфата меди Выполнение работы. Собрать электролизер в соответствии со схемой, приведенной на рис. 2. Заполнить электролизер раствором CuSO4, подключить источник питания. Наблюдать изменения, происходящие на электродах и в растворах в обоих коленах электролизера. Запись данных опыта. Зарисовать прибор, записать результаты наблюдений за изменениями, происходящими на электродах и в растворах в обоих коленах электролизера. 1. Определить последовательность разряда ионов на катоде и аноде. 2. Записать катодные и анодные реакции. Определить продукты реакции, образующиеся на электродах. 3. Объяснить изменение окраски индикаторов в растворах у катода и анода. Контрольные вопросы 1. Составить схему электрохимической коррозии никелированного и хромированного железа в кислой и нейтральной средах. Скорость какого процесса больше? 2. Написать уравнения реакций катодного и анодного процессов при электролизе водных растворов хлорида никеля, нитрата кальция, гидроксида натрия, нитрата серебра.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Глинка Н.Л. Общая химия: Учеб. пособие для вузов. – 23-е изд. – Л.: Химия, 1984. – 704 с. 2. Фролов В.В. Химия: Учеб. пособие для машиностроит. спец. вузов. – 3-е изд. – М.: Высш. шк., 1986. – 543 с. 3. Васильева З.Г., Грановская А.А., Таперова А.А. Лабораторные работы по общей и неорганической химии: Учеб. пособие для вузов. – 2-е изд. – Л.: Химия, 1986. – 288 с. 4. Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. – М.: Химия, 1993. – 592 с. 5. Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ. – М.: Химия, 1997. – 480 с. 6. Неорганическая химия. Химия элементов: Учебник в 2-х тт. / Ю.Д. Третьяков, Л.И. Мартыненко, А.Н. Григорьев, А.Ю. Цивадзе. – М.: Изд-во МГУ, Академкнига, 2007. ПРИЛОЖЕНИЕ Таблица П. 1 Стандартные электродные потенциалы
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 111; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.81.154 (0.009 с.) |
 В
В




