Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
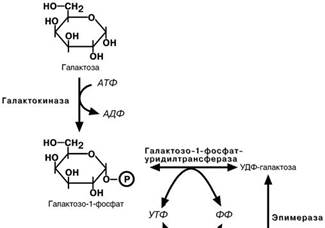
Нарушения превращения галактозы
Нарушения обмена галактозы вызваны генетическим де- фектом нескольких ферментов:
• галактокиназы, частота дефекта 1:500000;
• галактозо-1-фосфат-уридил-трансферазы, частота дефекта 1:40000;
• эпимеразы, частота дефекта менее 1:1000000.
Заболевание, возникающее при этих нарушениях получи-
ло название галактоземия.
Диагностика. Концентрация га-
лактозы в крови возрастает до
11,1-16,6 моль/л (норма
0,3-0,5 ммоль/л), в крови также по-
является галактозо-1-фосфат. К ла-бораторным критериям относятся
также билирубинемия, галактозурия,
протеинурия, гипераминоацидурия, накопление гликозилированного ге-
моглобина. Дети отказываются от
еды,
Патогенез. Избыток галактозы
превращается в спирт галактитол (дульцитол), накапливающийся в
хрусталике и осмотически привле-
кающий сюда воду. Изменятся соле-вой состав и белки хрусталика, что
приводит к катаракте в молодом
возрасте. Катаракта возможна даже у плодов матерей с галактоземией,
употреблявших молоко во время бе-ременности. При дефекте галактозо-1-фосфат-уридил-трансферазы АТФ постоянно расходуется на фосфо-
рилирование галактозы и дефицит энергии "токсически" действует на нейроны, гепа-
тоциты, нефроциты, угнетает активность многих ферментов. Как результат возмож-
ны задержка психо-моторного развития, умственная отсталость, некроз гепатоцитов и цирроз печени. В почках и кишечнике избыток галактозы и ее метаболитов ингиби- рует транспорт аминокислот.
Лечение: исключение из рациона молока и других источников галактозы позво-ляет предотвратить развитие патологических симптомов. Однако сохранность ин- теллекта может быть достигнута только при ранней, не позднее первых 2 месяцев
жизни, диагностике и вовремя начатом лечении.
СУДЬБА ГЛЮКОЗЫ В КЛЕТКЕ
Попав в клетку, глюкоза сразу же фосфорилируется. Фосфорилирование глюко-
зы решает сразу несколько задач: • фосфатный эфир глюкозы не в состоянии выйти из клетки, так как молекула
отрицательно заряжена и отталкивается от фосфолипидной поверхности
мембраны;
• наличие заряженной группы обеспечивает правильную ориентацию молеку-
лы в активном центре фермента;
• уменьшается концентрация свободной (нефосфорилированной) глюкозы, что способствует диффузии новых молекул из крови.
Ф ОСФОРИЛИРОВАНИЕ ГЛЮКОЗЫ
Наибольшие запасы гликогена имеются в печени и скелетных мышцах, но во-обще гликоген способен синтезироваться во всех тканях. Резервы гликогена в клет-
ках используются в зависимости от функциональных особенностей клеток. Гликоген печени расщепляется при снижении концентрации глюкозы в крови,
прежде всего между приемами пищи. Через 12-18 часов голодания запасы гликогена в печени полностью истощаются. В мышцах количество гликогена снижается обычно только после физической нагрузки – длительной и напряженной. Повышение содер-
жания гликогена в мышцах отмечается в период восстановления при приеме богатой
углеводами пищи. В печени гликоген накапливается после еды.
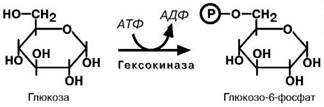
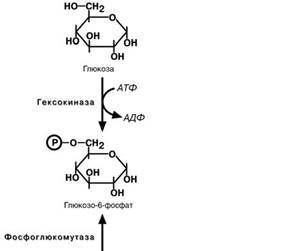
Такие отличия печени и мышц обусловлены наличием различных изоферментов гексокиназы,фермента,который фосфорилирует глюкозу в глюкозо-
6-фосфат.
Для печени характерен изо-
фермент, получивший собственное
название – глюкокиназа. Отличия-ми этого фермента от гексокиназ других тканей являются:
• в низком сродстве к глюко-зе, что ведет к захвату глюкозы печенью только при ее высокой концентра-
ции в крови (после еды);
• продукт реакции – глюкозо-6-фосфат – не ингибирует фермент, в то время как в других тканях гексокиназа чувствительна к такому влиянию. Благодаря этим отличиям гепатоцит может эффективно захватывать глюкозу по-
сле еды и метаболизировать ее в любом направлении.
Например, при переполнении запасов гликогена накапливающийся глюкозо-6-фосфат не подавляет глюкокиназу и усвоение глюкозы, а просто идет на
окисление до ацетил- S -КоА и в пентозофосфатный цикл, что в целом увели-
чивает синтез липидов.
Регуляция глюкокиназы: активация–андрогены и инсулин,подавление–глю-кокортикоиды и эстрогены.
МЕТАБОЛИЗМ ГЛИКОГЕНА
М ОБИЛИЗАЦИЯ ГЛИКОГЕНА
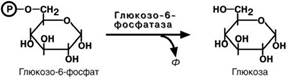
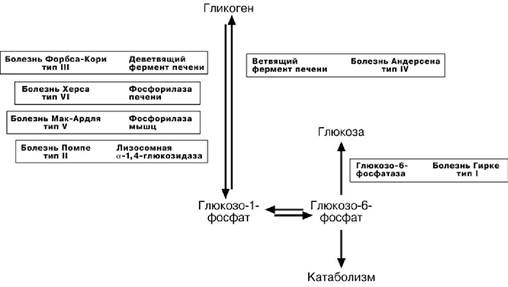
Мобилизация (распад) гликогена или гликогенолиз в норме активируется при недостатке свободной глюкозы в клетке, а значит и в крови (голодание, мышечная работа). При этом уровень глюкозы крови поддерживают только печень и почки, ткани в которых имеется фермент глюкозо-6-фосфатаза, гидролизующий фосфат-ный эфир глюкозы. Образуемая свободная глюкоза выходит через плазматическую мембрану в кровь. Остальные органы используют гликоген только для собственных нужд.
В гликогенолизе непосредственно участвуют три фермента:
1. Фосфорилаза гликогена –расщепляетα-1-4-гликозидные связи с образова-
нием глюкозо-1-фосфата. Фермент работает до тех пор, пока до точки ветвления
α(1-6) не останется 4 остатка глюкозы.
2. α (1-4)– α (1-6)-глюкантрансфераза,фермент переносящий трисахаридный
фрагмент на другую цепь с образованием новой α-1-4-гликозидной связи. При этом
на прежнем месте остается один остаток глюкозы и «открытая» доступная α-1-6-гликозидная связь. 3. Амило- α -1-6-глюкозидаза, «деветвящий»фермент–гидролизует
α-1-6-гликозидную связь с высвобождением свободной глюкозы. В результате обра-зуется цепь без ветвлений, служащая субстратом для фосфорилазы.
А КТИВАЦИЯ ФОСФОРИЛАЗЫ
Скорость гликогенолиза лимитируется только скоростью работы фосфорилазы гликогена. Ее активность может изменяться трямя способами.
Ковалентная модификация
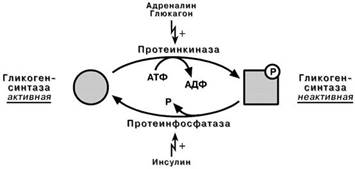
Происходит фосфорилирование фермента при действии гормонов на клетку
через аденилатциклазный механизм. Он является так называемым каскадным регу-лированием:
1. Молекула гормона взаимодействуя со своим рецептором, активирует фермент
аденилатциклазу.;
2. Аденилатциклаза превращает АТФ в циклический АМФ (цАМФ) – вторичный
посредник или мессенджер;
3. цАМФ аллостерически активирует фермент протеинкиназу А;
4. Протеинкиназа А фосфорилирует различные внутриклеточные белки. Одним из этих белков является киназа фосфорилазы, которая при фосфорилировании ак- тивируется;
5. Киназа фосфорилазы фосфорилирует фосфорилазу " b " гликогена, послед-
няя в результате превращается в активную фосфорилазу "а";
6. Активная фосфорилаза " а" гликогена расщепляет α-1-4-гликозидные связи в гликогене с образованием глюкозо-1-фосфата.
Активация ионами кальция
Второй способ регуляции заключается в активации киназы фосфорилазы не протеинкиназой, а ионами Ca 2+ и кальмодулином. Этот путь работает при инициа-ции кальций-фосфолипидного механизма. Такой способ оправдывает себя, напри- мер, при мышечной нагрузке, когда гормональные влияния недостаточны, зато в ци- топлазму под влиянием нервных импульсов поступают ионы Ca2+. Также некоторые
гормоны влияют на углеводный обмен посредством этого механизма.
Активация с помощью АМФ
Третий способ–аллостерическая активация благодаря присоединению АМФ кмолекуле фосфорилазы " b ". Способ работает в любой клетке – при увеличении рас-
хода АТФ и накоплении продуктов его распада.
С ИНТЕЗ ГЛИКОГЕНА
Синтез гликогена начинается с обра-
зования глюкозо -6 -фосфата под действи-ем глюкокиназы в печени или других гек-
сокиназ в остальных тканях. Как уже гово-
рилось, глюкокиназа обладает низким сродством к глюкозе и в гепатоцитах глю- коза будет задерживаться только при вы-
соких концентрациях ее в клетке. Непосредственно же синтез гликогена осуществляют следующие ферменты:
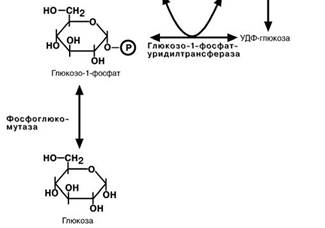
1. Фосфоглюкомутаза – превращает глюкозо-6-фофат в глюкозо-1-фофат; 2. Глюкозо-1-фосфат-уридил-трансфе-
раза – фермент, осуществляющий ключе-вую реакцию синтеза. Необратимость этой реакции обеспечивается гидролизом
образующегося дифосфата;
3. Гликогенсинтаза – образует α-1-4-гликозидные связи;
4. Амило-α-1.4-α-1,6-гликозил-транс-фераза, гликоген-ветвящий фермент – переносит фрагмент с минимальной дли-
ной в 6 остатков глюкозы на эту же или соседнюю цепь с образованием α-1-6-гликозидной связи.
Р ЕГУЛЯЦИЯ ОБМЕНА ГЛИКОГЕНА
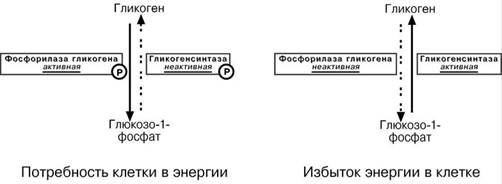
Ферменты метаболизма гликогена активны либо в фосфорилированной, либо в
дефосфорилированной форме: • фосфорилаза глико-гена активируется после присоединения фосфатной группы (см выше),
• синтаза гликогенапосле присоединения фосфата инактиви-
руется.
Таким образом, осуществ-
ляется реципрокная (взаи- моисключающая) регуляция:
• при работе клетки
и/или гормональных
влияниях активирует-
ся протеинкиназа и,
как следствие, акти-
Вируется фосфори-
лаза гликогена и ин-
гибируется гликоген-
синтаза. Идут реак-ции катаболизма глю- козы, и образуется
энергия.
• при отдыхе или в по-
кое работают протеин-фосфатазы, которые освобождают ферменты от фос-
форной кислоты: в результате гликоген-фосфорилаза дефосфорилируется и становится не активной, активируется гликоген-синтаза. Начинается за-пасание глюкозы в виде гликогена.
Г ЛИКОГЕНОВЫЕ БОЛЕЗНИ
Это наследственные заболевания, обусловленные недостаточностью каких-либо
ферментов, отвечающих за метаболизм гликогена. Средняя частота встречаемости составляет 1:40000.
Гликогенозы
Ранее гликогенозы классифицировались по номерам, однако в связи с открытием
новых видов этих болезней появилось много разночтений. В настоящее время глико-
генозы делят по патогенетическому признаку на печеночные, мышечные и сме-шанные формы.Следует отметить,что при гликогенозах количество гликогена не
всегда изменено, изменения могут быть только в структуре его молекулы.
Печеночные гликогенозы
Самый частый гликогеноз I типа или болезнь фон Гирке обусловлен аутосом-
но-рецессивным дефектом глюкозо-6-фосфатазы. Из-за того, что этот фермент есть
только в печени и почках, преимущественно страдают эти органы, и болезнь носит еще одно название – гепаторенальный гликогеноз. Даже у новорожденных детей
наблюдаются гепатомегалия и нефромегалия, обусловленные накоплением гликоге-на не только в цитоплазме, но и в ядрах клеток. Кроме этого, активируется синтез липидов с возникновением стеатоза печени. Так как фермент необходим для де-фосфорилирования глюкозо-6-фосфата с последующим выходом глюкозы в кровь, у больных отмечается гипогликемия, и, как следствие, ацетонемия, метаболический ацидоз, ацетонурия.
Гликогеноз III типа или болезнь Форбса-Кори или лимит-декстриноз –этоаутосомнорецессивный дефект а мило- α -1-6-глюкозидазы, «деветвящего» фермен-та, гидролизующего α-1-6 -гликозидную связь. Болезнь имеет более доброкачествен-ное течение и частота ее составляет примерно 25% от всех гликогенозов. Для боль-ных характерна гепатомегалия, умеренная задержка физического развития, в подро-стковом возрасте возможна небольшая миопатия.
Еще два печеночных гликогеноза – гликогеноз IV типа (болезнь Андерсена),
связанный с дефектом ветвящего фермента и гликогеноз VI типа (болезнь Херса), связанный с дефицитом печеночной фосфорилазы гликогена встречаются довольно редко.
Мышечные гликогенозы
Для этой группы гликогенозов характерны изменения ферментов мышечной тка-
ни. Это приводит к нарушению энергообеспечения мышц при физической нагрузке, болям в мышцах, судорогам. Гликогеноз V типа (болезнь Мак-Ардля) –отсутствие мышечной фосфорила-
зы. При тяжелой мышечной нагрузке возникают судороги, миоглобинурия, хотя лег-кая работа не вызывает каких-либо проблем.
Смешанные гликогенозы
Эти заболевания касаются и печени, и мышц, и других органов.
Гликогеноз II типа (болезнь Помпе) –поражаются все гликогенсодержащие
клетки из-за отсутствия лизосомальной α -1-4-глюкозидазы. Происходит накопле-
ние гликогена в лизосомах и в цитоплазме. Заболевание составляет почти 10% всех гликогенозов и является наиболее злокачественным. Больные умирают в грудном возрасте из-за кардиомегалии и.тяжелой сердечной недостаточности.
Агликогенозы
Агликогенозы – состояния, связанные с отсутствием гликогена.
В качестве примера агликогеноза можно привести наследственный аутосомно-
рецессивный дефицит гликоген-синтазы. Симптомами является резкая гипогликемия натощак, особенно утром, появляется рвота, судороги, потеря сознания. В результа-те гипогликемии наблюдается задержка психомоторного развития, умственная от-сталость. Болезнь несмертельна при адекватном лечении (частое кормление), хотя и опасна.
ГЛИКОЛИЗ
Путь, по которому глюкоза окисляется до пировиноградной кислоты для получе-
ния энергии, называется гликолизом. В зависимости от дальнейшей судьбы пирува-
та различают аэробный и анаэробный гликолиз.
В аэробном процессе пировиноградная кислота превращается в ацетил-S-КоА и
далее сгорает в реакциях тканевого дыхания до СОB2 B и НB2 B О. В анаэробном процессе пировиноградная кислота восстанавливается до молоч-ной кислоты (лактата), поэтому в микробиологии анаэробный гликолиз называют молочнокислым брожением. Лактат является метаболическим тупиком и далее ни во
что не превращается, единственная возмож-ность утилизовать лактат – это окислить его обратно в пируват.
Практически все клетки организма способ-ны к анаэробному гликолизу. Для эритроцитов он является единственным источником энер-
гии. Клетки скелетной мускулатуры за счет бескислородного расщепления глюкозы спо- собны выполнять мощную, быструю, интенсив-
ную работу, как, например, бег на короткие дистанции, напряжение в силовых видах спор- та.
Анаэробный гликолиз локализуется в цито-золе и включает 2 этапа из 11 ферментатив-ных реакций.
Первый этап – подготовительный, здесь происходит
затрата энергии АТФ, активация глюкозы и образование
из нее триозофосфатов.
Первая реакция гликолиза,строго говоря,к гликоли-
зу не относится. Это гексокиназная реакция о которой
ранее уже говорилось ("Метаболизм гликогена"). Ее роль сводится к превращению глюкозы в реакционно способ- ное соединение за счет фосфорилирования 6-го, не
включенного в кольцо, атома углерода.
Для печени характерен изофермент гексокиназы –
глюкокиназа. Низкое сродство этого фермента к глюко-
зе обеспечивает ее захват печенью только после приема пищи, когда создается высокая концентрация глюкозы в крови. При обычных концентрациях глюкозы в крови пе-
чень ее не потребляет и та достается другим тканям. Вторая реакция –реакция изомеризации–необхо- дима для выведения еще одного атома углерода из
кольца для его последующего фосфорилирования. В ней образуется фруктозо-6-фосфат.
фосфата с образованием почти симметричной молекулы фруктозо-1,6-дифосфата. В четвертой реакции фруктозо1,6-дифосфат разре-
зается пополам с образование двух фосфорилирован-ных триоз-изомеров, альдозы глицеральдегида (ГАФ) и кетозы диоксиацетона (ДАФ).
Пятая реакция подготовительного этапа–переходглицеральдегидфосфата и диоксиацетонфосфата друг в друга. Равновесие реакции сдвинуто в пользу диокси-
ацетонфосфата, его доля составляет 97%, доля глице-ральдегидфосфата – 3%. Эта реакция, при всей ее про- стоте, является вершителем судьбы глюкозы:
• при нехватке энергии в клетке и активации окис-
ления глюкозы диоксиацетонфосфат превраща-
ется в глицеральдегидфосфат, который далее окисляется на втором этапе гликолиза;
• при достаточном количестве АТФ, наоборот, глицеральдегидфосфат изомеризуется в диоксиацетонфосфат, и последний
отправляется на синтез жиров (см "Синтез триацилглицеридов").
Второй этап гликолиза – это освобождение
энергии, содержащейся в глицеральдегидфосфате,
и запасание ее в форме АТФ.
Шестая реакция гликолиза–окисление глице-
ральдегидфосфата и присоединение к нему фос-
форной кислоты приводит к образованию макроэр-гического соединения 1.3-дифосфоглицериновой кислоты.
В седьмой реакции энергия фосфоэфирной связи, заключенная в 1,3-дифосфоглицерате тра- тится на образование АТФ. Реакция получила до-
полнительное название –реакция субстратного фосфорилирования, что уточняет источник энергии для получения макроэргической связи в АТФ (суб-
страт) в отличие от окислительного фосфорилиро-вания (электрохимический градиент ионов водоро- да на мембране митохондрий).
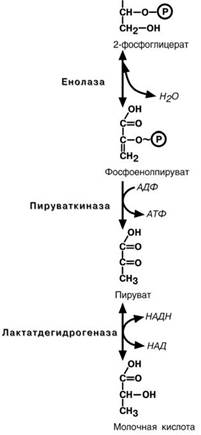
Подобных реакций в клетке всего три – 1) ука-занная реакция, 2) пируваткиназная реакция, деся-тая реакция гликолиза (см ниже), 3) тиокиназная
реакция цикла трикарбоновых кислот.
Восьмая реакция –синтезированный в преды-
дущей реакции 3-фосфоглицерат изомеризуется в
2-фосфоглицерат.
Девятая реакция –отрыв молекулы воды от
2-фосфоглицериновой кислоты приводит к образо-
ванию еще одной макроэргической фосфоэфирной связи. Еще одна реакция субстратного фосфорили-рования – десятая реакция гликолиза–заключа-
ется в переносе макроэргического фосфата с фос-
фоенолпирувата на АДФ.
Последняя реакция, одиннадцатая, образова-ние молочной кислоты из пирувата под действием лактатдегидрогеназы. Важно то, что эта реакция
осуществляется только в анаэробных условиях. Эта реакция необходима клетке, так как НАДН, об- разующийся в 6-й реакции, в отсутствие кислорода не может поступать и окисляться в митохондриях.
При наличии кислорода пировиноградная ки-
слота превращается в ацетил-S-КоА.
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 128; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.229.113 (0.183 с.) |









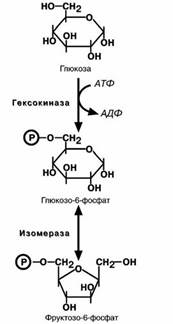
 Третья реакция –фосфорилирование фруктозо-6-
Третья реакция –фосфорилирование фруктозо-6-