Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Посттрансляционная модификация молекул белка. Особенности синтеза коллагена. Гидроксилирование, гликозилирование, ограниченный протеолиз. Другие механизмы посттрансляционных модификаций
Посттрансляционная модификация белков К основным реакциям процессинга относятся: 1. Удаление с N-конца метионина или даже нескольких аминокислот специфичными аминопептидазами. 2. Образование дисульфидных мостиков между остатками цистеина. 3. Частичный протеолиз – удаление части пептидной цепи, как в случае с инсулином или протеолитическими ферментами ЖКТ. 4. Присоединение химической группы к аминокислотным остаткам белковой цепи: - фосфорной кислоты – например, фосфорилирование по аминокислотам Серину, Треонину, Тирозину используется при регуляции активности ферментов или для связывания ионов кальция, - карбоксильной группы – например, при участии витамина К происходит γ-карбоксилирование глутамата в составе протромбина, проконвертина, фактора Стюарта, Кристмаса, что позволяет связывать ионы кальция при инициации свертывания крови, - метильной группы – например, метилирование аргинина и лизина в составе гистонов используется для регуляции активности генома, - гидроксильной группы – например, присоединение ОН-группы к лизину и пролину с образованием гидроксипролина и гидроксилизина необходимо для созревания молекул коллагена при участии витамина С, - йода – например, в тиреоглобулине присоединение йода необходимо для образования предшественников тиреоидных гормонов йодтиронинов, 5. Включение простетической группы: - углеводных остатков – например, гликирование требуется при синтезе гликопротеинов. - гема – например, при синтезе гемоглобина, миоглобина, цитохромов, каталазы, - витаминных коферментов – биотина, ФАД, пиридоксальфосфата и т.п. 6. Объединение протомеров в единый олигомерный белок, например, гемоглобин, коллаген, лактатдегидрогеназа, креатинкиназа. Фолдинг белков Фолдинг – это процесс укладки вытянутой полипептидной цепи в правильную трехмерную пространственную структуру. Для обеспечения фолдинга используется группа вспомогательных белков под названием шапероны (chaperon, франц. – спутник, нянька). Они предотвращают взаимодействие новосинтезированных белков друг с другом, изолируют гидрофобные участки белков от цитоплазмы и "убирают" их внутрь молекулы, правильно располагают белковые домены. В целом шапероны способствуют переходу структуры белков от первичного уровня до третичного и четвертичного.
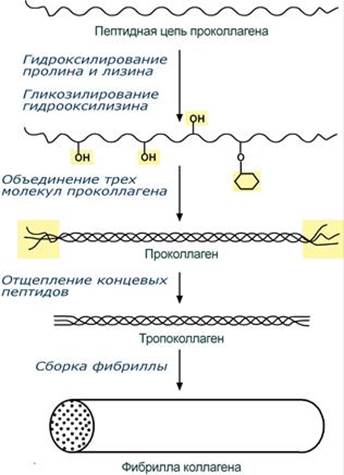
При нарушении функции шаперонов и в отсутствии фолдинга в клетке формируются белковые отложения – развивается амилоидоз. Насчитывают около 15 вариантов амилоидоза. При синтезе коллагена первостепенное значение имеет гидроксилирование лизина и пролина, включенных в состав первичной цепи, осуществляемое при участии аскорбиновой кислоты. Также коллаген обычно содержит моносахаридные (галактоза) и дисахаридные (глюкоза-галактоза) молекулы, связанные с ОН-группами некоторых остатков оксилизина.
Синтезированная молекула коллагена построена из 3 полипептидных цепей, сплетенных между собой в плотный жгут – тропоколлаген (длина 300 нм, диаметр 1,6 нм). Полипептидные цепи прочно связаны между собой через ε-аминогруппы остатков лизина. Тропоколлаген формирует крупные коллагеновые фибриллы диаметром 10-300 нм. Поперечная исчерченность фибриллы обусловлена смещением молекул тропоколлагена друг относительно друга на 1/4 их длины. --- Механизмы регуляции биохимических реакций. Обратимая и необратимая регуляция. Представление о механизме изостерической регуляции. Использование принципов изостерической регуляции в медицинской практике Механизмы регуляции биохимических реакций: 1. Регуляция количества ферментов: индукция/репрессия синтеза (стероидные и тиреоидные гормоны индуцируют синтез ферментов), распад ферментов (скорость разрушения ферментов) 2. Регуляция активности ферментов: А) ингибитор Б) аллостерия и кооперативность В) регуляция активности путем ковалентной модификации структуры ферментов Г) регуляция активности при помощи белков-регуляторов 3. Изменение количества субстрата 4. Наличие изоферментов Ингибиторы бывают обратимыми и необратимыми. Необратимые ингибиторы – химическое соединение, которое ковалентно связывается с группами активного центра фермента (влияния фторурацила на тимидилатсинтазу, тяжелых металлов на тиоловые группы ферментов). Обратимые ингибиторы: 1) Конкурентные (изостерические) – аналоги субстратов по своей структуре, могут взаимодействовать с ферментом, вытесняя субстрат. Снять его действие можно, повышая концентрацию субстрата. 2) Неконкурентные – связываются со специфическими участками фермента вне активного центра, вызывая изменение конформации фермента и затрудняя его связывание с субстратом. Не похожи на субстрат.
Применение ингибиторов в медицинской практике: 1) применение сульфаниламидных препаратов – конкурентных ингибиторов ПАБК 2) обычный спирт в больших дозах играет роль конкурентного ингибитора при отравлениях антифризом (этиленгликолем) 3) аллопуринол – необратимый ингибитор, используемый при лечении подагры 4) эспераль - необратимый ингибитор оксидазы уксусного альдегида используется при лечении алкоголизма (препятствует превращение образующегося альдегида в уксусную кислоту, вызывая тем самым сильное отравление организма) 5) контрикал – необратимый ингибитор протеолитических ферментов поджелудочной железы, применяемый при панкреатите. ---
|
||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 386; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.135.224 (0.008 с.) |