
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Транспортные средства специального назначения»Стр 1 из 18Следующая ⇒
КОНСПЕКТ ЛЕКЦИЙ по дисциплине (модулю) «ТЕРМОДИНАМИКА И ТЕПЛОПЕРЕДАЧА» Специальность Транспортные средства специального назначения» Специализация Наземные транспортные средства и комплексы аэродромно-технического обеспечения полетов авиации Квалификация Инженер Москва 2018 г.
Настоящий конспект лекций по дисциплине (модулю) «Термодинамика и теплопередача» входит в состав методических материалов основной профессиональной образовательной программы по специальности 23.05.02 «Транспортные средства специального назначения» (уровень специалитет) и предназначен для оказания помощи обучающимся в освоении дисциплины (модуля), а также при подготовке к прохождению процедур текущего контроля успеваемости и промежуточной аттестации. Разработчики:
Лекция 1. Термодинамика Термодинамика – наука о взаимном превращении одного вида энергии в другой, происходящем в макросистемах. Техническая термодинамика изучает закономерности взаимного превращения энергий, предаваемых в формах теплоты и работы. Термодинамическая система и рабочее тело. Термодинамическая система (ТС) – совокупность выделенных из окружающей среды (ОС) тел, взаимодействующих между собой и с ОС.
ТС может быть: · изолированной (замкнутой) при dM=0; dQ=0; dL=0; · неизолированной при dM ¹0 или dQ ¹0; dL ¹0; · закрытой при dM=0; · открытой при dM ¹0; Рис 1.1 · термически изолированной (адиабатной) при dQ=0; · термомеханической при dQ ¹0 и dL ¹0. Рабочее тело Работа L совершается рабочим телом (РТ) при его расширении и принимается положительной. При сжатии РТ работа затрачивается и принимается отрицательной. РТ должно обладать свойством значительного изменения объема под воздействием ОС. Таким свойством обладают газы и пары. Во многих случаях РТ можно рассматривать как идеальный газ, строго подчиняющийся газовым законам. Допущения для идеального газа:
· пренебрежимо малый размер молекул по сравнению с межмолекулярным расстоянием, т.е. молекулы считаются материальными точками, имеющими массу и не имеющими объема; · отсутствие сил взаимодействия между молекулами, их взаимодействие ограничивается абсолютно упругим соударением. Величина |
Единица измерения | ||||||||||||||
| Па(Н/м2) | бар | техн. атм. | физ. атм. | мм рт. ст. | мм вод. ст. | |||||||||||
| 1 Па | 1 | 10-5 | 1,02×10-5 | 0,987×10-5 | 7,5×10-3 | 0,102 | ||||||||||
| 1 бар | 105 | 1 | 1,02 | 0,987 | 750 | 1,02×104 | ||||||||||
| 1техн. атм. | 9,81×104 | 0,981 | 1 | 0,968 | 735,6 | 104 | ||||||||||
| 1физ. атм. | 1,013×105 | 1,013 | 1,0332 | 1 | 760 | 1,033×104 | ||||||||||
| 1мм рт. ст. | 133,32 | 133,3×10-5 | 1,36×10-3 | 1,31×10-3 | 1 | 13,6 | ||||||||||
| 1мм вод. ст. | 9,81 | 9,81×10-5 | 10-4 | 0,968×10-4 | 7,356×10-2 | 1 | ||||||||||
Абсолютное давление:
· в атмосфере рабс = рбар; измеряется барометром Bt, мм рт. ст.; показания барометра приводятся к 0°С: B0 = Bt(1- at),
где a – постоянная барометра, учитывающая тепловое расширение ртути и шкалы, a=0,000163-0,000173 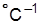 ;
;
· в закрытом сосуде при давлении больше атмосферного
рабс = рбар+ризб; избыточное давление измеряется манометром
ризб = рман;
· в закрытом сосуде при давлении меньше атмосферного
рабс = рбар – рразр; разрежение измеряется вакуумметром, рразр=рвак
Температура Т – параметр, характеризующий среднюю кинетическую энергию теплового движения частиц.
 , где КВ – постоянная Больцмана, КВ » 1,38 ×10-23 Дж/К.
, где КВ – постоянная Больцмана, КВ » 1,38 ×10-23 Дж/К.
Температурные шкалы: Кельвина (кельвин К); Цельсия (° С);
Фаренгейта (° F); Ренкина (° R).
Т К = t °С+273,15; t °С = 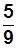 (t0 F-32); T K=1,8 0 R.
(t0 F-32); T K=1,8 0 R.
Удельный объем v, м3/кг – объем единицы массы вещества.
Плотность r, кг/м3 – масса единицы объема;  ,
,
где М – масса, кг; V – объем, м3.
Уравнения состояния системы
Уравнения Клапейрона: для 1 кг pv=RT; (1.1)
для М кг pV=RMT, (1.2)
где R – индивидуальная газовая постоянная, Дж/(кг×К).
Уравнения Клапейрона –Менделеева:
для 1 киломоля pv m = R mT; (1.3)
для N киломолей pV=R mNT, (1.4),
где R m – универсальная газовая постоянная,
R m= КВNА = 8314 Дж/(кмоль × К);
|
|
NА»6,022 ×1026 кмоль-1 – число Авогадро.
Из закона Авогадро:  .
.
С учетом этого 
где po=101325 Па; Тo = 273,15 К – нормальные физические условия (НФУ); 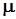 - молярная масса.
- молярная масса.
Из (1.3) при нормальных условиях
R m 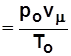
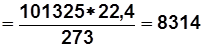 Дж/(кмоль×К).
Дж/(кмоль×К).
Физический смысл R и R m - работа, совершаемая соответственно 1 кг и 1 киломолем газа при нагревании его на 1 К при p=const.
Уравнение связи R и R m: 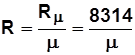 ; (1.5)
; (1.5)
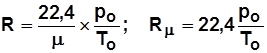 .
.
1.3. Газовые смеси: понятие о газовой смеси; способы задания состава газовых смесей; закон Дальтона; закон Амага; закон сохранения массы и количества вещества; кажущаяся молекулярная масса и газовая постоянная смеси; определение параметров смеси и ее компонентов.
Закон Дальтона. Каждый компонент смеси ведет себя независимо от других, т.е. занимает весь объем, в котором заключена смесь, и оказывает на стенки сосуда свое, так называемое парциальное давление. Температура всех компонентов в равновесном состоянии одинакова и равна температуре смеси.
Давление смеси pсм равно сумме парциальных давлений pi ее компонентов,
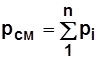 , где n – число компонентов смеси. (1.6)
, где n – число компонентов смеси. (1.6)
Объем, который занимал бы компонент смеси при температуре и давлении смеси, называется парциальным (приведенным) объемом.
Закон Амага: сумма парциальных объемов Vi компонентов равна объему смеси Vсм.
 . (1.7)
. (1.7)
По закону сохранения массы и количества вещества:
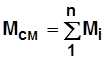 ; (1.8)
; (1.8)
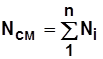 . (1.9)
. (1.9)
Термодинамические функции.
Первый закон термодинамики
Графическое представление термодинамического процесса и его анализ: применение v-p координат для графического анализа совершения или затраты работы в термодинамическом процессе; применение s - T координат для графического анализа подвода или отвода теплоты в термодинамическом процессе.
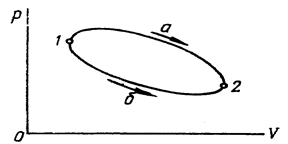
К функциям состояния относятся внутренняя энергия U, Дж; энтальпия Н, Дж; энтропия S, Дж/К. Изменение этих функций не зависит от пути процесса, а определяется лишь начальным и конечным состояниями рабочего тела. В процессах на рис.2.1
 ;
;
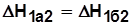 ;
;
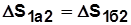 .
.
В круговом процессе 1а2б1:
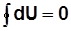 ;
; 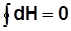 ;
; 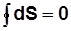 .
.
Рис. 2.1
Внутренняя энергия
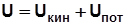 .
.
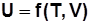 . Для 1 кг
. Для 1 кг 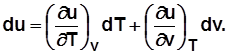
Для идеального газа 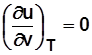 и
и 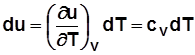 .
.
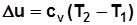 , Дж/кг; (2.1)
, Дж/кг; (2.1)
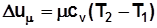 , Дж/кмоль; (2.2)
, Дж/кмоль; (2.2)
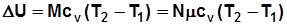 , Дж. (2.3)
, Дж. (2.3)
Здесь и далее в процессах с изменением температуры, в обозначении средних теплоемкостей, пределы изменения температуры для сокращения записи не приводятся.
Для смеси газов 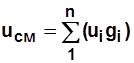 ; (2.4)
; (2.4)
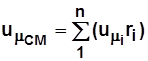 . (2.5)
. (2.5)
Энтальпия
Энтальпия – сумма внутренней энергии и потенциальной энергии давления 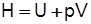 или энергия, затрачиваемая на перевод газа из абсолютного вакуума в данное состояние при р=const,
или энергия, затрачиваемая на перевод газа из абсолютного вакуума в данное состояние при р=const, 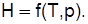
Для 1 кг 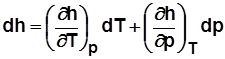 .
.
Для идеального газа 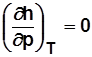 и
и 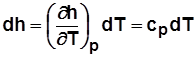 .
.
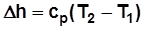 , Дж/кг; (2.6)
, Дж/кг; (2.6)
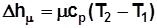 , Дж/кмоль; (2.7)
, Дж/кмоль; (2.7)
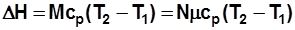 , Дж. (2.8)
, Дж. (2.8)
Для смеси газов 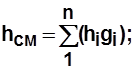 (2.9)
(2.9)
|
|
Энтропия
Энтропия – функция, элементарное изменение которой равно
отношению элементарной подведенной (отведенной) теплоты к абсо-
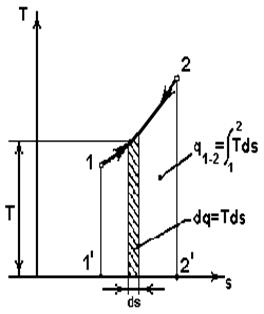 лютной температуре:
лютной температуре: 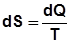 .
.
Для 1кг 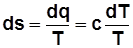 , где с – теплоемкость в данном процессе.
, где с – теплоемкость в данном процессе.
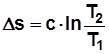 , Дж/(кг K); (2.11)
, Дж/(кг K); (2.11)
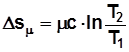 ,Дж/(кмоль К). (2.12)
,Дж/(кмоль К). (2.12)
В координатах sT (рис.2.2.) площадь под линией процесса (пл. 1’122’1’) соответствует подведенной (отведенной) теплоте. Так как всегда 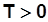 , то:
, то:
при 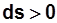
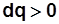 - подвод теплоты,
- подвод теплоты,
при 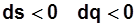 –отвод теплоты.
–отвод теплоты.
Рис.2.2
Функции процесса
Работа L, Дж; располагаемая работа L0, Дж. Значения этих функций зависят как от начального и конечного состояний газа, так и от пути процесса.
Работа
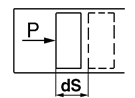
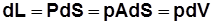 , где Р, р – сила и давление газа; А – площадь поршня; dS – элементарное перемещение (рис. 2.3.).
, где Р, р – сила и давление газа; А – площадь поршня; dS – элементарное перемещение (рис. 2.3.).
Рис. 2.3
Для 1 кг 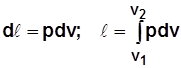 . (2.13)
. (2.13)
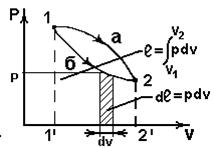 В координатах vp (рис.2.4)
В координатах vp (рис.2.4)
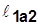 ~пл.1’1a22’1’;
~пл.1’1a22’1’;
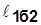 ~пл.1’1б22’1’;
~пл.1’1б22’1’; 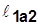 >
> 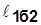 .
.
Работа зависит от пути процесса (работа - функция процесса).
Рис.2.4
Располагаемая работа
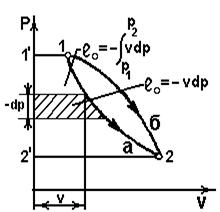 Располагаемая работа – работа изменения давления, т.е. работа, которую может совершить рабочее тело при истечении в окружающую среду под действием разности давлений тела и среды,
Располагаемая работа – работа изменения давления, т.е. работа, которую может совершить рабочее тело при истечении в окружающую среду под действием разности давлений тела и среды, 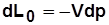 .
.
Для 1 кг 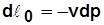 ;
;
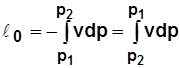 . (2.14)
. (2.14)
В координатах vp (рис.2.5)
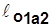 ~пл.1’1a22’1’;
~пл.1’1a22’1’; 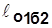 ~пл.1’1б22’1’;
~пл.1’1б22’1’;
Рис.2.5 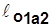 <
< 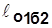 - располагаемая работа зависит от пути процесса (располагаемая работа - функция процесса).
- располагаемая работа зависит от пути процесса (располагаемая работа - функция процесса).
1) 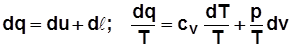 . С учетом
. С учетом 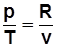 получим
получим
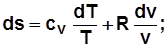
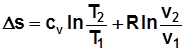 ; (2.18)
; (2.18)
2) 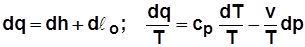 . С учетом
. С учетом 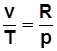 получим
получим
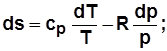
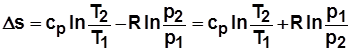 ; (2.19)
; (2.19)
3) 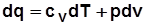 . Дифференцируя выражение
. Дифференцируя выражение 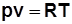 , получим
, получим 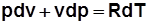 , отсюда
, отсюда 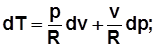
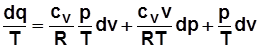 ;
;
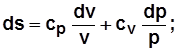
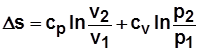 . (2.20)
. (2.20)
Первый закон термодинамики
Первый законтермодинамики - частный случай всеобщего закона сохранения энергии, который гласит: энергия не исчезает и не создается вновь, она может лишь переходить от одного тела к другому или превращаться из одного вида в другой в равных количествах.
В термомеханической системе теплота превращается в работу, а работа - в теплоту в равных количествах.
В замкнутой системе, состоящей из теплового аккумулятора с запасом энергии Q, рабочего тела с внутренней энергией U, механического аккумулятора с запасом энергии L,
dQ+ dU+ dL=0,
т.е. алгебраическая сумма изменения энергии элементов системы равна нулю.
Если dQ – теплота, подводимая к рабочему телу, то
dQ= dU+ dL. (2.15)
Для 1 кг 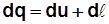 (математическое выражение первого закона термодинамики, первая форма).
(математическое выражение первого закона термодинамики, первая форма).
|
|
В конечных разностях: 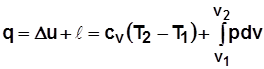 . (2.16)
. (2.16)
Формулировки первого закона термодинамики.
· Теплота, подводимая к рабочему телу, затрачивается на изменение его внутренней энергии и совершение им работы.
· Невозможно в каком-либо механизме периодически получать работу без подвода энергии извне.
· Вечный двигатель (perpetuum mobile) первого рода невозможен.
Вечный двигатель первого рода – гипотетический двигатель, способный производить работу, не получая энергию извне.
Вторая форма математического выражения первого закона термодинамики:
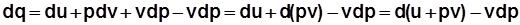 ;
;
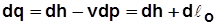 ; (2.17)
; (2.17)
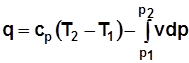 . (2.17а)
. (2.17а)
· Теплота, подведенная к рабочему телу, затрачивается на увеличение его энтальпии и располагаемой работы.
Термодинамические процессы
С идеальным газом
Уравнения процессов
Политропный процесс:
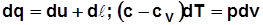 ; с учетом
; с учетом 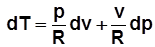
 ;
;
 ;
;
 ;
;
 ;
;
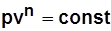 - уравнение процесса; (3.1)
- уравнение процесса; (3.1)
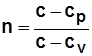 - показатель политропы; (3.2)
- показатель политропы; (3.2)
 - теплоемкость политропного процесса. (3.3)
- теплоемкость политропного процесса. (3.3)
Частные случаи политропного процесса: изохорный, изобарный, изотермический, адиабатный процессы (уравнения процессов, формулы соотношения между параметрами, изменение энергетических составляющих, перераспределение энергии в процессах).
Изохорный процесс:
уравнение процесса 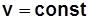 получается из уравнения политропного процесса
получается из уравнения политропного процесса 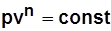 или
или  при n= ± ¥;
при n= ± ¥;
теплоемкость процесса 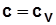 .
.
Изобарный процесс:
уравнение процесса  получается из уравнения
получается из уравнения 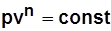 при n=0; теплоемкость процесса
при n=0; теплоемкость процесса  .
.
Изотермический процесс:
уравнение процесса  или
или  получается из уравнения
получается из уравнения 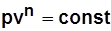 при n=1; теплоемкость процесса
при n=1; теплоемкость процесса  .
.
Адиабатный процесс:
уравнение процесса получается из уравнения первого закона термодинамики при dq=0:
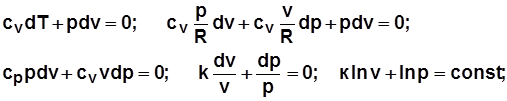
уравнение процесса 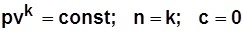 .
.
Процессы
ФУНКЦИИ
 ,
Дж/кг
,
Дж/кг
 , Дж/кг
, Дж/кг
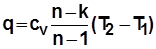
 ;
;  ;
; 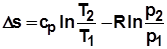 ;
; 
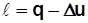 ;
;

 ;
;
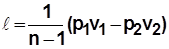 ;
;
 ;
;
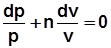 ;
;
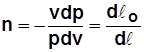 ;
;
 ;
;
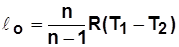 ;
; 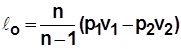

 ;
;

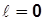
 ;
;

Второй закон термодинамики
4.1. Понятие о термодинамическом цикле. Условия преобразования тепловой энергии в механическую работу. Прямой термодинамический цикл, его среднее давление и КПД. Обратный цикл, его холодильный и отопительный коэффициенты.
Второй закон термодинамики связан с необратимостью (односторонней направленностью) всех естественных процессов. По Больцману: природа стремится к переходу от менее вероятных состояний к более вероятным.
Наиболее вероятное состояние термодинамической системы – состояние внутреннего равновесия.
В технической термодинамике второй закон определяет условия превращения теплоты в работу.
Работа, как показывает опыт, превращается в теплоту непосредственно и полностью.
 Теплота превращается в работу посредством рабочего тела (газ, пар) лишь частично и при определенных условиях.
Теплота превращается в работу посредством рабочего тела (газ, пар) лишь частично и при определенных условиях.
|
|
Рассмотрим прямой и обратный обратимые изотермические процессы при наличии одного источника теплоты (рис.7.1):
12 – прямой процесс расширения с подводом теплоты q от источника с запасом энергии Q;  ~пл.1’122’1’;
~пл.1’122’1’;
21 – обратный процесс сжатия с отводом теплоты q в источник внешней энергии;
Рис.4.1 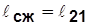 ~пл. 2’211’2’;
~пл. 2’211’2’;
 ;
; 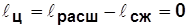 .
.
Для получения избыточной работы процесс сжатия должен проходить при меньшей температуре, т.е. необходимо иметь, по крайней мере, два источника теплоты («горячий» и «холодный»).
Круговой процесс (цикл)
Цикл – совокупность процессов, в результате осуществления которых рабочее тело возвращается в исходное состояние.
Прямой цикл – цикл, в котором теплота превращается в работу (линия расширения проходит выше линии сжатия).
Обратный цикл – цикл, в котором теплота от “холодного” источника передается “горячему” источнику при затрате работы (линия сжатия проходит выше линии расширения).
Прямой цикл
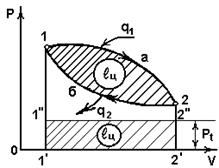 В прямом цикле (рис.4.2):
В прямом цикле (рис.4.2):
1а2 – процесс расширения с подводом теплоты q1 от «горячего» источника;
 ~ пл.1’1а22’1’;
~ пл.1’1а22’1’;
2б1 – процесс сжатия с отводом теплоты q2 в «холодный» источник; 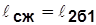 ~ пл. Рис. 4.2 2’2б11’2’;
~ пл. Рис. 4.2 2’2б11’2’;
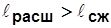 ;
; 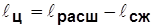 ~ пл. 1a2б1.
~ пл. 1a2б1.
Термический к.п.д. цикла  . (4.1)
. (4.1)
Среднее давление цикла 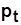 - условное постоянное давление, при котором совершается работа, равная работе за цикл при переменном давлении; по физическому смыслу
- условное постоянное давление, при котором совершается работа, равная работе за цикл при переменном давлении; по физическому смыслу 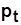 - работа, приходящаяся на единицу рабочего объема,
- работа, приходящаяся на единицу рабочего объема, 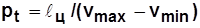 . (4.2)
. (4.2)
В vp – координатах (рис.4.2) пл. 1’1”2”2’1’=пл. 1a2б1.
Обратный цикл
 В обратном цикле (рис.4.3):
В обратном цикле (рис.4.3):
1a2 – процесс расширения с подводом теплоты q2 от «холодного» источника; 2б1 – процесс сжатия с отводом теплоты q1 в «горячий» источник; площадь 1a2б1 пропорциональна затрате работы (– 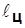 ).
).
Рис.4.3
Обратный цикл в холодильных установках оценивается
холодильным коэффициентом 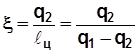 , (4.3)
, (4.3)
в тепловых насосах –
отопительным коэффициентом  . (4.4)
. (4.4)
Второй закон термодинамики: приведенная теплота; интеграл Клаузиуса; изменение приведенной теплоты и энтропии в обратимых и необратимых процессах и циклах; изменение энтропии как мера необратимости и потери работоспособности рабочего тела; формулировки второго закона термодинамики.
· Невозможно превратить в работу энергию какого-либо тела, не производя никакого другого действия, кроме охлаждения этого тела (Томсон, он же Кельвин).
· Перпетуум мобиле (вечный двигатель) второго рода невозможен (Оствальд). Перпетуум мобиле второго рода – воображаемый тепловой двигатель, в котором возможно стопроцентное превращение подведенной теплоты в работу.
· Теплота не может переходить от холодного к теплому телу сама собой, даровым процессом (Клаузиус).
Поршневые компрессоры
Поршневые компрессоры: работа одноступенчатого компрессора; параметры сжатия газа; затраты энергии на привод компрессора; многоступенчатое сжатие с промежуточным охлаждением газа; работа реального компрессора.
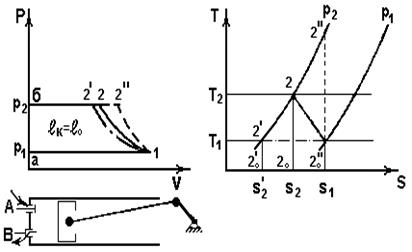 Процессы, протекающие в поршневом компрессоре, представлены на рис. 5.1.
Процессы, протекающие в поршневом компрессоре, представлены на рис. 5.1.
На vp – диаграмме
а1 – процесс заполне-ния цилиндра рабочим телом
(p,T,r = сonst; M=var).
Рис. 5.1
Кривые 12,12’,12’’ – соответственно политропный, изотермический, адиабатный процессы сжатия (см. также диаграмму sT);
в реальных компрессорах n=1,2-1,25;
2б– вытеснение сжатого газа из цилиндра (p,T,r = const; M=var).
Работа на привод компрессора
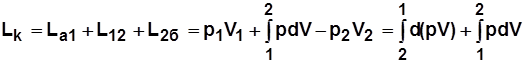 ;
;
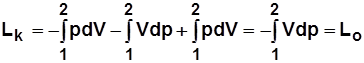 ~ пл. а12ба.
~ пл. а12ба.
Для 1 кг  .
.
При изотермическом процессе сжатия
 , (5.1)
, (5.1)
где l - степень повышения давления, 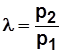 .
.
При политропном процессе сжатия
 . (5.2)
. (5.2)
 ; (5.3)
; (5.3)
Из sT – диаграммы
 ; (5.4)
; (5.4)
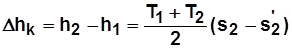 ;
;
 . (5.5)
. (5.5)
При адиабатном процессе сжатия
 ; (5.6)
; (5.6)
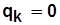 .
.
Многоступенчатый идеальный компрессор
Применяется при р2>0,8 МПа. Процессы в двухступенчатом компрессоре показаны на рис.5.2.
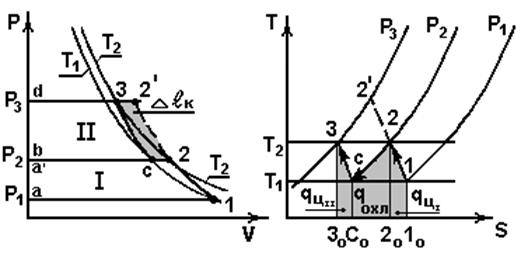
Рис. 5.2
Процессы
а1 – заполнение первой ступени рабочим телом;
12 – политропное сжатие в первой ступени;
2b – вытеснение сжатого газа из первой ступени;
bа ' (соответствует процессу 2с) – изобарное охлаждение газа
в охладителе до Т1;
а ' с – заполнение второй ступени;
с3 – политропное сжатие во второй ступени;
3d – вытеснение сжатого газа из второй ступени;
12 ' – политропное сжатие в одноступенчатом компрессоре.
В vP – координатах: В sT – координатах:
Пл. а12с3dа ~  . Пл. 10122010 ~
. Пл. 10122010 ~ 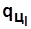 .
.
Пл. а122’dа ~  при одноступенчатом Пл. 202сс020 ~
при одноступенчатом Пл. 202сс020 ~  .
.
сжатии.
Пл. c22’3c ~  - уменьшение
- уменьшение  . Пл. с0с330с0 ~
. Пл. с0с330с0 ~ 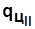 .
.
При 2- ступенчатом сжатии Т3 < Т2’.
Обычно 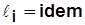 и
и  ;
; 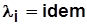 и
и 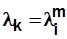 ,
,
где i – номер ступени; m – количество ступеней.
Для двухступенчатого компрессора  ;
;
при 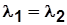 и
и  получим
получим  и
и  . (5.7)
. (5.7)
Для m – ступенчатого компрессора  . (5.8)
. (5.8)
При одинаковой Т на входе в ступени  ,
,
где 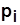 - давление в начале сжатия в i - й ступени,
- давление в начале сжатия в i - й ступени,  .
.
Рабочий объем i - й ступени  . (5.9)
. (5.9)
Реальный компрессор
 В отличие от идеального реальный компрессор имеет вредный объем, давление при наполнении и нагнетании не остается постоянным. Цикл реального компрессора показан на рис. 5.3:
В отличие от идеального реальный компрессор имеет вредный объем, давление при наполнении и нагнетании не остается постоянным. Цикл реального компрессора показан на рис. 5.3:
НМТ – нижняя мертвая точка;
ВМТ – верхняя мертвая точка;
Vh – рабочий объем;
Vвр– вредный объем;  =(0,04-0,10)
=(0,04-0,10) 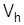 ;
;
а – относительный вредный объем;
 ; (5.10)
; (5.10)
 - объемный к.п.д;
- объемный к.п.д;
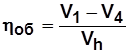 . (5.11)
. (5.11)
Рис.5.3
В vp – координатах:
12 – политропное сжатие газа; n = 1,2…1,25 (при воздушном охлаждении до 1,35);
23 – вытеснение газа из цилиндра;
34 – расширение газа, оставшегося во вредном объеме;
41 – наполнение цилиндра новым зарядом.
При одинаковых показателях политропы n процессов сжатия и расширения 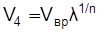 . С учетом этого после преобразования выражения (5.11) получим
. С учетом этого после преобразования выражения (5.11) получим 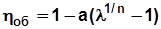 . (5.12)
. (5.12)
Цикловая подача газа, кг/цикл:
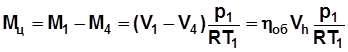 . (5.13)
. (5.13)
Производительность компрессора:
· объемная, м3/ч:  , (5.14)
, (5.14)
где i – число цилиндров; n – частота вращения вала, мин-1; Vh в дм3;
· массовая, кг/ч: 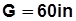 Мц. (5.15)
Мц. (5.15)
Реальные газы. Водяные пары
Водяной пар: понятие о водяном паре; процессы производства водяного пара; функции состояния жидкости и пара, их графическое описание в s-T и s-h координатах, термодинамические процессы с водяным паром.
 На vp-диаграмме (рис.4.3):
На vp-диаграмме (рис.4.3):
точка а – жидкость при 0 ° C;
ab – процесс нагревания жидкости при p=const до температуры кипения (сопровождается испарением – парообразованием с поверхности); точка b – начало кипения; bc – изобарно-изотермический процесс па-рообразования с потреблением теплоты при кипении (паро- Рис. 8.3 образование во всем объеме). В каждой точке динамическое равновесие – парообразование компенсируется конденсацией (конденсация – процесс превращения пара в жидкость с выделением теплоты). Состояние пара – влажный насыщенный пар (ВНП) при давлении насыщения p s и температуре насыщения Ts.
ВНП – механическая смесь образовавшегося сухого насыщенного пара (СНП) с жидкой фазой. x – степень сухости – отношение массы СНП к массе ВНП; 0  x
x  1 (x=0 – начало кипения, x=1 – только СНП);
1 (x=0 – начало кипения, x=1 – только СНП);
(1-x) – степень влажности – отношение массы жидкой фазы к массе ВНП;
r, Дж/кг - скрытая теплота парообразования – количество теплоты, необходимое для полного превращения 1 кг кипящей жидкости в СНП. 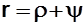 , где r - внутренняя теплота парообразования (изменение внутренней потенциальной энергии); y - внешняя теплота парообразования (работа расширения ВНП), y ~ пл. bobccobo (см. рис 8.3);
, где r - внутренняя теплота парообразования (изменение внутренней потенциальной энергии); y - внешняя теплота парообразования (работа расширения ВНП), y ~ пл. bobccobo (см. рис 8.3);
точка c – СНП; cd – изобарный перегрев пара (степень перегрева–
разность температур перегретого пара (ПП) и СНП при p=const), т.е.
( ); cd ¢ - изотермический перегрев пара (степень перегрева (
); cd ¢ - изотермический перегрев пара (степень перегрева (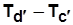 ).
).
Обозначения параметров и функций жидкости и пара:
жидкость при 0°C:  ,
, 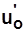 ,
, 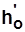 ,
, 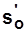 .
.
жидкость в начале кипения:  ,
,  ,
, 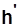 ,
, 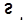 .
.
ВНП: 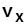 ,
,  ,
,  ,
,  .
.
СНП:  ,
,  ,
,  ,
, 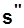 .
.
ПП:  ,
,  ,
,  ,
,  .
.
При увеличении  возрастают
возрастают 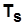 и незначительно
и незначительно  и уменьшаются
и уменьшаются 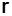 и
и 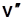 .
.
Линия To=const – жидкость при 0°C.
Линия x=0 –нижняя пограничная кривая (НПК), соответствует состоянию жидкости в начале кипения.
Линия x=1 – верхняя пограничная кривая (ВПК) – СНП.
На пересечении линий To=const и x=0 (НПК) находится тройная точка (А) воды, обозначающая трехфазное состояние (твердое – лед, жидкое, парообразное).
Параметры точки А: p=610 Па; t=0°C; v=0,001м3/кг.
На пересечении линий НПК и ВПК находится точка k – критическая точка, в которой исчезает различие между жидкой и газовой фазами. В точке k теплота парообразования r =0.
Параметры в точке k: pк=22,06 МПа; Tk=374,1 °C; vк=0,00306 м3/кг.
ST - и sh - диаграммы
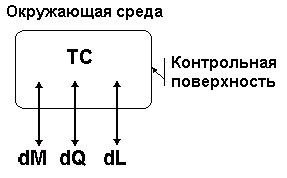 ТС отделяется от ОС реальной или мнимой границей - контрольной поверхностью (рис.1.1). ТС может обмениваться с ОС массой М, энергией, передаваемой в форме теплоты Q и в форме работы L.
ТС отделяется от ОС реальной или мнимой границей - контрольной поверхностью (рис.1.1). ТС может обмениваться с ОС массой М, энергией, передаваемой в форме теплоты Q и в форме работы L.


