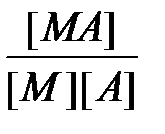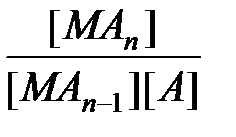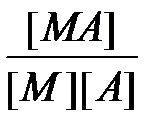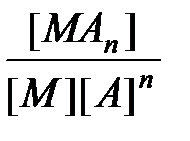Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические равновесия в растворах электролитовСтр 1 из 4Следующая ⇒
Лабораторная работа № 4 Опыт 1. Равновесие диссоциации воды. Водородный показатель Диссоциация молекул воды приводит к тому, что в любом водном растворе – кислом, нейтральном или щелочном, есть как ионы водорода, так и гидроксид-ионы. Их концентрацию можно рассчитать, используя ионное произведение воды. Для характеристики содержания ионов водорода в растворе используется водородный показатель – рН, значение которого можно определить как с помощью приборов (точно) (рН-метры, иономеры), так и с помощью индикаторов. Для определения рН с помощью рН-метра, ознакомьтесь с устройством и порядком работы с ним. Следует учесть, что для определения рН раствора с помощью иономера, требуется 30-50 мл раствора, поэтому для приготовления растворов их количества, указанные в опытах, кратно увеличивайте. Также помните, что после каждого определения рН данного раствора электроды ополаскивают дистиллированной водой и просушивают фильтровальной бумагой. Для определения рН с помощью универсального индикатора необходимо каплю испытуемого раствора нанести с помощью стеклянной палочки или пипетки на полоску индикаторной бумажки (нельзя вносить индикаторную бумажку в раствор!). Окраску индикаторной бумажки сразу сравнивают с цветной шкалой, имеющейся на упаковке индикаторной бумаги. В три пробирки налейте примерно по 2 мл дистиллированной воды. Добавьте в одну из пробирок 1 каплю 0.1М раствора HCl, в другую 1 каплю 0.1М раствора едкого натра. Измерьте рН жидкостей в каждой пробирке с помощью рН-метра и универсальной индикаторной бумаги. а) Напишите уравнение диссоциации воды в упрощенном виде и в более точном, с учетом образования иона гидроксония, выражение для ионного произведения воды, его значение, теоретические значения концентраций ионов и значение рН в чистой воде, сравните с экспериментально найденным. Чем можно объяснить отличие (если оно есть) данных эксперимента и теории? б) Напишите уравнения диссоциации HCl и NaOH. Используя экспериментально найденные значения рН, рассчитайте концентрации ионов водорода и гидроксид-ионов в каждом растворе. Как влияет добавка этих веществ на степень диссоциации воды? Опыт 2. Равновесие диссоциации слабых электролитов. Степень диссоциации и влияние одноименного иона
Налейте в пробирку примерно 2 мл 0.1М раствора уксусной кислоты, измерьте рН этого раствора с помощью рН-метра и индикаторной бумагой. С помощью шпателя добавьте в пробирку примерно 0.3-0.5 г ацетата натрия, перемешайте до растворения и снова измерьте рН. Повторите опыт, используя 0.1М раствор аммиака и кристаллический хлорид аммония, запишите найденные значения рН. а) Напишите уравнения обратимых реакций, идущих в растворах уксусной кислоты и аммиака, выражения констант равновесия для этих реакций и их значения (из справочника). Используя найденные значения рН, рассчитайте концентрации ионов водорода и гидроксид-ионов в каждом растворе. Рассчитайте степени диссоциации уксусной кислоты и раствора аммиака по этим экспериментальным данным. б) Повторите свои расчеты по значениям рН, найденным после добавления солей. Как влияет добавка солей, содержащих одноименные ионы, на степень диссоциации слабых электролитов? Опыт 3. Буферные растворы а) Смешением равных объемов 0,2М растворов уксусной кислоты и ацетата натрия приготовить 5-8 мл ацетатного буферного раствора и измерить его рН. Напишите уравнения диссоциации веществ в буферном растворе. Какие частицы преобладают в растворе? Используя найденные значения рН определите концентрацию ионов водорода в этом растворе. б) В две пробирки налить по 1-2 мл приготовленного ацетатного буферного раствора. В одну из них добавить одну(!) каплю 0.1М HCl, в другую – одну каплю 0.1М раствора NaOH. Определить рН полученных растворов. Сравните величину изменения рН (ΔрН) после добавления кислоты и щелочи в этом опыте и в опыте 1. Объясните различие, используя принцип Ле-Шателье. в) в) В стаканчик налить несколько капель ацетатного буферного раствора и добавить стократное количество дистиллированной воды. Измерить рН полученного раствора. Как должно было измениться значение рН при стократном разбавлении раствора соляной кислоты? Как изменилось оно при разбавлении буферного раствора? Чем объясняются буферные свойства буферных растворов? Лабораторная работа № 5 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
Степень окисления. Окислители и восстановители Окислительно-восстановительными называются реакции, сопровождающиеся изменением степеней окисления атомов, входящих в состав реагирующих веществ. Степень окисления — это условный заряд атома в соединении, вычисленный из предположения, что все связи в соединении являются чисто ионными, а само соединение состоит из ионов. Поскольку чисто ионных связей не существует, действительные (эффективные) заряды атомов в соединениях часто сильно отличаются по числовым значениям от степеней окисления. Однако понятие «степень окисления» очень полезно для классификации веществ и нахождения стехиометрических коэффициентов уравнений химических реакций. Если в результате реакции степень окисления атома увеличивается, то говорят, что он окисляется. Примерами окисления служат процессы: Fe2+ - 2I- - 2 Mn2+ +4H2O - 5 Из них видно, что окисление связано с отщеплением — потерей — электронов. Если же в результате реакции степень окисления атома уменьшается, то говорят, что он восстанавливается. В качестве примеров восстановления могут служить процессы, обратные записанным выше: Fe3+ + I2 + 2 MnO4- + 8H+ + 5 Из них видно, что восстановление связано с присоединением электронов восстанавливающимся атомом. Окисление — это отдача электронов, восстановление — присоединение электронов. Атом, молекула или ион, принимающие электроны, называются окислителями. Атом, молекула или ион, отдающие электроны, называются восстановителями. Понятие «окислитель» и «восстановитель» часто используют как совершенно однозначные характеристики окислительно-восстановительных свойств соединений. В действительности эти понятия относительны. Так, например, молекулярный водород в огромном числе реакций используется как восстановитель. К числу таких реакций относятся: CuO + H2 CH3COН + H2 Но в реакциях образования гидридов щелочных и щелочноземельных металлов тот же водород играет роль окислителя: 2Na + H2 ® 2NaH Целесообразно запомнить важнейшие окислители и восстановители. К важнейшим окислителям относятся: 1) свободные неметаллы (галогены, кислород, сера), которые в результате реакций превращаются в одноатомные анионы; 2) кислородсодержащие ионы и молекулы, в которых центральный атом имеет высшую или высокую степень окисления (MnO4-, Cr2O72-, CrO42-, NO3-, ClO3-); 3) одноатомные катионы, в которых элементы проявляют свою высшую степень окисления (Ce4+, Fe3+, Ag+, H+). Важнейшими восстановителями являются: 1. свободные металлы, а из неметаллов – углерод и водород; 2. многоатомные ионы и молекулы, в которых центральный атом имеет низшую или низкую степень окисления (H2S, NH3, SO32-, NO2-, CrO2-); 3. одноатомные ионы, в которых элементы проявляют низшую или низкую степень окисления (I-, S2-, Sn2+, Fe2+). Таким образом, вещества, содержащие атомы в высших степенях окисления, могут быть только окислителями, т.е. только принимать электроны. Вещества, содержащие атомы в низших степенях окисления, могут быть только восстановителями, т.е. только отдавать электроны. Вещества, содержащие атомы в промежуточных степенях окисления, могут быть как окислителями, так и восстановителями.
Составление уравнений окислительно-восстановительных реакций Для реакций, не связанных с изменением степеней окисления элементов, характерны небольшие стехиометрические коэффициенты, нахождение которых обычно не вызывает трудностей. Напротив, реакции окисления-восстановления часто имеют сложную стехиометрию. Примером может служить окисление минерала пирита FeS2 кислородом: 4FeS2 + 11O2 = 2Fe2O3 + 8 SO2 Поэтому нахождение стехиометрических коэффициентов реакций окисления-восстановления часто оказывается непростой задачей, которую решают с применением специально разработанных приемов. Рассмотрим метод полуреакций, обычно применяемый к реакциям в водных растворах. Ключевая задача этого метода — составление уравнений полуреакций. При использовании этого метода каждая окислительно-восстановительная реакция представляется как алгебраическая сумма двух полуреакций: полуреакции восстановления окислителя и полуреакции окисления восстановителя. Составляя уравнения полуреакций, используют те же правила, что и при составлении обычных ионных реакций в растворах: для неэлектролитов и слабых электролитов записывают формулы их молекул, а для сильных электролитов — формулы только тех ионов, в состав которых входят атомы элементов, изменяющих в результате реакции степени окисления. От обычных ионных уравнений уравнения полуреакций отличаются наличием в них символов электронов. Уравнения многих полуреакций очень просты. В них присутствуют всего три вида частиц: электроны и две формы соединений одного и того же элемента: Cu2+ + Br2 + 2 MnO4- + Одна из них — окисленная форма — содержит атомы элемента в более высокой степени окисления. В приведенных примерах окисленными формами являются Си2+, Вг2 и MnO4-. Другая — восстановленная форма — содержит атомы этого же элемента в более низкой степени окисления. В приведенных примерах восстановленные формы — это Си+, Вг- и MnO42-. Немного сложнее уравнения полуреакции типа: PbSO4 + 2 [Cu(NH3)4]2+ + 2 В этих полуреакциях наряду с атомами элементов, изменяющих степени окисления, присутствуют сульфат-ионы SO42- и молекулы NH3, все атомы которых сохраняют постоянные степени окисления, а сами эти ионы и молекулы имеют одинаковый состав в левой и правой частях уравнения.
Сложнее других полуреакции с участием кислородсодержащих анионов (оксоанионов) типа NO3-, MnO4-, Cr2O72-. В результате восстановления оксоанионы могут терять все входящие в их состав атомы кислорода или часть этих атомов. Например, перманганат-ион в результате восстановления в кислой среде превращается в катион Mn2+, теряя четыре атома кислорода. При восстановлении перманганат-иона в нейтральной и слабощелочной среде образуется оксид марганца (IV) MnO2, в ходе этой реакции MnO4- отдает два атома кислорода. Составляя полуреакции восстановления оксоанионов, принимают, что атомы кислорода в оксоанионах имеют формальную степень окисления -2, хотя даже в ионных кристаллах оксидов щелочных и щелочноземельных металлов действительный заряд оксид-анионов O2- не достигает этого значения. В соответствии со степенью окисления -2 предполагают, что атомы кислорода, отщепляющиеся от оксоанионов, реагируют с водой так же, как оксид-анионы, попадающие в раствор при разрушении кристаллических решеток ионных оксидов: Na2O + H2O ® 2Na+ + 2OH- т.е. предполагают, что при взаимодействии одного иона O2-с молекулой воды образуются два иона ОН-: O2- + H2O ® 2OH- В соответствии с этим предположением полуреакцию восстановления перманганат-иона в нейтральной среде можно записать так: MnO4- + 2H2O + 3 При разрушении оксоанионов в кислой среде, где имеется избыток катионов Н+, образуются не гидроксид-ионы, а молекулы воды: MnO4- + 8Н+ + 5 Для связывания одного атома кислорода в степени окисления -2 при этом расходуются два катиона Н+. Полуреакции, составленные с использованием описанных приемов, приведены в справочниках, где они записаны как полуреакции восстановления, т.е. в левой части уравнения — окисленная форма, а в правой — восстановленная. Это сделано для того, чтобы не повторять в таблицах одну полуреакцию дважды, сначала как полуреакцию окисления, а затем как полуреакцию восстановления. Как же, используя полуреакции, составить уравнение реакции окисления — восстановления? Рассмотрим процесс составления уравнения на примере реакции между перманганатом калия КMnO4 и сульфитом натрия Na2SO3 в присутствии H2SO4. Прежде чем приступить к составлению уравнений, следует определить, какую роль играют каждая молекула и ион в данной реакции, т.е. назвать окислитель и восстановитель, а также те молекулы и ионы, атомы которых не изменяют степеней окисления. Если хотя бы одно из веществ, участвующих в реакции, содержит атом в высшей или низшей возможной для данного элемента степени окисления, то предсказать роль этого вещества можно, пользуясь перечнем, приведенным выше. Если оба вещества, участвующих в реакции, содержат атомы в промежуточных степенях окисления, то определить, какое из веществ будет окислителем, а какое — восстановителем, можно с помощью стандартных окислительно-восстановительных потенциалов.
В рассматриваемом примере перманганат калия содержит марганец в высшей степени окисления +7, и поэтому он может играть только роль окислителя. Сульфит натрия содержит серу в промежуточной степени окисления +4 и может быть и окислителем, и восстановителем. В данном случае в присутствии сильного окислителя — перманганата калия — сульфит натрия является восстановителем. Разбавленная серная кислота окислительно-восстановительными свойствами не обладает. Она играет роль источника ионов водорода, т. е. обеспечивает кислую реакцию среды. После этого следует составить или найти в справочнике нужные уравнения полуреакций, а затем получить их алгебраическую сумму. Для этого обе полуреакции нужно записать одну под другой. Причем ту полуреакцию, которая описывает восстановление окислителя, следует привести в табличной форме, а вторую полуреакцию нужно преобразовать: перенести все члены уравнения из левой части в правую и наоборот так, чтобы она превратилась в полуреакцию окисления восстановителя. Перед сложением надо все члены уравнения первой полуреакции умножить на число электронов, отдаваемых восстановителем во второй полуреакции, а все члены второй полуреакции следует умножить на число электронов, присоединяемых окислителем в первой полуреакции. После этого все члены левых и правых частей уравнения полуреакций суммируются. Таким образом, получается уравнение реакции окисления — восстановления в сокращенной ионной форме. Для рассматриваемой реакции окисления сульфита натрия перманганатом калия в кислой среде уравнение полуреакции восстановления MnO4- и уравнение полуреакции окисления SO32- запишутся следующим образом: MnO4- + 8H+ + 5 SO32- + H2O - 2 2MnO4- + 16H+ + 5SO32- + 5H2O Û 2Mn2+ + 8H2O + 5SO42- +10H+ Справа от вертикальной черты записываем множители — числа электронов. После приведения однородных членов уравнения (катионы H+, молекулы H2O) получаем сокращенное ионное уравнение реакции окисления сульфита натрия перманганатом калия в кислой среде: 2MnO4- + 6H+ + 5SO32- Û 2Mn2+ + 3H2O + 5SO42- Для получения молекулярной формы уравнения каждому иону добавляем определенное число противоионов, необходимое для полной нейтрализации заряда иона. Объединяя ионы в формулы молекул, получаем уравнение в молекулярной форме: 2KMnO4+5Na2SO3+3H2SO4Û 2MnSO4+3H2O+5Na2SO42-+K2SO4 Экспериментальная часть Лабораторная работа № 6 КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
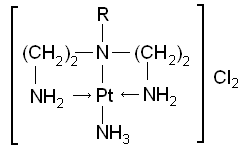
Основные положения Комплексными соединениями называются определенные химические соединения, образованные сочетанием отдельных компонентов и представляющие собой сложные ионы или молекулы, способные к существованию как в кристаллическом, так и в растворенном состоянии. Комплексные соединения содержат катионный, анионный или нейтральный комплекс, состоящий из центрального атома или иона и связанных с ним молекул или ионов - лигандов. Центральный атом (комплексообразователь) - обычно акцептор, а лиганды - доноры электронов и при образовании комплекса между ними возникает донорно-акцепторная, или координационная связь. Комплекс может быть электронейтральным (неэлектролит), иметь положительный заряд (комплексный катион) или отрицательный (комплексный анион). В случае образования комплексного соединения с одноименными лигандами все связи в комплексе равноценны, если он находится в растворе или в газовой фазе, а в случае разнородных лигандов характер связи зависит от их свойств. Число атомов лигандов, координированных центральным атомом, - координационное число (к.ч.) - обычно превышает его степень окисления. Лиганды, связанные с центральным атомом, образуют внутреннюю координационную сферу комплексного соединения. Анионы или катионы (противоионы), входящие вместе с комплексом в состав комплексного соединения, образуют вторую (внешнюю) сферу. В зависимости от числа донорных атомов лиганда, способных к координации, различают моно-, би- и полидентатные лиганды. Лиганды, координирующиеся через два и более донорных атомов к одному центральному атому, называются хелатными, а координирующиеся к разным центральным ионам - мостиковыми. Комплексы, в которых лиганды связывают два или более центральных ионов, называются би- или полиядерными. Полиядерные комплексы, имеющие химические связи между центральными атомами, называются кластерами. Комплексные соединения, содержащие циклические комплексы металлов с полидентатными лигандами, в которых центральный атом входит в один или несколько циклов, называются хелатами. Например:
Природа химической связи в комплексных соединениях. В комплексных соединениях - хотя бы одна из связей - донорно- акцепторная, образуется в результате перекрывания заселенных электронами орбиталей лигандов с вакантными орбиталями центрального атома. Если лиганд, как, например, OH-, OR-, NR2-, SR-, O2-, NR2-, имеет дополнительные неподеленные пары электронов, а центральный атом - подходящие вакантные орбитали, то образуются простые дативные связи. Лиганды, у которых есть вакантные орбитали с центральными атомами, имеющими d -электроны (как, например, у PR3, SR2, AsR3), могут образовывать обратные дативные связи p -типа. Оба эффекта приводят к упрочению координационной связи, увеличивая ее кратность. Природу химической связи в комплексных соединениях объясняют с помощью метода валентных связей, методов молекулярных орбиталей, электростатической теории и ее модификации - теории кристаллического поля. Комплексные соединения в водных растворах При растворении кристаллического комплексного соединения в воде его кристаллическая решетка разрушается, а координационная сфера и внешнесферные ионы гидратируются водой. Этот процесс протекает по механизму диссоциации сильных электролитов. Образование и диссоциация координационной сферы комплексных соединений происходит ступенчато: M + A Û MA K1 = MA + A Û MA2 K2 = ...... MAn-1 + A Û MAn K n = Константы К1, К2,..., К n называются ступенчатыми константами образования (устойчивости). Для обозначения полных констант образования используют символ b: M + A Û MA b 1 = M + 2A Û MA2 b 2 = ...... M + nA Û MAn b n = При этом b n является произведением ступенчатых констант b n =K1 × K2 × ¼ × K n. Константы K n и b n - термодинамические характеристики устойчивости комплекса в растворе. Величины, обратные K n или b n, называются константами диссоциации или нестойкости. Устойчивость комплексных соединений определяется природой центрального атома и лиганда и стерическими факторами. В соответствии с теорией «жестких» и «мягких» кислот и оснований все центральные атомы могут быть условно разделены на два класса: жесткие кислоты Льюиса и мягкие кислоты Льюиса. Первые имеют малый атомный или ионный радиус и высшую положительную степень окисления, предпочтительно взаимодействующие с неполяризующимися жесткими основаниями, такими как F-, OH-, NR2-. Кислоты второго класса имеют большой атомный или ионный радиус и низкую степень окисления, более эффективно взаимодействуют с легко поляризующимися мягкими лигандами. К жестким кислотам Льюиса относятся центральные ионы элементов в высших степенях окисления, с электронной конфигурацией d0 или d10. Мягкие кислоты Льюиса имеют электроны на d -орбиталях, способные к образованию p -связей в результате перекрывания с вакантными d -орбиталями мягких лигандов. С увеличением основных свойств лигандов устойчивость комплексов повышается. Комплексы хелатообразующих реагентов по сравнению с комплексами их монодентантных аналогов обладают повышенной устойчивостью (так называемый хелатный эффект). Присоединение объемного заместителя к донорному атому или вблизи него, например, замена атома водорода на алкильную группу, приводит под влиянием стерических факторов к уменьшению стабильности комплекса, напротив, введение алкильных групп в другие положения, вследствие увеличения основности лигандов, повышает стабильность комплексов. На стабильность комплексов оказывает влияние и природа донорного атома лигандов. В случае «жестких» центральных атомов уменьшение размера донорных атомов лиганда и повышение его электронной плотности приводит к увеличению стабильности комплексов. Например, стабильность комплексов падает в рядах F > Cl > Br > J или O > S > Se > Te. В случае «мягких» центральных ионов наблюдается обратная тенденция: F < Cl < Br < J.
Экспериментальная часть Опыт 1. Образование и разрушение комплексных соединений а) В пробирку налить небольшое количество нитрата серебра и добавить двукратный объем хлорида натрия. Полученный осадок отцентрифугировать, фильтрат слить и к осадку добавить концентрированный раствор аммиака до полного его растворения. Напишите уравнения протекающих реакций в молекулярной и ионно-молекулярной формах. Запишите выражение для константы нестойкости образующегося комплексного иона и ее значение (справочник). Затем в пробирку с растворенным осадком добавить по каплям концентрированную азотную кислоту. Объяснить образование осадка и написать уравнение реакции. б) В пробирку внести несколько кристаллов соли CoCl2·6H2O и осторожно нагреть. Каким процессом обусловлено изменение цвета? Напишите уравнение реакции в молекулярной и ионно-молекулярной формах. Охладить пробирку и добавить несколько капель воды. Что образуется? в) К раствору соли Ni2+ добавляют в избытке водный раствор аммиака. Какой комплекс образуется? Добавить к полученному раствору раствор Na2S. Что происходит? Напишите уравнения протекающих реакций в молекулярной и ионно-молекулярной формах.
Опыт 2. Образование соединений с комплексным анионом К растворам солей Al3+, Cr3+, Sn2+, Zn2+, Pb2+, Co2+ приливают раствор NaOH до растворения вначале выпавшего осадка. Для растворения Pb(OH)2 и Co(OH)2 требуется концентрированный раствор щелочи. Напишите уравнения реакций в молекулярной и ионно-молекулярной формах и выражения для констант нестойкости образующихся комплексных ионов и их значения (справочник). Назовите полученные комплексные соединения. Опыт 3. Образование соединений с комплексным катионом К растворам солей Cu2+, Zn2+ и Ni2+ приливают водный раствор аммиака. Осаждающиеся гидроксиды растворяют в избытке раствора аммиака. Напишите уравнения реакций в молекулярной и ионно-молекулярной формах и выражения для констант нестойкости образующихся комплексных ионов и их значения (справочник). Назовите полученные комплексные соединения. Лабораторная работа № 4 ХИМИЧЕСКИЕ РАВНОВЕСИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
В соответствии с современными представлениями электролиты в растворах подразделяются на две группы: неассоциированные (сильные) и ассоциированные. Если электролит в растворе диссоциирован нацело, он является неассоциированным. Примером таких электролитов в разбавленных водных растворах являются хорошо растворимые в воде соли, некоторые кислоты, щелочи. Все остальные электролиты в растворе относятся к группе ассоциированных, которые делятся на три подгруппы. К первой подгруппе (слабые электролиты) относятся такие электролиты, которые в растворе находятся как в виде ионов, так и недиссоциированных молекул. Вторая подгруппа (ионные ассоциаты) - это электролиты, которые в растворах существуют как в виде простых ионов, так и ионных ассоциатов (ионных пар, тройников, квадрополей), т.е. образований, обусловленных электростатическим взаимодействием. Третья подгруппа - это комплексы различного вида (в их растворах наряду с простыми ионами имеются комплексные частицы). Очевидно, что в зависимости от условий (концентрация раствора, его температура, свойства растворителя) один и тот же электролит может относиться к различным группам. Это принципиально важное обстоятельство позволяет строго рассчитывать количественные термодинамические характеристики электролитов. Количественно процесс электролитической диссоциации характеризуется степенью диссоциации и константой диссоциации. Степень электролитической диссоциации равна отношению числа молекул, распавшихся на ионы n, к общему (исходному) числу растворенных молекул n. a = n / nобщ .
которое представляет собой закон разбавления Освальда. В тех случаях, когда a £ 0.1, можно принять, что 1- a» 1, тогда: Кд. = С a 2 Особенностью сильных электролитов является их полная электролитическая диссоциация в растворе, сопровождающаяся образованием гидратированных ионов и ионных пар. Последние отличаются от молекул тем, что ионы в них не соприкасаются непосредственно друг с другом, а разделены одним или несколькими слоями молекул воды, образуя с ними гидратные комплексы. Современная теория сильных электролитов пользуется понятием «активность иона» для объяснения многообразия всех факторов, влияющих на свойства растворов сильных электролитов, таких как гидратация ионов и сила их электростатического взаимодействия, электропроводность, осмотическое давление, понижение давления пара и температуры кристаллизации, повышение температуры кипения и некоторые другие. Активность иона - это доля ионов вещества, которая проявляет себя в действии, т.е. влияет на определенные свойства растворов сильных электролитов. Активность иона а пропорциональна концентрации иона С и для бинарных электролитов определяется выражением: a = fC, где С - молярная концентрация электролита; а f - коэффициент активности иона. Если при диссоциации электролита (BaCl2, AlCl3, Na3PO4 и др.) из одной молекулы образуется n ионов какого-либо одного вида, то: а = fCn Активность ионов можно считать равной их концентрации лишь в сильно разбавленных растворах.
Ионной силой раствора называется полусумма произведений концентраций каждого иона данного раствора на квадрат его заряда. Коэффициент активности иона f в зависимости от m определяется по формуле Дебая-Хюккеля:
Для растворов с ионной силой менее 0,01 можно пользоваться приближенной формулой:
Гидролиз солей При растворении некоторых соединений в воде, в частности солей, наряду с процессами электролитической диссоциации с образованием гидратированных ионов протекает обменная реакция между молекулами воды и растворенного вещества. Такой процесс называется гидролизом. Гидролиз бывает обратимым и необратимым. Положение равновесия обратимого гидролиза зависит от того, какой электролит более слабый - вода или образующееся соединение. Вода является слабым электролитом. Равновесие реакции: H2O Û H+ + OH- или 2Н2О Û H3O+ + OH- характеризует ионное произведение воды К w ,298 = [H+ ]×[OH- ] = 10-14 Ионное произведение воды - величина постоянная при постоянной температуре. С повышением температуры K w возрастает, т.е. с повышением температуры усиливается диссоциация молекул воды. В чистой воде при 298К [H+] = [OH-] = 10-7 моль/л. При добавлении к воде кислот или щелочей концентрация ионов Н+ и ОН- меняется, что влияет на равновесие диссоциации воды.
Для нейтрального раствора рН =7, для кислого рН <7, для щелочного рН >7. Изменение рН при растворении веществ в воде является одним из основных признаков, указывающих на протекание в растворе гидролиза. Характер гидролиза растворенного вещества определяется природой соли. Различают несколько вариантов гидролиза соли. 1. Соль, образованная сильным основанием и сильной кислотой практически не подвергается гидролизу, поскольку катион обладает слабо поляризующим действием, а анион не образует недиссоциированного соединения с ионами водорода. Растворы таких солей имеют нейтральную реакцию. 2. Соль, образованная сильным основанием и слабой кислотой, гидролизуется по аниону, т.к. анион образует с ионами водорода слабодиссоциирующее соединение KCN + H2O Û KOH + HCN CN- +H2O Û HCN + OH- Реакция среды щелочная, рН >7. Соли, образованные многоосновной слабой кислотой, гидролизуются ступенчато: I. K2CO3 + H2O Û KHCO3 + KOH CO32- + H2O Û HCO3- + OH- II. KHCO3 + H2O Û H2CO3 + KOH HCO3- + H2O Û H2CO3 + OH- причем гидролиз идет в основном по первой ступени, протеканию гидролиза по второй ступени препятствуют ионы ОН-, образовавшиеся в результате гидролиза по первой ступени. 3. Соль, образованная слабым основанием и сильной кислотой, гидролизуется по катиону, т.к. катион образует с ионами гидроксила слабодиссоциирующее соединение. Взаимодействие происходит в результате сильного поляризующего действия катиона соли на молекулы воды, находящиеся в гидратной оболочке. Поскольку в результате гидролиза образуется сильная кислота, то раствор такой соли имеет рН <7. Соли многоосновных оснований гидролизуются ступенчато, причем протекает наиболее полно первая ступень гидролиза. Последняя ступень гидролиза практически не протекает: I. Fe2(SO4)3 + 2H2O Û 2Fe(OH)SO4 + H2SO4 Fe3+ + H2O Û Fe(OH)2+ + H+ II. 2Fe(OH)SO4 + 2H2O Û [Fe(OH)2]2SO4 + H2SO4 Fe(OH)2+ + H2O Û Fe(OH)2+ + H+ При сильно поляризующем действии катиона на молекулу воды протекает гидролиз, причем усиление гидролиза происходит при уменьшении радиуса катиона и увеличении поляризующего действия иона. Сильно поляризующее действие оказывают небольшие по размеру многозарядные ионы (Be2+, Al3+, ионы d-элементов Cu2+, Fe3+, Cr3+ и т.д.), соли которых в водных растворах в значительной степени гидролизованы. Для некоторых ионов (Be2+, Al3+, Zr4+, UO22+) наряду с образованием гидроксосолей в растворах образуются полиядерные комплексы. Некоторые соли (например, сурьмы и висмута) при растворении в воде образуют нерастворимые оксосоединения, выпадающие в осадок: Bi(NO3)3 + H2O Û BiONO3¯ + 2HNO3 Bi3+ + H2O + NO3- Û BiONO3¯ + 2H+ Раствор становится кислым (рН <7). Согласно принципу Ле-Шателье, чтобы предотвратить гидролиз этих солей с выпадением осадков, необходимо подкислять их растворы. 4. Соль, образованная слабым основанием и слабой кислотой, гидролизуется и по катиону и по аниону. CH3COONH4 + H2O Û CH3COOH + NH4OH CH3COO- + NH4+ + H2O Û CH3COOH + NH4OH рН среды зависит от силы образующихся слабых кислоты и основания, обычно рН составляет 6-8. П
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 144; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.36.141 (0.118 с.) |
 ® Fe3+
® Fe3+ Cu + H2O
Cu + H2O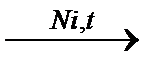 CH3CH2OH
CH3CH2OH