
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Закон распределения. Экстракция. ⇐ ПредыдущаяСтр 8 из 8
Растворение вещества в двух несмешивающихся друг с другом растворителях выражается законом распределения:
где С1 и С2 – равновесные концентрации распределяющегося вещества в первом и втором растворителях, К – коэффициент распределения. В реальных растворах концентрации в выражении закона распределения (1) следует заменять активностями. При диссоциации (ассоциации) вещества в одном из растворителей используют уравнение Шилова-Лепиня:
где n = M2/M1, M1 и M2 – средняя молекулярная масса распределяющегося вещества в первом и втором растворителях. В случае если степень диссоциации α растворенного вещества в растворителях 1 и 2 различна, то уравнение (1) преобразуется к виду:
Закон распределения применяется для описания процесса экстракции. Масса вещества g, оставшегося в растворе после n-го шага экстрагирования может быть рассчитана по формуле:
где g0 – начальная масса экстрагируемого вещества в растворе, V – объем этого раствора, ν – объем порции экстрагента, n – число стадий экстракции.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ Пример 1. Рассчитайте состав раствора бензол-толуол, который при нормальном давлении кипит при температуре 1000С, а также состав образующегося пара. Раствор считайте идеальным. Давления пара чистых бензола и толуола при 1000С равны 1350 Торр и 556 Торр соответственно. Решение: Мольную долю бензола в растворе находим по закону Рауля: 760 = 556 + (1350-556)х1, откуда х1 = 0,257. Мольная доля толуола в растворе равна х2 = 1-х1 = 0,743. Мольную долю бензола в газовой фазе находим по закону Дальтона:
Соответственно мольная доля толуола в паре: Пример 2. Мольные объемы CCl4 и C6H6 равны 0,09719 и 0,08927 л/моль соответственно, а их парциальные мольные объемы в эквимолярном растворе равны 0,10010 и 0,10640 л/моль. Рассчитайте мольный объем эквимолярного раствора и изменение объема при смешении.
Решение: Объем 1 моля раствора определим по формуле (36): Vm = 0,5·0,10010 + 0,5∙0,10640 = 0,10325 (л/моль). Объем до смешения: V0 = 0,5·0,09719 + 0,5∙0,089274 = 0,09323 (л/моль). ∆Vmix = Vm - V0 = 0,01002 (л/моль) – наблюдается увеличение объема раствора при смешении, т. е. положительные отклонения от закона Рауля. Пример 3. Рассчитайте растворимость висмута в кадмии при 150 и 2000С. Энтальпия плавления висмута при температуре плавления (2730С) равна 10,5 кДж/моль и не зависит от температуры. Считайте, что образуется идеальный раствор. Решение: Воспользуемся уравнением Шредера: при 1500С при 2000С Растворимость увеличивается с температурой, что характерно для эндотермического процесса. Пример 4. Раствор 20 г гемоглобина в 1 л воды имеет осмотическое давление 7,52·10-3 атм при 250С. Определите молярную массу гемоглобина. Решение: В уравнении (47) выразим молярную концентрацию как С=m/MV (m – масса гемоглобина в растворе, а М – его молекулярная масса), получим Обратите особое внимание на соответствие размерностей всех величин в используемой формуле. При использовании величины R= 8,314 Пример 5. Проба нелетучей жирной кислоты с общей формулой CnH2n-3COOH массой 1,263 г растворена в 500 г CCl4. Температура кипения раствора составила 76,8040С. Определите, какая кислота была исследована, если Ткип (ССl4)=76,760С, а эбуллиоскопическая постоянная 4,88. Решение: По формуле для расчета молярной массы растворенного вещества: Индекс n находим, решая уравнение: 12n + 1(2n-3) + 12 + 2∙16 +1 = 280, откуда n = 17. Исследована линолевая кислота C17H31COOH (витамин F). Пример 6. Давление пара воды при 273 К равно 610,48 Па, а давление пара 10% раствора NaNO3 589,28 Па. Определите активность, коэффициент активности и химический потенциал воды в растворе. Решение: активность растворителя в неидеальном растворе можно рассчитать по закону Рауля Мольная доля воды в растворе
Химический потенциал воды в реальном растворе:
|
|||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 231; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.187.103 (0.006 с.) |
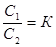 , (1)
, (1)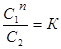 , (2)
, (2)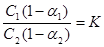 . (3)
. (3)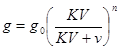 , (4)
, (4)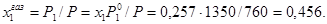
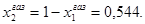

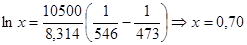 .
. .
. следует выразить осмотическое давление в Па, а молярную концентрацию в
следует выразить осмотическое давление в Па, а молярную концентрацию в 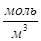 .
.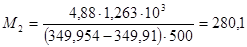 .
. , а коэффициент активности из соотношения
, а коэффициент активности из соотношения  .
. , тогда
, тогда 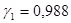 .
.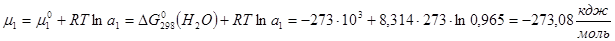 .
.


