
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Объемные дианраммы фазового равновесия систем, образованных ограниченно растворимыми жидкостямиСтр 1 из 8Следующая ⇒
ОБЪЕМНЫЕ ДИАНРАММЫ ФАЗОВОГО РАВНОВЕСИЯ СИСТЕМ, ОБРАЗОВАННЫХ ОГРАНИЧЕННО РАСТВОРИМЫМИ ЖИДКОСТЯМИ ОГРАНИЧЕННАЯ РАСТВОРИМОСТЬ В ДВУХ И ТРЕХ ЧАСТНЫХ БИНАРНЫХ СИСТЕМАХ.
В данной части мы рассмотрим только изотермические сечения Т-х диаграмм (рисунок 3).
а)
б)
в)
Рис. 3. Изотермические сечения объемных диаграмм, образованных тремя жидкостями с ограниченной растворимостью в одной (а), в двух (б) и трех (в) частных бинарных системах.
На рисунке 3(а) представлено изотермическое сечение для системы с ограниченной взаимной растворимостью в одной бинарной системе. На рисунке 3(б) представлено изотермическое сечение для системы с ограниченной взаимной растворимостью в двух бинарных системах. На рисунке 3(в) представлено изотермическое сечение для системы с ограниченной взаимной растворимостью в трех бинарных системах. Как видно из рисунков, неограниченная растворимость может приводить к возникновению одной, двух или трех двухфазных областей на изотермических сечениях объемной дианраммы.
Слайд 2
УЧЕНИЕ О РАСТВОРАХ Растворы – это гомогенные системы, состоящие из растворенных веществ, растворителя и продуктов их взаимодействия. Основные параметры состояния раствора – это давление, температура, концентрация. Идеальный раствор - раствор, образование которого, при любом соотношении компонентов, не сопровождается тепловым эффектом (∆Нраст=0), а также сжатием или расширением системы (т. е. объем раствора обладает свойством аддитивности). Vр-ра= V1 +V2, (1) где V1 и V2 - соответственно объемы первого и второго компонентов до образования раствора. Для соблюдения этих условий надо, чтобы силы взаимодействияв растворе между однородными и разнородными молекулами были одинаковыми, что, естественно, ни в одном действительносуществующем растворе не выполняется. Раствор называется бесконечно разбавленным, если концентрация растворенного вещества в нем бесконечно мала. В таком растворе взаимодействие между молекулами растворенного вещества отсутствует, так как они разделены бесконечно большим объемом растворителя.
В практике бесконечно разбавленныерастворы не встречаются, но к ним близки по свойствам растворы газов в жидкости, с которой они химически не взаимодействуют. Состав растворов обычно выражают в весовых процентах, в молях растворенного вещества на литр раствора (молярность) или на килограмм растворителя (моляльность), а также в мольных долях. Формулы для расчета различных концентраций приведены в таблице 9.
Способы выражения концентраций Таблица 9
Для пересчета концентраций можно использовать следующие соотношения (индекс 1 относится к растворителю, 2 – к растворенному веществу, Mi – молекулярная масса, г/моль; ρ – плотность раствора, г/см3):
Среднюю молекулярную массу раствора рассчитывают по формуле:
МЕТОДЫ ОПРЕДЕЛЕНИЯ ПАРЦИАЛЬНЫХ СВОЙСТВ
• Аналитический – дифференцирование аналитической зависимости интегрального свойства от состава раствора по количеству молей одного из компонентов. Если зависимость Ф=f(n2) может быть аппроксимирована полиномом:
то парциальная мольная характеристика растворенного вещества определяется как
а парциальная мольная характеристика растворителя может быть рассчитана на основании свойства аддитивности (5):
• Графические – основаны на построении касательных к зависимости свойство раствора – состав, причем состав раствора может быть выражен через число молей одного из компонентов, мольную или массовую долю:
а) к кривой Ф = f(n2) → парциальное свойство б) к кривой Ф = f(х2) или Ф = f(ω2) → парциальные свойства
а) Рис. 3 Графические методы определения парциальных мольных величин на основании зависимости свойства раствора от состава: а) от числа молей растворенного вещества n2 – метод касательных; б) от мольной доли растворенного вещества x2 – метод пересечений.
ИДЕАЛЬНЫЙ БИНАРНЫЙ РАСТВОР ЛЕТУЧИЕ БИНАРНЫЕ РАСТВОРЫ Насыщенный пар над идеальным бинарным летучим раствором образован обоими веществами раствора (обозначим их А и В). Давление насыщенного пара над ним (Р) равно сумме парциальных давлений (РА и РВ): Р= РА + РВ. По закону Рауля: Графически эти зависимости выражаются прямыми линиями, проходящими через начало координат (рис.2). Общее давление насыщенного пара:
Рис.2. График закона Рауля для смеси двух летучих жидкостей.
Зависимость общего давления насыщенного пара над раствором от концентрации вещества А выражается прямой линией, не проходящей через начало координат. В реальных предельно разбавленных растворах для растворителя выполняется закон Рауля, а для растворенного вещества выполняется закон Генри. В идеальных растворах закон Генри совпадает с законом Рауля.
РЕАЛЬНЫЕ РАСТВОРЫ. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ Пример 1. Рассчитайте состав раствора бензол-толуол, который при нормальном давлении кипит при температуре 1000С, а также состав образующегося пара. Раствор считайте идеальным. Давления пара чистых бензола и толуола при 1000С равны 1350 Торр и 556 Торр соответственно. Решение: Мольную долю бензола в растворе находим по закону Рауля: 760 = 556 + (1350-556)х1, откуда х1 = 0,257. Мольная доля толуола в растворе равна х2 = 1-х1 = 0,743. Мольную долю бензола в газовой фазе находим по закону Дальтона:
Соответственно мольная доля толуола в паре: Пример 2. Мольные объемы CCl4 и C6H6 равны 0,09719 и 0,08927 л/моль соответственно, а их парциальные мольные объемы в эквимолярном растворе равны 0,10010 и 0,10640 л/моль. Рассчитайте мольный объем эквимолярного раствора и изменение объема при смешении. Решение: Объем 1 моля раствора определим по формуле (36): Vm = 0,5·0,10010 + 0,5∙0,10640 = 0,10325 (л/моль). Объем до смешения: V0 = 0,5·0,09719 + 0,5∙0,089274 = 0,09323 (л/моль). ∆Vmix = Vm - V0 = 0,01002 (л/моль) – наблюдается увеличение объема раствора при смешении, т. е. положительные отклонения от закона Рауля. Пример 3. Рассчитайте растворимость висмута в кадмии при 150 и 2000С. Энтальпия плавления висмута при температуре плавления (2730С) равна 10,5 кДж/моль и не зависит от температуры. Считайте, что образуется идеальный раствор. Решение: Воспользуемся уравнением Шредера: при 1500С при 2000С Растворимость увеличивается с температурой, что характерно для эндотермического процесса. Пример 4. Раствор 20 г гемоглобина в 1 л воды имеет осмотическое давление 7,52·10-3 атм при 250С. Определите молярную массу гемоглобина. Решение: В уравнении (47) выразим молярную концентрацию как С=m/MV (m – масса гемоглобина в растворе, а М – его молекулярная масса), получим
Обратите особое внимание на соответствие размерностей всех величин в используемой формуле. При использовании величины R= 8,314 Пример 5. Проба нелетучей жирной кислоты с общей формулой CnH2n-3COOH массой 1,263 г растворена в 500 г CCl4. Температура кипения раствора составила 76,8040С. Определите, какая кислота была исследована, если Ткип (ССl4)=76,760С, а эбуллиоскопическая постоянная 4,88. Решение: По формуле для расчета молярной массы растворенного вещества: Индекс n находим, решая уравнение: 12n + 1(2n-3) + 12 + 2∙16 +1 = 280, откуда n = 17. Исследована линолевая кислота C17H31COOH (витамин F). Пример 6. Давление пара воды при 273 К равно 610,48 Па, а давление пара 10% раствора NaNO3 589,28 Па. Определите активность, коэффициент активности и химический потенциал воды в растворе. Решение: активность растворителя в неидеальном растворе можно рассчитать по закону Рауля Мольная доля воды в растворе
Химический потенциал воды в реальном растворе:
ОБЪЕМНЫЕ ДИАНРАММЫ ФАЗОВОГО РАВНОВЕСИЯ СИСТЕМ, ОБРАЗОВАННЫХ ОГРАНИЧЕННО РАСТВОРИМЫМИ ЖИДКОСТЯМИ
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 113; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.81.240 (0.033 с.) |






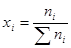

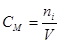
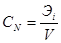
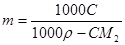 ,
, 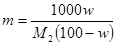 ;
;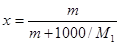 ,
, 
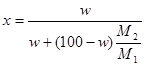 ;
;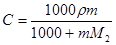 ,
, 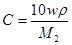 .
. (2)
(2)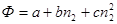 ,
,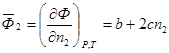 ,
,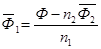 .
. (метод касательных),
(метод касательных), и
и 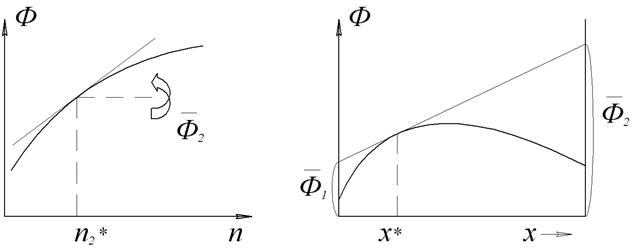
 б)
б) ,
,  , где
, где  - соответственно давление насыщенного пара над чистыми веществами А и В.
- соответственно давление насыщенного пара над чистыми веществами А и В.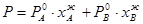 . (7)
. (7)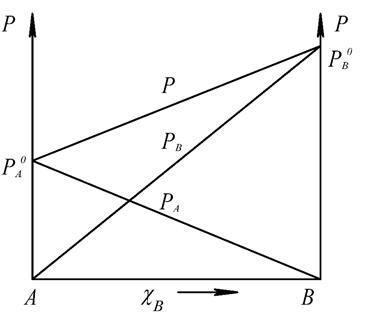
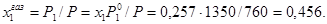
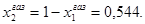

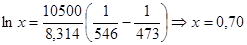 .
. .
. следует выразить осмотическое давление в Па, а молярную концентрацию в
следует выразить осмотическое давление в Па, а молярную концентрацию в 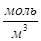 .
.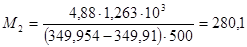 .
. , а коэффициент активности из соотношения
, а коэффициент активности из соотношения  .
. , тогда
, тогда 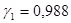 .
.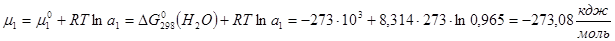 .
.


