
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Парциальные мольные величины
Вклад компонента в любое общее экстенсивное свойство Ф раствора определяется его парциальной мольной величиной, которая выражается как частная производная от любой экстенсивной переменной Ф по количеству i-того компонента (в молях) при постоянных давлении, температуре и числе молей остальных компонентов системы:
Парциальная мольная величина отражает изменение какого-либо экстенсивного свойства раствора Ф при изменении количества i-того компонента на dni в условиях постоянства Р,Т и состава раствора в расчете на 1 моль. Символом парциальной мольной величины является горизонтальная черта над буквенным обозначением термодинамической функции. Особенности парциальных величин: - характеризуют не само свойство, а его изменение, поэтому в отличие от мольных величин ( - парциальные мольные величины зависят от состава раствора, поэтому при определении численного значения парциальной величины необходимо указывать состав; - парциальные мольные величины различных компонентов раствора зависят друг от друга и связаны уравнением Гиббса-Дюгема:
которое позволяет по известной зависимости парциальной мольной величины одного компонента от состава рассчитывать парциальные мольные величины других компонентов и далее – интегральные свойства системы. Парциальными молярными величинами могут быть объем
Общее (интегральное) значение свойства раствора представляет собой сумму вкладов всех компонентов раствора с учетом их количества (свойство аддитивности парциальных мольных величин):
Для бинарного раствора свойство аддитивности запишется следующим образом:
а в расчете на 1 моль раствора:
где
Энергия Гиббса двухкомпонентного раствора, отнесенная к 1 молю:
Величину ∆G в уравнении (9) называют энергией Гиббса образования раствора. Если раствор и его компоненты имеют одну и ту же структуру (общепринятый выбор стандартного состояния компонентов в растворе), то функции образования совпадают с функциями смешения (∆Фmix, где Ф = G, H, S, V). Интегральные функции смешения рассчитывают по формулам (5, 6), а парциальные мольные функции смешения определяют как:
где Так парциальная энергия Гиббса смешения в идеальном растворе:
а парциальная мольная энтропия смешения:
Изменение объема и тепловой эффект в случае идеальных растворов отсутствуют (
МЕТОДЫ ОПРЕДЕЛЕНИЯ ПАРЦИАЛЬНЫХ СВОЙСТВ
• Аналитический – дифференцирование аналитической зависимости интегрального свойства от состава раствора по количеству молей одного из компонентов. Если зависимость Ф=f(n2) может быть аппроксимирована полиномом:
то парциальная мольная характеристика растворенного вещества определяется как
а парциальная мольная характеристика растворителя может быть рассчитана на основании свойства аддитивности (5):
• Графические – основаны на построении касательных к зависимости свойство раствора – состав, причем состав раствора может быть выражен через число молей одного из компонентов, мольную или массовую долю: а) к кривой Ф = f(n2) → парциальное свойство б) к кривой Ф = f(х2) или Ф = f(ω2) → парциальные свойства
а) Рис. 3 Графические методы определения парциальных мольных величин на основании зависимости свойства раствора от состава:
а) от числа молей растворенного вещества n2 – метод касательных; б) от мольной доли растворенного вещества x2 – метод пересечений.
|
||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 504; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.193.232 (0.008 с.) |
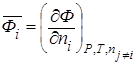 . (1)
. (1)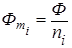 ) они могут принимать любые значения (положительные, отрицательные, нулевые и даже бесконечные);
) они могут принимать любые значения (положительные, отрицательные, нулевые и даже бесконечные); , (2)
, (2)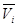 , энтальпия
, энтальпия 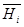 , энтропия
, энтропия 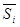 , теплоемкость
, теплоемкость 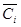 , энергия Гиббса
, энергия Гиббса 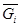 и Гельмгольца
и Гельмгольца 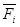 . По определению парциальная мольная энергия Гиббса тождественна химическому потенциалу:
. По определению парциальная мольная энергия Гиббса тождественна химическому потенциалу:  . (3)
. (3)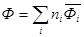 . (4)
. (4) , (5)
, (5) , (6)
, (6) - мольная величина, т. е. свойство одного моля раствора, может быть определена соотношением
- мольная величина, т. е. свойство одного моля раствора, может быть определена соотношением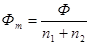 . (7)
. (7)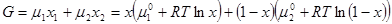 . (8)
. (8)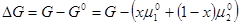 . (9)
. (9)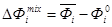 , (10)
, (10) - экстенсивная функция Ф i-того компонента в стандартном состоянии.
- экстенсивная функция Ф i-того компонента в стандартном состоянии.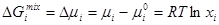 , (11)
, (11)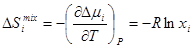 . (12)
. (12)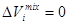 ,
, 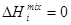 ).
).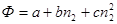 ,
,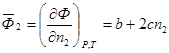 ,
,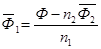 .
. (метод касательных),
(метод касательных), и
и 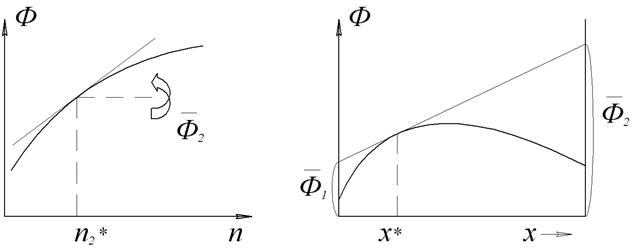
 б)
б)


