
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчет материального и энергетического балансов процесса получения водородаСодержание книги
Поиск на нашем сайте
Материальный баланс По закону Фарадея в результате прохождения через электролит двух фарадеев электричества на катоде выделяется 2 г-экв водорода (1 моль занимающий при нормальном давлении и температуре 0,0224) и 1 г-экв кислорода (0,5 моля - объем 0,0112) и израсходован 1 моль воды. Фактически водорода и кислорода выделяется меньше, так как выход по току в этом процессе ниже 100 % и составит 95-98%, а воды израсходуется больше из-за уноса ее паров с газами. [2] Паров уносится тем больше, чем выше температура, при которой идет электролиз. Материальный баланс ¾ это количество загружаемых реагентов и получаемых продуктов на каждой стадии технологического процесса с учетом промежуточных и побочных продуктов. Материальный баланс составляется на основании закона сохранения массы вещества - количество веществ, вступивших в реакцию, равно количеству веществ, полученных в результате реакции. Приходные статьи баланса Расход воды на электролиз
где
или Расходные статьи баланса На катоде выделяется газообразного водорода за 1 час: K:2 где I ¾ cила тока, проходящего через электролизер, а n ¾количество ячеек в электролизере, шт;
Или
или На аноде выделится газообразный кислород за 1 час: A: 2О+1/2
где
или
Или Расход воды на испарение. Для расчета требуется найти объем газов в реальных условиях, то есть в условиях температуры и влажности атмосферы промышленного предприятия. Объем выделившихся за 1 час газов - водорода и кислорода
Объем влажного газа при реальной температуре: где p - давление насыщенного водяного пара при температуре воздуха, Па; B- барометрическое давление, Па; t - реальная температура в аппарате.
Суммарный объем влажных газов:
Приход |
Расход | |||||
| Вещество | Масса (кг/ч%) | Вещество | Масса (кг/ч%) | ||||
| Обессоленная вода | 61,4 | Водород (газ) | 5,99 | ||||
| Кислород (газ) | 55,3 | ||||||
| Вода | 0 | ||||||
| На унос газами: | 0,31 | ||||||
| Итого | 61,4 | 61,6 | |||||
Потери находятся в допустимых пределах.
Энергетический баланс
Составить тепловой (энергетический) баланс реактора для получения водорода каталитической конверсией метана.[1]
Расчет ведем на 1000 м3 Н2.
Потери теплоты в окружающую среду примем 6% от прихода теплоты.
Расчет ведем по реакции
СН4 + Н2О ↔ СО + 3Н2 – 206200 кДж
Исходные данные:
СН4:Н2О = 1:2.
Температура поступающих в реактор реагентов 1050 С; температура в зоне реакции 9000 С.
Теплоемкости в кДж/(кмоль ∙0С):
| С | СН4 | Н2О | СО | Н2 |
| 0 | ||||
| 1000С | 36,72 | 33,29 | 28,97 | 29,10 |
| 0 | ||||
| 900 С | - | 38,14 | 31,36 | 29,90 |
В соответствии с условием на 1000м3 Н2 объем исходных реагентов[6]
и полученных продуктов будет составлять:
| Приход | Расход | ||
| Исходное вещество | м | Продукт | м3 |
| СН4 | 333 | СО | 333 |
| Н2О | 667 | Н2О | 334 |
| Н2 | 1000 | ||
| Итого | 1000 | 1667 | |
Приход теплоты:
Qфиз.СН4 = (334/22,4)∙36.72∙105 =58180 кДж
Qфиз.Н2О = (667/22,4)∙33.29∙105 = 104130 кДж
ΣQфиз = 162310 кДж
Расход теплоты
Теплота, уносимая продуктами реакции из реактора при 9000С:
QСО = (333/22,4)∙37.36∙900 = 419500 кДж
QН2 = (1000/22,4)∙29.90∙900 =1202700 кДж
QН2О = (334/22,4) ∙38.14∙900 = 511825 кДж
ΣQфиз ун. = 2133025 кДж
Qр = (333/22,44) ∙206200 = 3065400 кДж
Всего: 5198425 кДж
Qп = 162310∙0.06 = 9738 кДж
Тепловой баланс конверсии метана:
| Приход | Расход | ||
| Вещество | кДж | Вещество | кДж |
| QH2O | 104130 | QСО | 419500 |
| QCH4 | 58180 | QH2 | 1201700 |
| QH2O | 511805 | ||
| Qп | 9738 | ||
| Qр | 3065400 | ||
| Итого | 162130 | 5208160 | |
ΔQ = 5208160 – 162130 = 5040030 кДж
Подвод теплоты в зону реакции осуществляется за счет сжигания части метана природного газа (98% СН4 и 2% N2):
СН4 + 2О2 = СО2 + 2Н2О + 890950 кДж/кмоль.
Для покрытия образовавшегося дефицита теплоты ΔQ необходимо сжечь метана
5046030/890950 = 5.66 кмоль или 5.66 · 22.4 = 127м3 СН4., то есть. 129.5 м3 природного газа.
|
| Поделиться: |

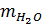 =
= 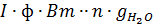 ,
,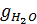 , - электрохимический эквивалент воды, г/А
, - электрохимический эквивалент воды, г/А  ч;
ч;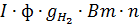 ,
,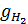 ¾ электрохимический эквивалент водорода, г/А∙ ч;
¾ электрохимический эквивалент водорода, г/А∙ ч;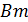 ¾ выход по току, доли; ф ¾продолжительность электролиза, час.
¾ выход по току, доли; ф ¾продолжительность электролиза, час.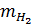 = 1000∙1∙0,037∙0,95∙192 = 6748,8 г/ч
= 1000∙1∙0,037∙0,95∙192 = 6748,8 г/ч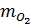 = I∙ф ∙Bm∙ n
= I∙ф ∙Bm∙ n 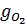
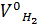 =
= 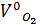 =
= 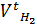 = 78650,88 ∙760∙ (273+80) / 273 ∙ (7502 - 17,5) ∙0,995 = 10378,8 л
= 78650,88 ∙760∙ (273+80) / 273 ∙ (7502 - 17,5) ∙0,995 = 10378,8 л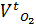 = 39325,44 ∙760 ∙ (273+80) / 273 ∙ (7502 - 17,5) ∙0,995 = 5189,3
= 39325,44 ∙760 ∙ (273+80) / 273 ∙ (7502 - 17,5) ∙0,995 = 5189,3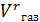 =
= 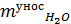 = 15,6 * 20 *10-3 = 0,31 м/час
= 15,6 * 20 *10-3 = 0,31 м/час


