Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электролиз и высокотемпературный электролиз
Несмотря на то, что водород может быть получен множеством способов, наиболее интересной, но и перспективной частью является получение водорода путем электролиза воды.
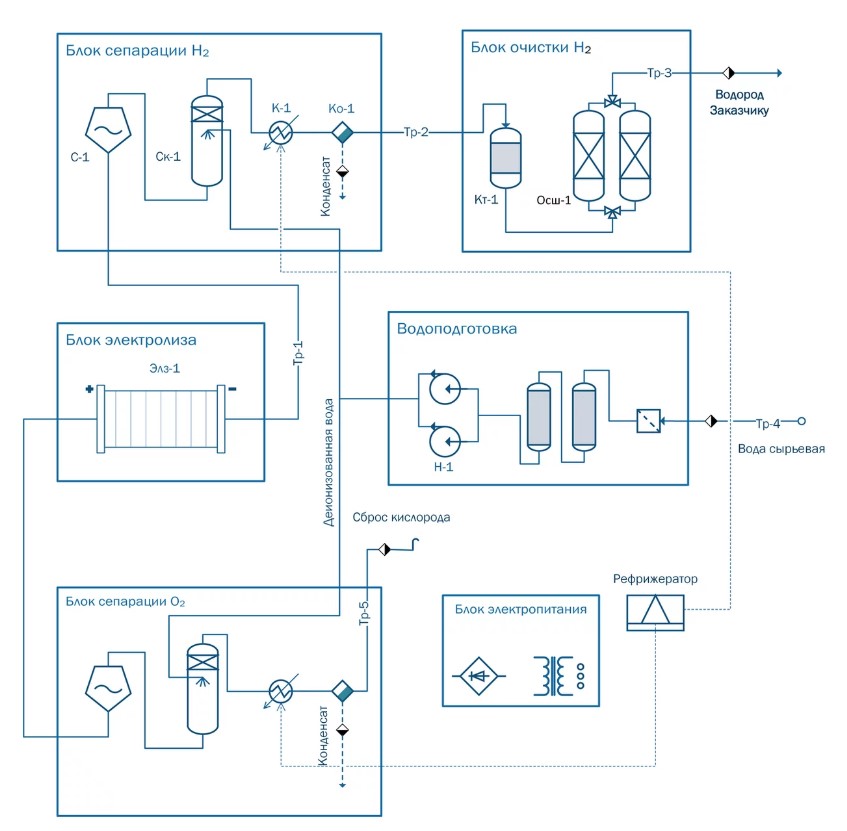
В процессе электролиза происходит расщепление воды на водород и кислород. Электролизер состоит из источника постоянного тока и двух электродов с ноблеметальным покрытием, которые разделены электролитом. Электролит или ионный проводник может быть жидкостью, например проводящим раствором едкого калия (гидроксида калия, КОН)для щелочного электролиза. В щелочном электролизере катод (отрицательный полюс) теряет электроны в водный раствор. Вода диссоциирует, что приводит к образованию водорода и гидроксидных ионов. Носители заряда движутся в электролите по направлению к аноду. На аноде (положительном полюсе) электроны поглощаются отрицательными он – анионами. Oh-анионы окисляются с образованием воды и кислорода. Кислород поднимается на аноде. Мембрана предотвращает смешивание газов продукта H2 и O2, но позволяет пропускать ионы OH. Электролизеры состоят из отдельных ячеек и центральных системных блоков (баланс завода). Схема электролиза воды: анод: 2H2O → O2 + 4H+ + 4e–; катод: 4H+ + 4e– → 2H2. Или: анод: 3H2O → O3 + 6e– + 6H+;
катод: O2 + 2H2O + 2e– → H2O2 + 2OH–. Общее уравнение: 2H2O → 2H2 + O2. Электролизеры дифференцируются по материалам электролита и температуре, при которой они работают: − низкотемпературный электролиз, включая щелочной электролиз; − электролиз протонной обменной мембраны; − электролиз анионообменной мембраны (также известный как щелочной); − высокотемпературный электролиз. Последняя группа наиболее заметно включает электролиз твердых оксидов, но это все еще находится на стадии разработки, и продукты еще не доступны на рынке. Как только он достигнет рыночной зрелости, его преимущества, как ожидается, будут включать повышенную эффективность конверсии и возможность получения синтез-газа непосредственно из пара и CO2, для использования в различных приложениях, таких как синтетические жидкие топлива. Высокотемпературный электролиз особенно интересен тогда, когда рядом с электролизером находится источник тепла (как это часто бывает на промышленных предприятиях) и является более эффективным экономически, чем традиционный электролиз при комнатной температуре.
Действительно, часть энергии поступает в виде тепла, которое либо бесплатно, либо дешевле, чем электричество, а также потому, что реакция электролиза более эффективна при более высоких температурах. [10]
Рисунок 1¾ Технологическая схема установки электролиза воды Паровая конверсия метана В настоящее время большая часть водорода, производимого сегодня, производится через интенсивный процесс CO2, называемый паровой конверсией метана. Высокотемпературный пар (700°C-1000°C) используется для получения водорода из источника метана, такого как природный газ.
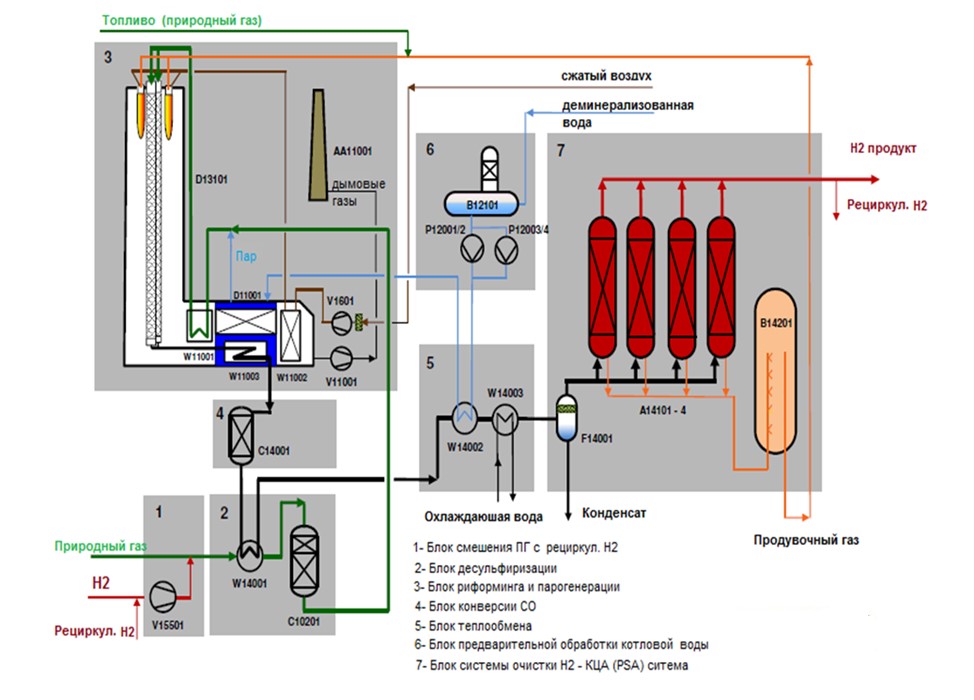
При паровой конверсии метан взаимодействует с паром под давлением 3-25 бар в присутствии катализатора для получения водорода, монооксида углерода и относительно небольшого количества двуокиси углерода. Паровой конверсия является эндотермической — то есть для протекания реакции в процесс необходимо подавать тепло. Впоследствии, в том, что называется "реакцией сдвига вода-газ", монооксид углерода и пар взаимодействуют с использованием катализатора для получения диоксида углерода и большего количества водорода. На заключительном этапе процесса, называемом "адсорбцией под давлением", углекислый газ и другие примеси удаляются из газового потока, оставляя по существу чистый водород. Паровой конверсия может также использоваться для получения водорода из других видов топлива, таких как этанол, пропан или даже бензин. Реакция паровой конверсии метана CH4 + H2O (+тепло) → CO + 3H2 Водогазовая сдвиговая реакция CO + H2O → CO2 + H2 (+ небольшое количество тепла) Частичное окисление При частичном окислении метан и другие углеводороды в природном газе вступают в реакцию с ограниченным количеством кислорода (как правило, из воздуха), которого недостаточно для полного окисления углеводородов до углекислого газа и воды. [9] При меньшем, чем стехиометрическое количество кислорода, доступном, продукты реакции содержат в основном водород и монооксид углерода (и азот, если реакция проводится с воздухом, а не с чистым кислородом), а также относительно небольшое количество диоксида углерода и других соединений.
Затем, в реакции переноса воды-газа, окись углерода реагирует с водой для того чтобы сформировать углекислый газ и больше водорода. Частичное окисление является экзотермическим процессом¾ оно выделяет тепло. [4] Этот процесс, как правило, намного быстрее, чем паровая конверсия, и требует меньшего объема реактора. Как видно из химических реакций парциального окисления, этот процесс изначально производит на единицу вводимого топлива меньше водорода, чем получается при паровой конверсии того же топлива. Парциальное окисление реакции метана CH4 + ½O2 → CO + 2H2 (+ тепло) Водогазовая сдвиговая реакция CO + H2O → CO2 + H2 (+ небольшое количество тепла) Процесс паровой конверсии метана можно также использовать для производства водорода из биогаза.
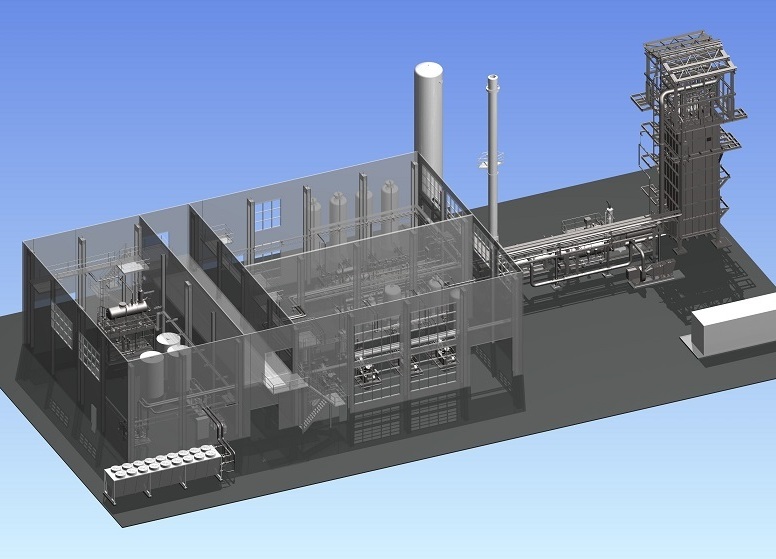
Рисунок 2¾ 3D-модель установки паровой конверсии метана
Рисунок 3 ¾Технологическая схема установки паровой конверсии метана
|
||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 245; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.211.87 (0.009 с.) |