Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Проведения практического занятия № 4Содержание книги
Поиск на нашем сайте
I. Методический блок Тема: Действия фельдшера на вызове. Особенности транспортировки и мониторирования жизненно важных функций организма при первичной СЛР № 4 Специальность 31.02.01 Лечебное дело Дисциплина: ПМ 03 Неотложная медицинская помощь на догоспитальном этапе Раздел 1 Общие вопросы реаниматологии при неотложных состояниях Курс: I (II) Семестр: 2 (4) Количество часов 4
31ФЛ 22.04.2020г. Русляков
II. ИНФОРМАЦИОННЫЙ БЛОК
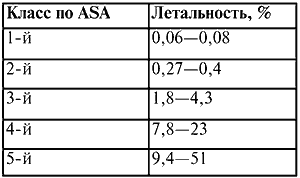
ИНСТРУКЦИЯ ПРОВЕДЕНИЯ ПРАКТИЧЕСКОГО ЗАНЯТИЯ № 4 Особенности транспортировки и мониторирования жизненно важных функций организма при первичной СЛР. В проведении занятия используются современные Клинические протоколы оказания помощи и укладки фельдшера скорой неотложной помощи. Оценка состояния больного и периоперационная летальность
Мониторинг (табл. 7) это контроль функций и процессов, выявление опасных их отклонений с целью предупреждения осложнений, в частности, во время анестезии и интенсивной терапии.
Мониторинг проводят с целью контроля: 1) за функциями больного (электрокардиография, пульсоксиметрия, капнография и др.); 2) лечебных действий (контроль нейромышечного блока); 3) окружающей среды (газового состава вдыхаемой смеси); 4) работы технических средств (аппарата ИВЛ и пр.).
Мониторинг функций по степени сложности может осуществлять:
1) непрерывный контроль за параметрами; 2) контроль с сигнализацией при выходе параметра из строя за установленные пределы; 3) непрерывный контроль с оповещением при выходе параметра за установленные пределы, а дополнительно подсказка решения; 4) то же с проведением мер по нормализации функции.
Актуальность мониторинга обусловлена: 1) постоянно возрастающей сложностью и длительностью хирургических вмешательств; 2) увеличением тяжести функциональных расстройств у больных; 3) усложнением технических средств, используемых в критической медицине.
Значимость мониторинга: 1) своевременная диагностика нарушений и профилактика тяжелых осложнений, в том числе остановки сердца и дыхания; 2) более адекватная тактика интенсивной терапии и высокая эффективность лечения. Показания для мониторинга: 1) минимального мониторинга – обязателен всегда при анестезии и интенсивной терапии;
2) углубленного мониторинга (неинвазивные и инвазивные методы) при значительных нарушениях функций организма, особенно при возникновении у больного полиорганной недостаточности; 3) профилактического мониторинга – при риске развития критического состояния.
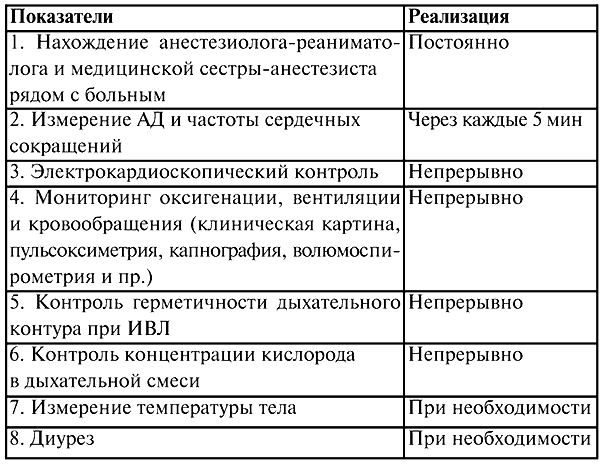
Стандарты мониторинга. В 1978 г. Голландским Советом здравоохранения введен первый стандарт мониторинга в операционной, который перечислял необходимое для мониторинга оборудование. В 1985 г. по предложению страховых компаний предложен Гарвардский стандарт мониторинга для анестезиологии, предусматривающий параметры для контроля у больных во время анестезии при операции и режим такого контроля. Внедрение его в практику снизило риск анестезиологических осложнений и сделало ее более безопасной для пациента. В нашей стране в 1997 г. в системе МОРФ были обозначены стандарты минимального мониторинга проведения наркоза, реанимационных мероприятий и интенсивной терапии (№ 161/ДМ-2 от 24 февраля 1997 г. «О мерах по обеспечению безопасности больных во время анестезии, реанимации и интенсивной терапии»). Данные приведены в таблице 8, таблице 9.
Таблица 8 Анестезия
Таблица 9 Мониторинг функций систем Мониторинг системы кровообращения Мониторинг кровообращения предусматривает своевременное выявление аритмий сердца и ишемии миокарда посредством использования электрокардиографии. Аритмии сердца можно определить по зубцу Р и комплексу ORS на электрокардиомониторе в отведениях V1 и V2 стандартного отведения от конечностей или их модификаций. Ишемию миокарда можно определить по возникшей депрессии сегмента ST на ЭКГ: 1) в грудном отведении V5, а также на одной из ее модификаций – ишемия перегородки левой боковой стенки; 2) стандартное 2 отведение от конечностей – ишемия базальной зоны миокарда в бассейне правой коронарной артерии. Косонисходящая депрессия ST (элевация) является индикатором ишемии под воздействием стресса. Мониторинг гемодинамики осуществляют путем: 1) измерения АД; 2) измерения ЦВД в сочетании с объемными нагрузочными пробами (это информация о сосудистом наполнении);
3) определения давления в легочной артерии и давления заклинивания (ДЗЛА) с помощью флотирующего катетера легочной артерии – более точный метод для оценки внутрисосудистого объема, чем ЦВД, а также может служить мерой преднагрузки левого желудочка; 4) определение сердечного выброса посредством термодилюционной методики, методом Фика (СO = VCO2 / CaCO2), различными модификациями методики Доплера (пищеводная доплеровская эхокардиография), УЗИ сердца. Мониторинг дыхания Мониторинг дыхания осуществляют по клиническим симптомам и данным капнографии, пульсоксиметрии, волюмоспирометрии и периодическим исследованием газов крови. При ИВЛ дополнительно определяют давление в системе «аппарат ИВЛ – больной» и концентрацию кислорода во вдыхаемой смеси (FiO2). Клинические признаки нарушения дыхания: частое (более 24–30 в мин для взрослых) поверхностное дыхание, участие в дыхании дополнительных мышц (грудино-ключично-сосцевидных, абдоминальных и других, что проявляется втягиванием межреберных промежутков, раздуванием крыльев носа, вынужденным полусидячим положением), потливостью, цианозом, изменением пульса (сначала учащение, а затем может быть аритмия) и АД (повышение, а при выраженной гипоксии – снижение), изменением сознания от эйфории до комы. Капнография позволяет своевременно выявить нарушение вентиляции: гиповентиляцию (увеличение концентрации СО2 в конечно-выдыхаемом воздухе – FetCO2 > 6,4 %), гипервентиляцию (FetCO2 < 4,9 %), неравномерность вентиляции (угол наклона альвеолярного плато капнограммы – 5°). При ИВЛ, если отсутствует капнограф, объем вентиляции контролируется по минутному объему дыхания (Vист.), измеряемому с помощью волюмоспирометра, который устанавливается на пути выдоха. Кроме этого, осуществляется контроль за минутным вдыхаемым объемом (Vаппар.), который необходим для расчета концентрации кислорода во вдыхаемой смеси газов и определения герметичности данной системы – «аппарат ИВЛ—больной». Контроль герметичности достигается также по давлению в системе «аппарат—больной», измеряемом посредством моновакуометра. Пульсоксиметрия позволяет своевременно выявить нарушение оксигенации в легких, гипоксемию (SaO2 < 94 %). Кроме того, на основании характера плетизмограммы можно судить о состоянии микроциркуляции и сердечном выбросе. Дополнительное исследование газов крови помогает оценить степень нарушения газообмена в легких (по величине альвеолоартериального градиента напряжения кислорода. Некоторые мониторы могут обеспечивать во время проведения ИВЛ оценку биомеханики дыхания на основании величины податливости легких и грудной клетки (С, в норме 60—100 мл) и сопротивления (резистентности) дыхательных путей (R, в норме 2–3 см). Мониторинг неврологических функций Мониторинг неврологических функций осуществляют путем оценки сознания по шкале Глазго (на основании реакции открывания глаз, двигательного и словесного ответов на возрастающий по силе стимул: 15 баллов – норма, 3 балла – смерть мозга). Кроме этого, определяют внутричерепное давление и мозговой кровоток (например, с помощью транскраниального доплеровского монитора). Монитор функции почек осуществляют чаще всего путем определения почасового диуреза, который в норме составляет > 0,5 мл/кг/ч. Дыхательные контуры
Ручная вентиляция с помощью мешка или маски легко доступна и часто достаточна для адекватного раздувания легких. Успешность ее, как правило, определяется правильным подбором размеров маски и опытностью оператора, а не тяжестью патологии легких.
Показания 1. Реанимация и подготовка пациента за короткий промежуток времени к последующей интубации. 2. Периодическое проведение ИВЛ мешком и маской с целью профилактики постэкстубационных ателектазов. 3. Ограничения к ИВЛ мешком и маской. Оборудование Используется обычный дыхательный мешок и маска с установленным мановакуометром или самораздувающийся дыхательный мешок с кислородной камерой. Техника проведения 1. Необходимо разместить плотно маску на лице больного, придав голове больного срединное положение с фиксацией подбородока пальцем. Маска не должна лежать на глазах. 2. Частота дыханий – обычно 30–50 в 1 мин. 3. Давление вдоха – обычно 20–30 см вод. ст. 4. Большее давление (30–60 см вод. ст.) допустимо при первичной реанимации в родовой деятельности женщины. Оценка эффективности 1. Возврат ЧСС к нормальным цифрам и исчезновение центрального цианоза. 2. Экскурсия грудной клетки должна быть хорошей, дыхание проводится одинаково хорошо с обеих сторон. 3. Исследование газового состава крови обычно требуется и проводится при длительной реанимации. Осложнения 1. Пневмоторакс. 2. Вздутие живота. 3. Гиповентиляционный синдром или эпизоды апноэ. 4. Раздражение кожи лица. 5. Отслойка сетчатки (при накладывании маски на глаза и создании длительно высокого пикового давления). 6. Вентиляция маской и мешком может ухудшить состояние пациента, если он активно сопротивляется процедуре. Аппаратная ИВЛ Показания 1. Апноэ. 2. Кома в остром периоде, даже без признаков дыхательной недостаточности. 3. Судороги, не купируемые стандартной противосудорожной терапией. 4. Шок любой этиологии. 5. Нарастание в динамике синдрома угнетения ЦНС при гипервентиляционном синдроме. 6. При родовой спинальной травме у новорожденных – появление на фоне одышки форсированного дыхания и крепитирующих распространенных хрипов. 7. РО2 капиллярной крови менее 50 мм рт. ст. при спонтанном дыхании смесью с FiO2 0,6 и более. 8. РСО2 капиллярной крови более 60 мм рт. ст. или менее 35 мм рт. ст. при спонтанном дыхании. Оборудование: «ФАЗА-5», «ВP-2001», «Infant-Star 100 или 200», «Sechrist 100 или 200», «Babylog 1», «Stephan» и др. Принципы лечения 1. Оксигенация при ригидных легких может быть достигнута повышением концентрации вдыхаемого кислорода, повышением давления вдоха, повышением PEEP, удлинением времени вдоха, увеличением давления плато.
2. Вентиляция (выведение СО2) может быть усилена увеличением дыхательного объема, увеличением частоты, удлинением времени выдоха. 3. Подбор параметров ИВЛ (частоты, давления вдоха, плато вдоха, соотношения вдоха и выдоха, РЕЕР) будет меняться в зависимости от характера основного заболевания и реакции пациента на проводимую терапию. Цели проведения ИВЛ 1. Кислород: достичь pO2 50—100 мм рт. ст. 2. Удержать pСО2 в пределах 35–45 мм рт. ст. 3. Исключения: в некоторых ситуациях показатели рО2 и pСО2 могут отличаться от вышеуказанных: 1) при хронической легочной патологии более высокие значения рСО2 переносимы; 2) при сильных пороках сердца переносятся меньшие цифры pО2; 3) в зависимости от терапевтического подхода в случае легочной гипертензии переносимы большие или меньшие цифры pСО2. 4. Показания и параметры ИВЛ всегда должны быть документированы. Техника проведения 1. Начальные параметры ИВЛ: давление вдоха 20–24 см вод. ст.; РЕЕР от 4–6 см вод. ст.; частота дыханий 16–24 в 1 мин, время вдоха 0,4–0,6 с, ДО от 6 до 10 л/мин, МОВ (минутный объем вентиляции) 450–600 мл/мин. 2. Синхронизация с респиратором. Как правило, больные синхронны с респиратором. Но возбуждение может ухудшить синхронизацию, в таких случаях может потребоваться медикаментозная терапия (морфин, промедол, оксибутират натрия, миорелаксанты). Обследование 1. Важной составляющей обследования являются неоднократные анализы газов крови. 2. Физикальный осмотр. Контроль адекватности проведения ИВЛ. При проведении экстренной ИВЛ простым методом достаточно наблюдать за цветом кожи и движениями грудной клетки пациента. Стенка грудной клетки должна расширяться при каждом вдохе и опадать при каждом выдохе, но если поднимается эпигастральная область, значит, вдуваемый воздух поступает в пищевод и желудок. Причиной чаще бывает неправильное положение головы больного. При проведении длительной аппаратной ИВЛ необходимо судить об ее адекватности. Если спонтанное дыхание больного не подавлено фармакологическими препаратами, то одним из основных признаков адекватности проводимой ИВЛ является хорошая адаптация больного к респиратору. При наличии ясного сознания у больного не должно быть ощущения недостатка воздуха, дискомфорта. Дыхательные шумы в легких должны быть одинаковыми с обеих сторон, а кожные покровы должны иметь обычную окраску. Осложнения 1. Наиболее частыми осложнениями механической вентиляции являются: разрыв альвеол с развитием интерстициальной эмфиземы, пневмоторакса и пневмомедиастенита. 2. Другими осложнениями могут быть: бактериальное обсеменение и инфицирование, обтурация интубационной трубки или экстубация, однолегочная интубация, пневмоперикардит с тампонадой сердца, снижение венозного возврата и уменьшение сердечного выброса, хронизация процесса в легких, стеноз и обструкция трахеи. На фоне ИВЛ возможно применение ряда анальгетиков, которые должны обеспечивать достаточный уровень и глубину анестезии в дозах, введение которых в условиях самостоятельного дыхания сопровождалось бы гипоксемией. Поддерживая хорошее обеспечение крови кислородом, ИВЛ способствует тому, что организм справляется с операционной травмой. При многих операциях на органах грудной клетки (легких, пищеводе) применяют раздельную интубацию бронхов, что позволяет при оперативных вмешательствах выключать одно легкое из вентиляции для того, чтобы облегчить работу хирурга. Такая интубация также предотвращает затекание в здоровое легкое содержимого из оперируемого легкого.
При операциях на гортани и дыхательных путях используют чрескатетерную струйную высокочастотную ИВЛ, которая облегчает осмотр операционного поля и позволяет поддерживать адекватный газообмен при вскрытой трахее и бронхах. В условиях общей анестезии и мышечной релаксации пациент не в состоянии реагировать на возникшую гипоксию и гиповентиляцию, поэтому важное значение приобретает контроль за содержанием газового состава крови (постоянный мониторинг показателей парциального давления кислорода и парциального давления двуокиси углерода) чрескожным путем при помощи специальных датчиков. В случае клинической смерти или агонии ИВЛ – обязательный компонент реанимационного мероприятия. Прекращать проведение ИВЛ можно только после того, как сознание полностью восстановлено и самостоятельное дыхание полноценно. В комплексе интенсивной терапии ИВЛ является наиболее эффективным методом лечения острой дыхательной недостаточности. Ее проводят через трубку, которую вводят в трахею через нижний носовой ход или трахеостому. Особое значение имеет уход за дыхательными путями, их адекватное дренирование. Вспомогательную ИВЛ применяют сеансами в течение 30–40 мин для лечения больных с хронической дыхательной недостаточностью. ИВЛ используют у больных, находящихся в состоянии комы (травма, операция на головном мозге), а также при периферическом поражении дыхательной мускулатуры (полирадикулоневрит, травма спинного мозга, боковой амиотрофический склероз). Широко используют ИВЛ и при лечении больных с травмой грудной клетки, различными отравлениями, нарушениями мозгового кровообращения, столбняком, ботулизмом. Инфузионная терапия Инфузионная терапия – это капельное введение или вливание внутривенно или под кожу лекарственных средств и биологических жидкостей с целью нормализации водно-электролитного, кислотно-щелочного баланса организма, а также для форсированного диуреза (в сочетании с мочегонными средствами). Показания к инфузионной терапии: все разновидности шока, кровопотери, гиповолемия, потеря жидкости, электролитов и белков в результате неукротимой рвоты, интенсивного поноса, отказа от приема жидкости, ожогов, заболеваний почек; нарушения содержания основных ионов (натрия, калия, хлора и др.), ацидоз, алкалоз и отравления. Главные признаки обезвоживания организма: западение глазных яблок в орбиты, тусклая роговица, кожные покровы сухие, неэластичные, характерно сердцебиение, олигурия, моча становится концентрированной и темно-желтой, общее состояние угнетенное. Противопоказаниями к инфузионной терапии являются острая сердечно-сосудистая недостаточность, отек легких и анурия. Кристаллоидные растворы способны восполнять дефицит воды и электролитов. Применяют 0,85 %-ный раствор натрия хлорида, растворы Рингера и Рингера—Локка, 5 %-ный раствор натрия хлорида, 5—40 %-ные растворы глюкозы и другие растворы. Их вводят внутривенно и подкожно, струйно (при выраженном обезвоживании) и капельно, в объеме 10–50 и более мл/кг. Эти растворы не вызывают осложнений, за исключением передозировки. Цели инфузионной терапии: восстановление ОЦК, устранение гиповолемии, обеспечение адекватного сердечного выброса, сохранение и восстановление нормальной осмолярности плазмы, обеспечение адекватной микроциркуляции, предупреждение агрегации форменных элементов крови, нормализация кислородно-транспортной функции крови. Коллоидные растворы – это растворы высокомолекулярных веществ. Они способствуют удержанию жидкости в сосудистом русле. Используют гемодез, полиглюкин, реополиглюкин, реоглюман. При их введении возможны осложнения, которые проявляются в виде аллергической или пирогенной реакции. Пути введения – внутривенно, реже подкожно и капельно. Суточная доза не превышает 30–40 мл/кг. Обладают дезинтоксикационным качеством. Как источник парентерального питания применяются в случае длительного отказа от приема пищи или невозможности кормления через рот. Применяют гидролизины крови и казеина (альвезин-нео, полиамин, липофундин и др.). Они содержат аминокислоты, липиды и глюкозу. Иногда на введение бывает аллергическая реакция. Темп и объем инфузии. Все инфузии с позиции объемной скорости вливания можно разграничить по двум категориям: требующие и не требующие быстрой коррекции дефицита ОЦК. Основную проблему могут представлять больные, которые нуждаются в быстрой ликвидации гиповолемии. т. е. темп проводимой инфузии и ее объем должны обеспечивать производительность сердца, чтобы должным образом снабдить регионарную перфузию органов и тканей без значительной централизации кровообращения. У пациентов с исходно здоровым сердцем максимально информативны три клинических ориентира: среднее АД > 60 мм рт. ст.; центральное венозное давление – ЦВД > 2 см вод. ст.; диурез 50 мл/ч. В сомнительных случаях проводят пробу с нагрузкой в объеме: в течение 15–20 мин вливают 400–500 мл кристаллоидного раствора и наблюдают за динамикой ЦВД и диуреза. Значительный подъем ЦВД без увеличения диуреза может указывать на сердечную недостаточность, что подсказывает необходимость провести более сложные и информативные методы оценки гемодинамики. Сохранение обоих показателей низкими говорит о гиповолемии, тогда поддерживают высокую скорость вливаний с повторной поэтапной оценкой. Увеличение диуреза обозначает преренальную олигурию (гипоперфузию почек гиповолемического генеза). Инфузионная терапия у пациентов с недостаточностью кровообращения требует четких знаний гемодинамики, большого и специального мониторного наблюдения. Декстраны – это коллоидные плазмозаменители, что обуславливает их высокую эффективность в быстром восстановлении ОЦК. Декстраны имеют специфические защитные свойства в отношении ишемических заболеваний и реперфузии, риск которых всегда присутствует при проведении больших хирургических вмешательств. К отрицательным сторонам декстранов следует отнести риск развития кровотечений за счет дезагрегации тромбоцитов (особенно характерно для реополиглюкина), когда возникает необходимость использования значительных доз препарата (> 20 мл/кг), и временное изменение антигенных свойств крови. Декстраны опасны способностью вызывать «ожог» эпителия канальцев почек и поэтому противопоказаны при ишемии почек и почечной недостаточности. Они часто вызывают анафилактические реакции, которые бывают весьма тяжелыми. Особый интерес представляет раствор человеческого альбумина, так как является природным коллоидом плазмозаменителя. При многих критических состояниях, сопровождающихся повреждением эндотелия (прежде всего при всех видах системных воспалительных заболеваний) альбумин способен переходить в межклеточное пространство внесосудистого русла, притягивая к себе воду и ухудшая интерстициальный отек тканей, в первую очередь легких. Свежезамороженная плазма – это продукт, взятый от одного донора. СЗП отделяется от цельной крови и немедленно замораживается в течение 6 ч после забора крови. Хранится при температуре 30 °C в пластиковых пакетах в течение 1 года. Учитывая лабильность факторов свертывания, СЗП должна быть перелита в течение первых 2 ч после быстрой разморозки при температуре 37 °C. Переливание свежезамороженной плазмы (СЗП) дает высокий риск заражения опасными инфекциями, такими как ВИЧ, гепатиты В и С и др. Частота анафилактических и пирогенных реакций при переливании СЗП весьма высока, поэтому совместимость по системе АВО должна учитываться. А для молодых женщин необходимо учитывать Rh-совместимость. В настоящее время единственным абсолютным показанием к применению СЗП является профилактика и лечение коагулопатических кровотечений. СЗП выполняет сразу две важнейшие функции – гемостатическую и поддержания онкотического давления. СЗП также переливают при гипокоагуляции, при передозировке непрямыми антикоагулянтами, при проведении лечебного плазмофереза, при остром ДВС-синдроме и при наследственных заболеваниях, связанных с дефицитом факторов свертывания крови. Показателями адекватной проводимой терапии являются ясное сознание больного, теплые кожные покровы, стабильная гемодинамика, отсутствие выраженной тахикардии и одышки, достаточный диурез – в пределах 30–40 мл/ч. Гемотрансфузия Осложнения гемотрансфузии: посттрансфузионные расстройства системы свертывания крови, тяжелые пирогенные реакции с наличием гипертермического синдрома и сердечно-сосудистой декомпенсацией, анафилактические реакции, гемолиз эритроцитов, острая почечная недостаточность и т. д. В основе большинства осложнений лежит реакция отторжения организмом чужеродной ткани. Показаний к переливанию цельной консервированной крови нет, потому что значителен риск посттрансфузионных реакций и осложнений, но наиболее опасным является высокий риск заражения реципиента. При острой кровопотере при хирургическом вмешательстве и адекватном восполнении дефицита ОЦК даже резкое снижение гемоглобина и гематокрита не угрожает жизни больного, так как потребление кислорода под наркозом значительно уменьшается, допустима дополнительная оксигенация, гемодилюция способствует профилактике возникновения микротромбообразования и мобилизации эритроцитов из депо, увеличению скорости кровотока и т. д. Имеющиеся у человека от природы «запасы» эритроцитов значительно превышают реальные потребности, тем более в состоянии покоя, в котором в это время находится пациент. Рекомендации по назначению переливания донорской крови и эритроцитов во время операции. 1. Переливание эритроцитарной массы проводится после восстановления ОЦК. 2. При наличии тяжелой сопутствующей патологии, которая может привести к летальному исходу (например, при тяжелой ишемической болезни сердца плохо переносится выраженная анемия). 3. При наличии следующих показателей красной крови больного: 70–80 г/л для гемоглобина и 25 % для гематокрита, а количество эритроцитов 2,5 млн. Показанием к переливанию крови являются: кровотечение и коррекция гемостаза. Виды эритросред: цельная кровь, эритроцитарная масса, ЭМОЛТ (эритроцитарная масса, отделенная от лейкоцитов, тромбоцитов с физиологическим раствором). Кровь вводят внутривенно капельно, при помощи одноразовой системы при скорости 60– 100 капель в минуту, в объеме 30–50 мл/кг. Перед переливанием крови обязательно проводится определение группы крови и резус-фактора реципиента и донора, проводят пробу на их совместимость, а у постели больного проводится биологическая проба на совместимость. При появлении анафилактической реакции трансфузия прекращается и начинаются мероприятия по ликвидации шока. Концентрат тромбоцитов стандартный – это суспензия дважды отцентрифугированных тромбоцитов. Минимальное количество тромбоцитов 0,5? 1012 на литр, лейкоцитов – 0,2? 109 на литр. Гемостатические характеристики и выживание наиболее выражены в ближайшие 12–24 ч приготовления, но препарат может быть использован в течение 3–5 дней с момента забора крови. Концентрат тромбоцитов используется при тромбоцитопении (лейкемия, аплазия костного мозга), при тромбопатии с геморрагическим синдромом.
Парентеральное питание При тяжелых заболеваниях, сопровождающихся выраженными нарушениями гомеостаза, необходимо обеспечить организм энергетическим и пластическим материалом. Поэтому, когда питание через рот по каким-либо причинам нарушено или совсем невозможно, необходимо переводить больного на парентеральное питание. При критических состояниях различной этиологии самые значительные изменения происходят в метаболизме белков – наблюдается интенсивный протеолиз, особенно в поперечнополосатой мускулатуре. В зависимости от тяжести протекающего процесса белки организма катаболизируются в количестве 75—150 г в сутки (суточные потери белка приведены в таблице 11). Это ведет к дефициту незаменимых аминокислот, которые используются в качестве источника энергии в процессе гликонеогенеза, что приводит к отрицательному азотистому балансу.
Таблица 11 Дезинтоксикационная терапия При тяжелых интоксикациях необходима активная дезинтоксикационная терапия, направленная на связывание и выведение токсинов из организма. С этой целью чаще всего используют растворы поливинилпирролидона (неокомпенсан, гемодез) и желатиноль, адсорбирующие и обезвреживающие токсины, которые потом выводятся почками. Эти растворы вводят капельно в количестве 5—10 мл/кг массы больного, добавляя в них витамин С и раствор хлористого калия в минимальном количестве 1 ммоль/кг массы тела. Выраженным дезинтоксикационным свойством обладает также мафусол, являющийся эффективным антигипоксантом и антиоксидантом. Кроме того, он улучшает микроциркуляцию и реологические свойства крови, что также способствует дезинтоксикационному эффекту. При различных отравлениях одним из наиболее эффективных способов дезинтоксикации является форсированный диурез. Внутривенное введение жидкостей с целью проведения форсированного диуреза назначают при тяжелых степенях отравлений и при более легких, когда больной отказывается пить. Противопоказаниями к форсированному диурезу являются: острая сердечно-сосудистая недостаточность и острая почечная недостаточность (анурия). Проведение форсированного диуреза требует строгого учета объема и количественного состава вводимой жидкости, своевременного назначения диуретиков, четкого клинического и биохимического контроля. В качестве основного раствора для водной нагрузки предложено: глюкоза 14,5 г; натрия хлорид 1,2 г; натрия гидрокарбонат 2,0 г; калия хлорид 2,2 г; вода дистиллированная до 1000 мл. Этот раствор изотоничен, содержит необходимое количество гидрокарбоната натрия, концентрация калия в нем не превышает допустимую, а соотношение осмотической концентрации глюкозы и солей равно 2: 1. На начальном этапе форсированного диуреза целесообразно ввести также плазмозамещающие и какие-либо дезинтоксикационные растворы: альбумин 8—10 мл/кг, гемодез или неокомпенсан 15–20 мл/кг, мафусол 8—10 мл/кг, рефортан или инфукол 6–8 мл/кг, реополиглюкин 15–20 мл/кг. Общее количество вводимых растворов ориентировочно должно превышать суточную потребность в 1,5 раза.
I. Методический блок Тема: Действия фельдшера на вызове. Особенности транспортировки и мониторирования жизненно важных функций организма при первичной СЛР № 4 Специальность 31.02.01 Лечебное дело Дисциплина: ПМ 03 Неотложная медицинская помощь на догоспитальном этапе Раздел 1 Общие вопросы реаниматологии при неотложных состояниях Курс: I (II) Семестр: 2 (4) Количество часов 4
31ФЛ 22.04.2020г. Русляков
II. ИНФОРМАЦИОННЫЙ БЛОК
ИНСТРУКЦИЯ ПРОВЕДЕНИЯ ПРАКТИЧЕСКОГО ЗАНЯТИЯ № 4 Особенности транспортировки и мониторирования жизненно важных функций организма при первичной СЛР.
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 256; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.156.153 (0.019 с.) |