
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Аналитический этап - Основные компоненты
Праймеры – искусственно синтезированные олигонуклеотиды, имеющие, как ► быть специфичными, для этого основным условием является адекватно подобранный фрагмент, который предполагается накапливать – он должен быть консервативным, не изменяться при переходе от хозяина к хозяину, под воздействием антибиотиков и др. При недостаточной специфичности праймеров в процессе ПЦР будут образовываться продукты, которые, с одной стороны, могут быть идентифицированы как ложноположительный результат, а с другой стороны, на процессы их накопления будут расходоваться компоненты реакционной смеси, Буфер – смесь катионов и анионов в определенной концентрации, обеспечивающей оптимальные условия для реакции, а также стабильное значение рН.
Положительный контрольный образец (ПКО) представляет собой искусственно синтезированную олигонкулеотидную последовательность, строго соответствующую искомой. Соответственно, праймеры для ПКО и искомой мишени одинаковые, что позволяет удостовериться в работоспособности и сохранности компонентов РС, необходимых для нормального прохождения ПЦР. Внутренний контроль - это искусственно сконструированный препарат ДНК или РНК, который имеет принципиально отличную от искомой олигонуклеотидную последовательность, добавляется вместо биопробы. Внутренний контроль необходим, поскольку биопроба может содержать ингибиторы, в присутствии которых ПЦР мало или совсем не эффективна. Кроме того, возможны ошибки на этапе составления РС (например, не добавили какой-либо компонент или саму НК), несоблюдение температурного режима хранения наборов реагентов или отдельных их частей (например, размораживание и потеря активности ферментов) и ряд других технических моментов, которые напрямую влияют на результаты ПЦР. Поэтому становится необходимым контролировать ход амплификации в каждой пробирке с реакционной смесью. КРИТИЧЕСКИЕ КОМПОНЕНТЫ ПЦР При практическом использовании ПЦР, по крайней мере, три характеристики данного метода важны для исследователя: • Специфичность реакции – продуктом ПЦР должен быть именно тот локус ДНК, который амплифицировали, других продуктов от ПЦР быть не должно (при этом не обращают внимание на ошибочно включенные, в результате работы полимеразы, нуклеотиды);
• •Точность синтеза ДНК – ошибки в амплификафии недопустимы при определении первичной структуры аплифицированного локуса, или при использовании продукта ПЦР для синтеза кодируемого им белка в генно-инженерных системах экспресии; • • • Эффективность синтеза ДНК – количественно оценивается по выходу продукта после окончании реакции. Теоретически через n циклов количество продуктов ПРЦ достигнет 2n-1 штук с каждой молекулы кДНК. Однако на практике такое происходит редко. ДИЗАЙН ПРАЙМЕРОВ В большинстве случаев необходимая длина праймеров составляет 18-30 нт, но для некоторых исследований применяют более длинные праймеры. Дизайн праймеров в настоящее время во многом облегчен благодаря специализированным компьютерным программам. Но ни одна из них не освобождает исследователя от необходимости мыслить при решении собственных задач. 1-Температура отжига праймера: ГЦ-состав праймера определяет температуру отжига праймера на кДНК и должен находится в пределах 35-65% (идеально 45-55%). Хотя состав праймера определяется первичной структурой кДНК, в случае если состав матрицы оказывается сильно смещенным в сторону А-Т или Г-Ц пар, допускается добавление к 5’-концу праймера нескольких Г-Ц или А-Т остатков, не комплементарных матрице. Для расчета температуры отжига праймеров используют следующую формулу: [4(Г+Ц)+2(А+Т)]-5оС, при длине праймера ≤ 20 нт, или 62,5 + 0,41оС(%Г-Ц) при длине праймера ≥ 20 нт.; 2-Желательно, чтобы температуры отжига пары праймеров для ПЦР совпадали, хотя допускается различие в 4-6оС; 3-При выборе мест отжига праймеров на матрице необходимо избегать участков, которые в одноцепочечной форме образуют вторичную структуру; 4-Для эффективной ПЦР не требуется полной комлементарности матрице, хотя полное соответствие желательно. В связи с этим допускается присоединение к 5’-концам праймеров участков, заключающих сайты рестрикции, кодоны инициации и терминации транскрипции; 5-Включение Г или Ц остатков на 3’-конец праймера повышает вероятность неспецифичного отжига праймера на матрице; 6-Недопустима самокомлементарность праймеров, особенно в 3’-концевых областях, так как это приводит к образованию димеров праймеров и уменьшению их эффективности; 7-Ионные условия при проведении ПЦР должны подбираться индивидуально для каждой новой пары праймеров 8-Стандартные концентрации праймеров в реакционной смеси составляют 0,1-1 мкМ, увеличение концентрации обычно в большинстве случаев дает хорошие результаты, однако это делает дороже пробу.
Методология ПЦР подразумевает использование термостабильных ДНК-полимераз. Выбор конкретной полимеразы зависит от целей конкретного эксперимента. ДНК-полимеразы, с более высокой точностью синтезирующие ДНК, как правило, обладают 3’ → 5’ экзонуклеазной активностью. Несмотря на высокую точность действия этих ферментов, только с ними не работают по ряду причин. Основная из них – неспецифический гидролиз праймеров, происходящий под действием корректирующей эндонуклеазы. Использование Taq-полимеразы в смеси (50:1) с более корректно работающими ферментами позволяет уменьшить скорость деградации праймеров и значительно повысить точность синтеза ДНК. Увеличение концентрации фермента в пробе приводит к увеличению вероятности появления в смеси неспецифический продуктов реакции
|
||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 255; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.239.77 (0.008 с.) |
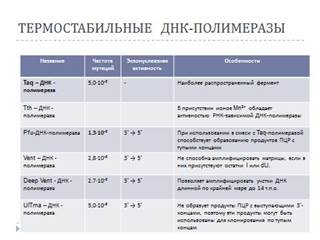 Полимеразы
Полимеразы


