
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Материальный баланс химических процессов .
Материальный баланс химических процессов – это расчет количеств загруженных и полученных веществ на каждой стадии технологического процесса с выводом расходных коэффициентов по сырью и определением составов и количеств отходов и сточных вод. Полученные данные служат исходными величинами для определения числа единиц необходимого оборудования, его размеров и производительности, а также для составления энергетических расчетов оборудования и определения расходов энергии на технологические нужды. Материальные расчеты проводят, опираясь на вещественное выражение закона сохранения массы вещества, согласно которому во всякой замкнутой системе масса веществ, вступивших в реакцию, равно массе веществ, образовавшихся в результате этой реакции:
С лайд№11 до далее Слайд№12. Материальные расчеты проводят по уравнению основной суммарной реакции с учетом параллельных и побочных реакций. Материальные расчеты составляют для отдельных стадий или для процесса в целом. При этом учет массы веществ производится отдельно для твердой, жидкой и газовой фаз, поэтому в общем виде материальные балансы, например, для реакции:
Или
можно записать в следующем виде:
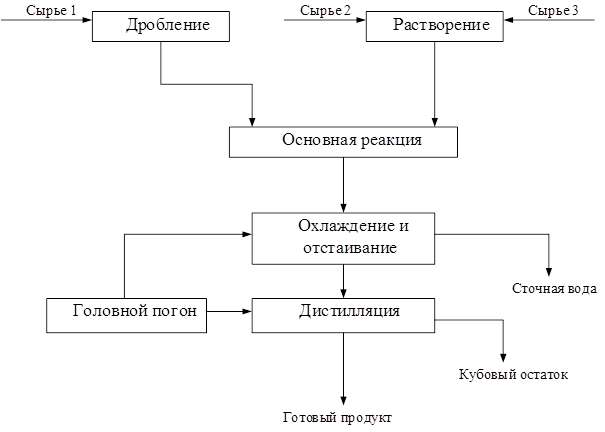
В этом уравнении ma и mb – масса веществ А и В в начале процесса; mr и ms – масса веществ R и S образующихся в результате процесса; В химической технологии различают теоретический и практический материальный баланс. Теоретический материальный баланс составляется на основе стехиометрических уравнений реакций, протекающих в рассматриваемом процессе, и молярных масс компонентов этих реакций. Практический материальный баланс отражает реальное положение дел в рассматриваемом процессе. Степень отклонения его показателей от теоретически возможных величин с одной стороны, характеризует уровень реализуемой технологии, а с другой – является движущей силой на пути его совершенствования. При составлении материальных балансов сложных производств, связанных с рециркуляцией сырья, растворителей, промывных вод, целесообразно составлять схему материальных потоков, на которой в наглядной форме представлены направления потоков сырья и промежуточных продуктов (рис. 1.2) Материальный расчет может быть составлен в кг, кг/час.
Однако в действительности при химических реакциях вещества расходуются и образуются в мольных соотношениях и поэтому для материальных расчетов более удобно их количества выражать в молях (моль/час). Эти две величины, как известно, связаны между собой следующим соотношением:
где m – масса вещества в г или кг; М – солярная масса в г/моль или кг/кмоль; n – количество вещества в молях или кмолях. С лайд№12 до далее Слайд№13
Рис. 1.2 Схема материальных потоков. С лайд№13 до далее Слайд№14
Для количества веществ, выраженных числом молей уравнение (1.22) написать нельзя, так как во многих случаях во время реакции число молей изменяется. Однако, для любой реакции простой или сложной оказывается можно ввести понятие полноты химической реакции (μ), через которую можно легко рассчитать материальный баланс в молях. В частности, для простой реакции:
верно следующее равенство:
При этом величина μ будет всегда положительна и инвариантна в отношении участников реакции. Из уравнения (1.23) вытекает уравнение материального баланса Тогда:
по которому, зная ni ,0 и ni для одного из веществ, можно вычислить по формуле (1.23) значение μ, и затем по уравнению (1.24) мольные количества других веществ. Так, например, полагая, что 3С6Н10 = 2С6Н12+С6Н6 является простой реакцией можно вычислить мольные количества всех компонентов реакции, если известно,
По уравнению (1.24) определяем Полученные результаты сводим в таблицу материального баланса. В случае сложных реакций расчет материального баланса значительно усложняется. Это связано с тем, что до начала расчета материального баланса необходимо определить число независимых реакций и равное ему число ключевых веществ. С лайд№14 до, далее Слайд№15. Таблица 1.1 Материальный баланс процесса получения бензола. Компонент
|
М, кг/кмоль |
Приход |
Расход | |||||||||||||||||
| кмоль | кг | кмоль | кг | ||||||||||||||||||
| С6Н10 | 82,146 | 12,0 | 985,752 | 3,0 | 246,438 | ||||||||||||||||
| С6Н12 | 84,162 | - | - | 6,0 | 504,972 | ||||||||||||||||
| С6Н6 | 78,114 | - | - | 3,0 | 234,342 | ||||||||||||||||
| Σ | - | 12,0 | 985,752 | 12,0 | 985,752 | ||||||||||||||||
При этом стехиометрически независимыми реакциями можно считать такие реакции, уравнения которых нельзя получить комбинацией уравнений других реакций (сложением, вычитанием, умножением стехиометрического коэффициента на постоянный множитель). В большинстве случаев это легко сделать исключением из системы сложной реакции зависимых реакций.
Так в системе сложных реакций дегидратации этанола:
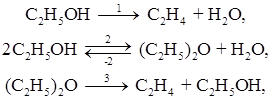
исключив реакцию -2 (как обратимую, зависимую от реакции 2) и 3 (уравнение которой можно получить вычислением уравнения 2 из уравнения 1) находим, что система имеет только две независимые реакции, то есть:
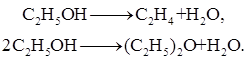
В более сложных случаях для определения числа независимых реакций обычно используют методы матричной алгебры, составляя стехиометрическую матрицу, строки и столбцы которой соответствуют реакциям и веществам. Определяют ранг матрицы, соответствующий числу независимых реакций. С лайд№15 до, далее Слайд№16.
Таблица 1.2 Стехиометрическая матрица процесса дегидратации этанола.
| № реакции | Вещество | |||
| С2Н5ОН | (С2Н5)2О | С2Н4 | Н2О | |
| 1 | -1 | 0 | +1 | +1 |
| 2 | -2 | +1 | 0 | +1 |
| -2 | +2 | -1 | 0 | -1 |
| 3 | +1 | -1 | +1 | 0 |
Примечание: ранг матрицы – это наивысший порядок минора матрицы, отличного от нуля. Здесь ранг матрицы равен 2, то есть числу независимых реакций.
Выбор ключевых веществ, как правило, осуществляется совместно с определением независимых реакций. Ключевые вещества определяются тем, чтобы в каждой независимой реакции участвовало хотя бы одно ключевое вещество, и в то же время выбранные ключевые вещества участвовали бы в одной или некотором минимуме независимых реакций. Анализ выше приведенной системы показывает, что ключевыми веществами являются (С2Н5)2О и С2Н4.
После анализа сложной системы превращений, то есть выбора независимых реакций и ключевых веществ достаточно легко провести ее материальный расчет. Для каждой независимой реакции по аналогии с (1.23) можно записать:
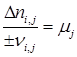 , ,
| (1.25) |
где i –соответствует веществу, j – реакции.
Тогда, имея в виду, что каждое вещество может участвовать в нескольких реакциях Δ ni = Σ Δ ni , j, получаем:
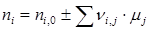 . .
| (1.26) |
Зная Δ ni ,0 и ni для ключевых веществ, можно в начале по уравнению (1.25) найти μj, а зачем полный состав реакционной массы по уравнению (1.26).
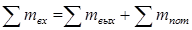 .
.

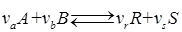
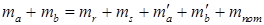 .
.
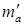 и
и 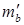 – масса веществ А и В не вступившие в реакцию по различным причинам; m пот – технологические потери.
– масса веществ А и В не вступившие в реакцию по различным причинам; m пот – технологические потери.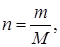
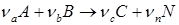
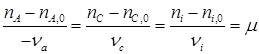 .
.
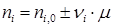 ,
,
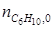 = 12 кмоль;
= 12 кмоль; 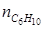 = 3 кмоль. Тогда по уравнению (1.23) находим:
= 3 кмоль. Тогда по уравнению (1.23) находим: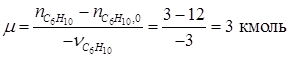 .
.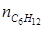 = 0 + 2∙ μ = 0 + 2∙3=6 кмоль;
= 0 + 2∙ μ = 0 + 2∙3=6 кмоль; 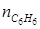 = 0 + +1∙ μ = 0 + 1∙3=3 кмоль.
= 0 + +1∙ μ = 0 + 1∙3=3 кмоль.


