
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Если реакция протекает без изменения мольного объема, то
где СА,0, СА – концентрации исходного вещества А в начале и конце процесса в моль/л, кмоль/м3. С лайд№7 до далее Слайд№8 Выход продукта – это отношение массы полученного целевого продукта к его массе, которое должно быть получено по стехиометрическому уравнению. Например, для реакции А→R.
где fR – выход целевого продукта; mR – масса продукта в конце процесса; mR , max – максимально возможное количество продукта R. Однако в случае, когда mR , max = m А,0, а mR = m А,0 - m А для необратимых реакций значение fr имеет:
Для обратимых реакций важным понятием понятием является равновесная степень конверсии; для реакции А↔R она описывается уравнением
где xA * - равновесная степень конверсии; m А * - масса реагента А в состоянии равновесия. Для обратимых реакций mR , max = mR *, поэтому:
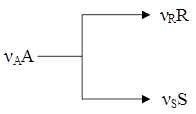
где mR * - масса продукта в состоянии равновесия. С лайд№8 до далее Слайд№9 Селективностью по продукту SR называется отношение количества целевого продукта к общему количеству получаемых продуктов. Селективность характеризует процессы, в которых протекают сложные параллельные и последовательные реакции с получением нескольких продуктов, что часто встречается на практике. Например, для реакции:
если целевым является продукт R, то селективность будет выражается в виде
где SR – селективность по продукту R; mR – масса продукта R, образовавшегося по целевой реакции. Селективность по направлению
где n (A → R) – соответствует количеству исходного реагента A, израсходованного на целевую реакцию; nR – количество, образовавшегося продукта R. С лайд№9 до далее Слайд№10 Скорость химической реакции определяется количеством прореагировавшего исходного вещества или продукта реакции в единицу времени в единице объема системы.
Например, скорость реакции А→R выражается уравнением:
или
где rA и rR – скорости реакции по реагенту A и R; nA и nR – число молей прореагировавшего вещества А и образовавшегося вещества R; τ – время реакции. Для реальных процессов число молей nA и nR может быть отнесено к объему реакционной смеси в реакторе (V см), к массе (mkt) или объему (Vkt) катализатора в случае гетерогенно-каталитических процессов.
Если объем системы не изменяется в течение реакции, тогда:
Однако скорость реакции зависит от концентрации реагирующих веществ и температуры. Скорость реакции А→R, первого порядока имеет вид:
где k - константа скорости реакции. С лайд№10 до далее Слайд№11 Подставив в уравнение (1.17) значение CA = СА,0 (1-хА) получим:
Для реакции второго порядка 2 А→R имеем
Или
|
|||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 78; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.253.152 (0.004 с.) |
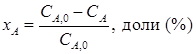 ,
,
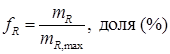 ,
,
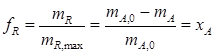 ,
,
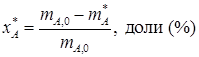 ,
,
 ,
,
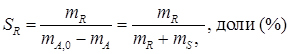 ,
,
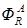 выполняется по мольным количествам (или мольным потокам), например:
выполняется по мольным количествам (или мольным потокам), например: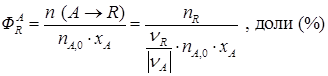 ,
,


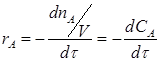 .
.
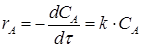 ,
,
 .
.




