
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Институт математики, физики и информационных технологийСтр 1 из 4Следующая ⇒
Институт математики, физики и информационных технологий Кафедра «Общая и теоретическая физика»
Потемкина С.Н.
КУРС ЛЕКЦИЙ ПО ФИЗИКЕ
3й семестр Модуль 6
Лекция9 Теория атома водорода по Бору. Уравнение Шредингера
2021 Глава 24. Теория атома водорода по Бору Электрон, находящийся на одной из этих орбит, несмотря на то, что он движется с ускорением, не излучает электромагнитных волн. Эти орбиты называются стационарными. II ой постулатБора: излучение испускается или поглощается в виде светового кванта энергии ħω при переходе электрона из одного стационарного состояния в другое. Энергия светового кванта равна:
где m и n – номера состояний электрона, Условие для стационарных орбит:
(n = 1, 2, 3,...) Число n -называется главным квантовым числом. Существование дискретных энергетических уровней подтверждается опытами Франка и Герца. Выведем формулу для расчета радиуса n ой допустимой (разрешенной) орбиты. Ньютоновское уравнение для электрона, движущегося по орбите радиуса rn со скоростью V имеет вид:
Исключив из (43.2) и (43.3) V, получим:
где (n = 1, 2, 3, …) Если n = 1, то rmin = 5,29·10-11м. Радиус первой орбиты водородного атома называется боровским радиусом.
Боровский радиус имеет значение порядка газокинетических размеров атома. Внутренняя энергия атома слагается из кинетической энергии электрона (ядро неподвижно) и энергии взаимодействия электрона с ядром:
Из (43.3) получаем:
тогда:
Подставив (43.4) в (43.8), получим:
(n = 1, 2, 3,...) Частоту спектральной линии, излучаемой при переходе водородного атома с уровня с номером m на уровень с номером n, определяет соотношение (43.10):
Энергетическое состояние с n=1 называется основным состоянием; состояния с n>1 называются возбужденными. Энергетический уровень, соответствующий основному состоянию атома, называется основным (нормальным) уровнем; все остальные уровни являются возбужденными. Вычисленные по формуле (43.10) частоты спектральных линий водород-ного атома оказываются в превосходном согласии с экспериментальными данными.
Недостатком теории Бора является то, что она не была ни последова-тельно классической, ни последовательно квантовой теорией.
Вопросы для повторения
Фотоны
Было экспериментально доказано существование особых световых частиц — квантов (фотонов). Энергия фотонов определяется:
где h» 6,62 ´ 10-34 Дж ∙ с — постоянная Планка h / 2p = ħ» 1,05 ´ 10-34 Дж ∙ с
Из теории относительности следует, что соотношение (45.1), (45.2) и (45.3) справедливы для частиц, у которых масса покоя равна нулю. Свойства фотонов:
Т.к. w = 2 pc / l, то для импульса фотона получаем:
Или в векторной форме записи:
где
Произведение неопределенностей значений двух сопряженных переменных не может быть по порядку величины меньше половины постоянной Планка.
Следовательно, для х и р, а также для W и t можно записать
Волновая функция
С 1900 по 1920 г - создание квантовой механики. Её создание связано с: 1) формулировкой М. Планком квантовой гипотезы в 1900 г; 2) работами австрийского физика Э. Шредингера, немецкого физика В. Гейзенберга и английского физика П. Дирака. На этом этапе возникли новые принципиальные проблемы, например, проблема физической природы волн де Бройля. Для выяснения этой проблемы сравним дифракцию световых волн и микрочастиц. Согласно волновым представлениям о природе света, интенсивность дифракционной картины пропорциональна квадрату амплитуды световой волны.
А согласно фотонной теории, интенсивность определяется числом фотонов, попадающих в данную точку дифракционной картины. Т.е. число фотонов в данной точке дифракционной картины задается квадратом амплитуды световой волны, в то время как для одного фотона квадрат амплитуды определяет вероятность попадания фотона в ту или иную точку. Дифракционная картина для микрочастиц также характеризуется неодинаковым распределением потоком микрочастиц по разным направлениям. Наличие max в дифракционной картине с точки зрения волновой теории означает, что эти направления соответствуют наибольшей интенсивности волн де Бройля. Соотношение неопределенностей Гейзенберга обусловлено корпускулярно-волновой природой микрообъектов и указывает, в какой мере можно пользоваться понятиями классической механики применительно к микрообъектам. Например, для макрочастицы размером 1 мкм неопределенности значений x и Vx оказываются за пределами измерения этих величин, так что ее движение будет практически неотличимо от движения по траектории. Пример: Рассмотрим движение электрона в электронно-лучевой трубке. Пусть след электронного пучка на экране имеет радиус r =10-2 мм, длина трубки l = 100мм; тогда Δ px / px ≈ 10-4м. При U = 104В энергия электрона равна 104эВ=1,65·10-15 Дж. Оценим импульс электрона:
Следовательно, Δ px = 5·10-23·10-4 = 5·10-27кг·м/с, тогда:
Уравнение Шредингера
В 1926 г. развивая идеи де Бройля о волновых свойствах вещества, Шредингер получил свое уравнение. Оно позволяет найти волновые функции частиц, движущихся в различных силовых полях.
где m - масса частицы, i - мнимая единица, U - потенциальная энергия, Δ - оператор Лапласа. Результат действия оператора Лапласа на некоторую функцию представляет собой сумму вторых частных производных по соответствующим координатам:
Из (49.1) следует, что вид волновой функции определяется функцией U, т.е. характером сил, действующих на частицу. Уравнение Шредингера является основным уравнением релятивистской механики. Оно не может быть выведено из других соотношений. Шредингер установил свое соотношение, исходя из оптико-механической аналогии. Для одномерного случая уравнение Шредингера имеет вид:
Это уравнение (49.3) совпадает c уравнением (48.1), если U =0. Если же частица движется в силовом поле, характеризуемом потенциальной энергией U, то энергия и импульс связаны соотношением:
Уравнение Шрёдингера в этом случае имеет вид:
Для стационарного силового поля (постоянного во времени) Ψ не зависит от t, тогда:
где E – полная энергия частицы. Тогда дифференциальное уравнение принимает вид:
Сократив на общий множитель exp[-i(E/ħ)t], придем к дифференциальному уравнению, определяющему функцию φ:
Уравнение (49.8) называется – уравнение Шредингера для стационарных состояний. Это уравнение часто записывают в виде (49.9):
В случае стационарного силового поля волновая функция имеет вид (49.6), и тогда:
так что плотность вероятности равна Институт математики, физики и информационных технологий
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 52; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.200.211 (0.023 с.) |
 ,
,
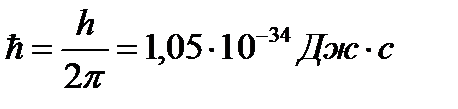 .
.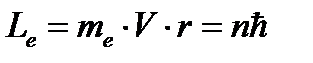 ,
,
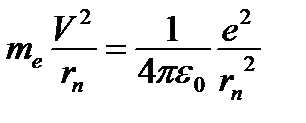 .
.
 ,
,
 .
.
 .
.
 ,
,
 .
.
 ,
,
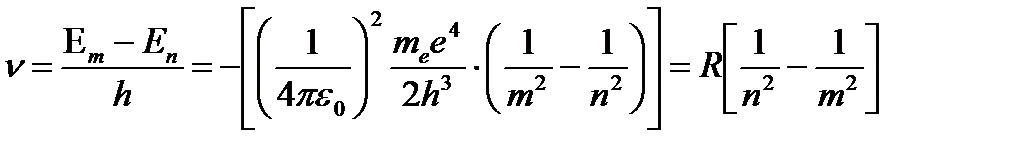 ,
,
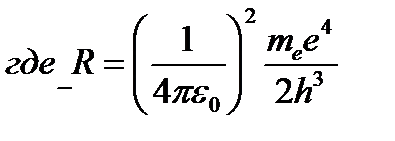 – постоянная Ридберга.
Для водородоподобного атома (43.9) имеет вид:
– постоянная Ридберга.
Для водородоподобного атома (43.9) имеет вид:
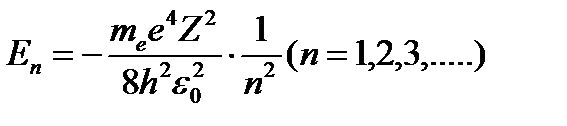 (43.11)
(43.11)
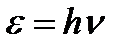 ,
,
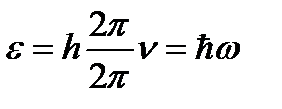 ,
,
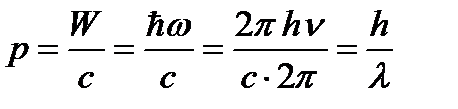 .
.
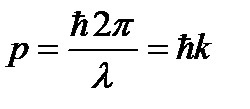 ,
,
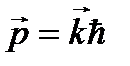 ,
,
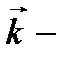 волновой вектор.
волновой вектор.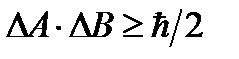 .
.
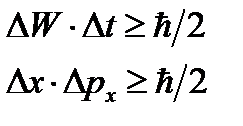 .
.
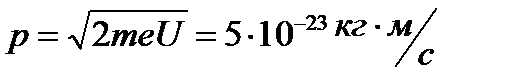 .
.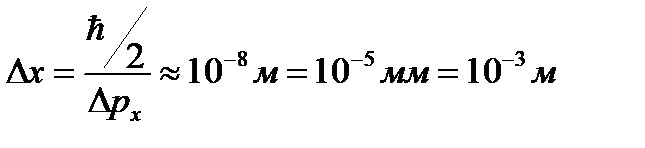
 ,
,
 .
.
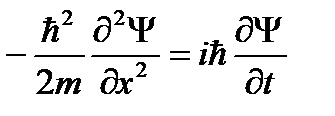 .
.
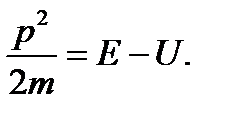
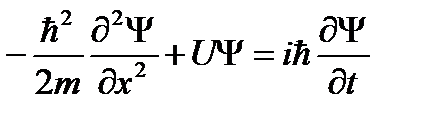 .
.
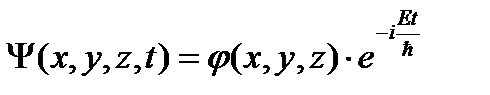 ,
,
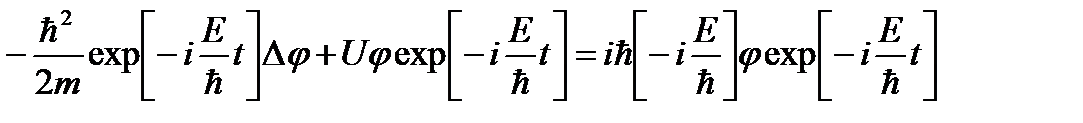 .
.
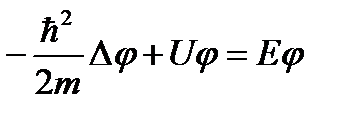 .
.
 .
.
 ,
,
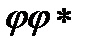 и, следовательно, от времени не зависит.
и, следовательно, от времени не зависит.


