Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Синтезы на основе ацетилена и этилена .
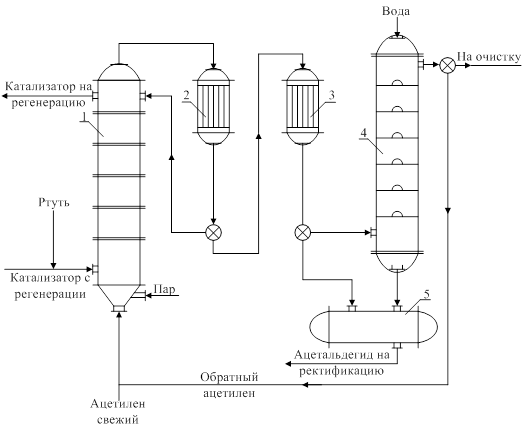
Ацетальдегид (альдегид уксусной кислоты) – бесцветная, легко испаряющаяся жидкость, температура кипения которой 21°С. Ацетальдегид отличается резким запахом, хорошо смешивается с водой и спиртом; с воздухом образует взрывоопасные смеси (4-57%(об.) CH3CHO). По масштабам производства ацетальдегид занимает одно из первых мест среди альдегидов, он является промежуточным продуктом органического синтеза. Из него получают уксусную кислоту, уксусный ангидрид, кротоновый ангидрид, н-бутиловый спирт и др. По одной из схем (рис. 6.23) очищенный от примесей ацетилен смешивают с циркуляционным газом и непрерывно подают в гидратор 1, где он нагревается до 80-100°С. Барботируя через катализатор-жидкость, содержащую сульфаты железа и ртути (в 1 л H2O: 200г H2SO4, 0,4г Hg, 40г оксидов железа) ацетилен на 50-60% превращается в ацетальдегид
Газы, содержащие ацетальдегид, ацетилен и примеси охлаждаются сначала в холодильнике 2 (здесь частично конденсируются пары воды и конденсат возвращается в гидратор 1), а затем в холодильник 3, где пары ацетальдегида и воды конденсируются, собираются в сборнике 5 и далее направляются на ректификацию (на схеме не показано). Несконденсированные газы, содержащие ацетилен, поступают в колонну 4, орошаемую водой. Здесь извлекаются остатки ацетальдегида, а непрореагировавший ацетилен вновь возвращается в процесс. Для очистки оборотного газа от окислов углерода и азота часть его (10%) непрерывно отбирается из цикла и направляется на очистку. Выход ацетальдегида составляет около 96%. Ртуть и ее соединения, входящие в состав катализатора, ядовиты, поэтому в настоящее время разрабатывается нертутные катализаторы в виде окислов Zn, Mg, Ni, Cо, C. Ацетилен, в свою очередь, получают из карбида кальция и термическим расщеплением углеводородов. По первому способу сплавлением окиси кальция и углерода в электродуговых печах получают карбид кальция,
который затем разлагают водой с образованием ацетилена:
Рис. 6.23. Схема получения ацетальдегида гидратацией ацетилена: 1 – гидратор; 2, 3 – холодильники; 4 – очистительная колонна; 5 – сборник. Из 1 кг чистого карбида кальция теоретически образуется 380 л С2Н2, однако, поскольку в техническом карбиде кальция содержатся примеси, выход ацетилена снижается до 230-250 л.
По второму способу ацетилен получают расщеплением углеводородов при высоких температурах:
Ацетальдегид полученный гидратацией ацетилена широко применяется для получения уксусной кислоты. Уксусная кислота (безводная) плавится при 16,6°С и кипит при 118°С. Она растворима во многих органических веществах и смешивается с водой в любых соотношениях. Уксусная кислота находит широкое применение в текстильной и пищевой промышленности, а также является промежуточным продуктом при получении монохлоруксусной кислоты, сложных эфиров, винилацетата и т.д. Окисление ацетальдегида кислородом воздуха с целью получения уксусной кислоты происходит в присутствии солей марганца (ацетат марганца) при 60-80°С:
Образующаяся в качестве промежуточного продукта надуксусная кислота взрывоопасна, поэтому парогазовую смесь разбавляют азотом. Синтетическую кислоту очищают от примесей перегонкой. Техническая кислота после перегонки содержит 97-99% CH3COOH, 0,1-0,5% HCOOH, 0,2-0,5% H2O. Этиловый спирт (этанол) – кипит при 78,3°С; с водой спирт образует азеотропную смесь, содержащую 95,6% C2H5OH, кипящую при 78,1°С. Этиловый спирт широко применяется в пищевой и медицинской промышленности, является компонентом жидкостного ракетного топлива, антифризов и т.д. Особенно широко этанол используется как полупродукт органического синтеза и, в частности, для получения сложных эфиров, хлороформа, хлораля, ацетальдегида, бутадиена и других продуктов. Ранее этиловый спирт получали из пищевого сырья – картофельного крахмала и некоторых зерновых кислот, однако этот способ связан с большими запретами пищевого сырья. Кроме того, его получают гидролизом древесины (гидролизный спирт). В настоящее время этанол в основном получают сернокислотной и прямой гидратацией этилена.
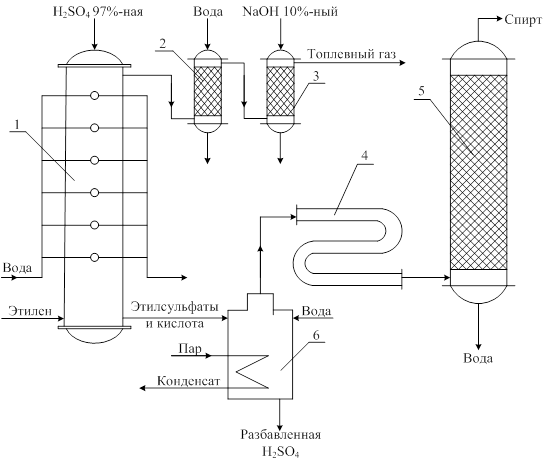
Рис. 6.24. Схема производства этилового спирта сернокислотной гидратацией этилена: 1 – тарельчатый абсорбер; 2, 3 – скрубберы; 4 – холодильник; 5 – колонна; 6 – гидролизер. При сернокислотном способе получения этанола (рис. 6.24) этилен под давлением 1.5-2.5 Мпа поступает в абсорбер 1 барботажного типа, орошаемый 97%-ной серной кислотой. Температура в абсорбере 65-75°С. Серная кислота в этом процессе является одновременно катализатором и реагентом.
Этилен взаимодействует с серой кислотой с образованием моноэтилсульфата (C2H5O)2SO2:
Газы, не поглощенные в абсорбере 1, проходят водяной 2 и щелочной 3 скрубберы и далее могут быть использованы как топливо. Этилсульфаты и серная кислота из абсорбера 1 поступают в гидролизер 6, в который подается вода. В гидролизере при давлении 1 Мпа и температуре 70-90°С происходит гидролиз этилсульфатов:
Пары спирта и воды далее проходят холодильник 4, где они конденсируются; конденсат поступает в ректификационную колонну 5 для разгонки и очистки от примесей. Разбавленная кислота (50%) выводится из гидролизера, направляется на концентрирование и снова возвращается в процесс. При ректификации концентрация этилового спирта достигает 95-96%. Синтез этанола прямой гидратацией этилена, как правило, проводят в паровой фазе, в присутствии катализатора – ортофосфорной кислоты (40-85% H3PO4), которой пропитывают алюмосиликаты, силикагель. Реакция взаимодействия этилена с водой обратима и протекает с выделением тепла
следовательно, процесс желательно проводить при низких температурах. Однако степень превращения этилена в этанол лимитируется скоростью реакции и активностью катализатора. Влияние температуры на степень конверсии этилена показано на рис. 6.25. На практике процесс ведут при температуре 280-290°С.
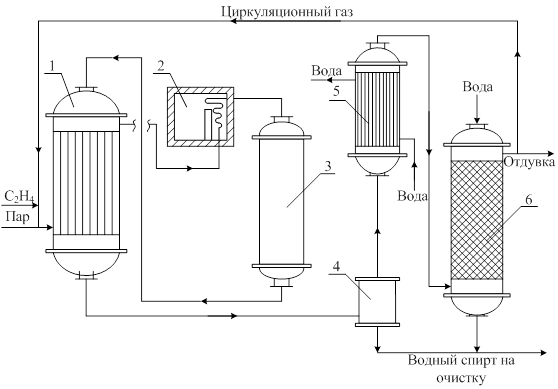
Повышение давления сдвигает равновесие в сторону образования этанола (рис. 6.25), поэтому в системе поддерживают давление около 7-8 МПа. Выход этанола зависит также от мольного соотношения H 2 O:С2Н4, времени контакта и объемной скорости. Прямую гидратацию этилена проводят по циклической схеме (рис. 6.27). Этилен сжатый компрессором до 7-8 МПа, смешивается с циркуляционным газом и паром высокого давления, после чего проходит теплообменник 1 и трубчатую печь 2, где смесь нагревается до 280°С и направляется в контактный аппарат 3. При прохождении смеси через катализатор образуются пары спирта. Выходящая из контактного аппарата 3 парогазовая смесь охлаждается в теплообменнике 1. Сконденсировавшиеся пары воды и спирта отделяются от газа в сборнике 4, откуда спирт-сырец (15-16% C2H5OH) поступает на очистку.
Непрореагировавший этилен проходит водяной холодильник 5 и колонну с насадкой 6, орошаемую водой для извлечения спирта, и поступает на смешение с новой порцией этилена.
Рис. 2.27. Схема производства этилового спирта гидратацией этилена в паровой фазе: 1 – теплообменник; 2 – трубчатая печь; 3 – контактный аппарат; 4 – сборник; 5 – холодильник; 6 – промывная колонна.
|
||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 292; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.9.141 (0.006 с.) |
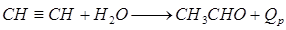 .
. ,
,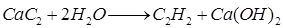 .
.

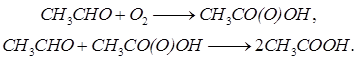
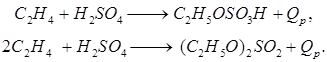

 ,
,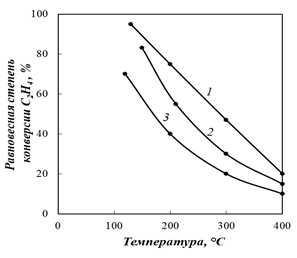 Рис. 6.25. Зависимость равновесной конверсии этилена в спирт от температуры и давления:
1 – при 20 Мпа; 2 – при 50 МПа; 3 – при 80 МПа
Рис. 6.25. Зависимость равновесной конверсии этилена в спирт от температуры и давления:
1 – при 20 Мпа; 2 – при 50 МПа; 3 – при 80 МПа
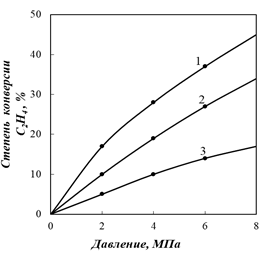 Рис. 6.26. Зависимость равновесной степени конверсии этилена в спирт от давления и температуры при соотношении H2O:С2Н4 = 1:1:
1 – при 200°С; 2 – при 250°С; 3 – при 300°С.
Рис. 6.26. Зависимость равновесной степени конверсии этилена в спирт от давления и температуры при соотношении H2O:С2Н4 = 1:1:
1 – при 200°С; 2 – при 250°С; 3 – при 300°С.