
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
При этом принято считать, что еслиСодержание книги Поиск на нашем сайте
Представление о том, на сколько глубоко может протекать обратимая химическая реакция, можно получить на основании данных о равновесии этой реакции. В состоянии равновесия, к которому стремятся практически все химические реакции, скорости прямой и обратной реакции становятся одинаковыми, а соотношение концентраций компонентов реакции в рассматриваемой системе остается неизменным. Слайд№2.11 до. Далее слайд 2.12: Так, например, условия равновесия реакции - для прямой реакции:
- для обратной реакции:
- в состоянии равновесия при r1=r2:
где k 1 и k 2 – константы скорости прямой и обратной реакции. Отсюда следует, что:
где КС – константа равновесия, выраженная через концентрации реагирующих веществ. слайд№2.12 до. В зависимости от того, в каких единицах выражаются концентрации реагирующих веществ, константа равновесия принимает различное значение. Далее слайд 2.13: При взаимодействии газов константу равновесия обычно выражают через парциальные давления реагирующих газовых компонентов. Например, для реакции:
Имеем:
Следует отметить, что для данного случая
где ∆ν = (ν R + ν S) – (ν A + ν B) – изменение числа молей газов в результате реакции. слайд№2.13 до. С целью наиболее полного использования сырья желательно вести технологический процесс в таких условиях, чтобы получить наиболее высокую равновесную степень конверсии x * исходного вещества. Основными параметрами, влияющими на равновесие химических реакций, является температура, давление и концентрация реагирующих веществ. Далее слайд 2.14: Влияние температуры. Для того чтобы определить влияние температуры на состав равновесной смеси обычно устанавливают функциональную зависимости r = f (K). Вид этой зависимости определяется типом химической реакции. Например, для простой обратимой реакции Зависимость скорости простой обратимой экзотермической реакции типа
где r – скорость суммарной реакции; k 1 и k 2 – константы скорости прямой и обратной реакции. Для анализа уравнения (2.21) подставим в него:
и получим:
Или
Слайд№2.14 до. Из уравнения (2.24) следует, что для некоторой постоянной xA с повышением температуры суммарная скорость реакции с одной стороны должна возрастать за счет увеличения величины Далее слайд 2.15: при повышении температуры скорость вначале увеличивается, достигает максимального значения, а затем снижается (рис. 2.7).
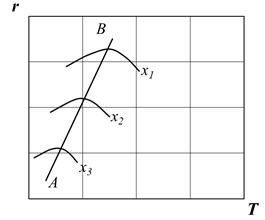
Из уравнения (2.24) так же следует, что при увеличении xA (при прочих равных условиях) суммарная скорость реакции снижается (рис. 2.8). Поэтому для случая, когда x 2 > x 1 кривая зависимости r 2 = φ (T) располагается ниже кривой, соответствующей x 1, а кривая зависимости r 3 = φ (T) располагается еще ниже. Прямая АВ при этом является линией оптимальных температур (ЛОТ). слайд№2.15 до. Далее слайд 2.16: Для простой обратимой эндотермической реакции типа
слайд№2.16 до. Далее слайд 2.17: Обычно для оценки влияния температуры на эффективность протекания обратимых реакций устанавливают функциональную зависимость х* от константы равновесия: x *=f(KP). Вид этой зависимости определяется типом химической реакции. Например, для простой обратимой реакции
Константа равновесия этой реакции выражается уравнением:
где Определим значения Для рассматриваемой реакции имеем:
где Р – общее давление. Слайд№2.17 до. Далее слайд 2.18: Подставив в уравнение (2.25) полученные значения
Откуда:
Для реакции
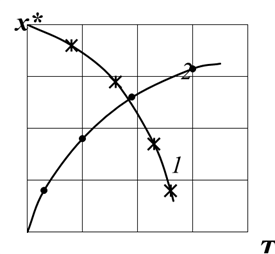
Следует отметить, что зависимость x *=f(KP) является одной из самых главных показателей в химической технологии, поскольку величина х* характеризует максимально возможное извлечение целевых продуктов из перерабатываемого сырья. Вид функциональной зависимости x *=f(KP) для реакций, протекающих с выделением тепла, х* уменьшается при повышении температуры, а для реакций, идущих с поглощением тепла – возрастает. Такой характер зависимости вытекает из уравнений 2.29 и 2.30. слайд№2.18 до. Далее слайд 2.19: Влияние температуры на равновесие, т.е. функциональную зависимость KP = f (T), можно выразить также уравнением изобары Вант-Гоффа, которое имеет вид:
После интегрирования этого уравнения в пределах изменения температуры от Т1 до Т2 и при условии, что
Для определения константы равновесия при значительном изменении температуры (более 100К) применяют эмпирическое уравнение типа:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 92; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.105.230 (0.008 с.) |

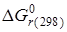 >0 – наиболее вероятное течение реакции справа налево;
>0 – наиболее вероятное течение реакции справа налево;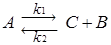 можно записать следующим образом
можно записать следующим образом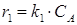 ,
,
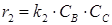 ,
,
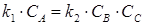 ,
,
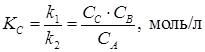 ,
,
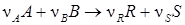
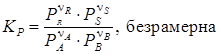 .
.
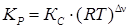 ,
,
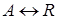 , протекающей в газовой фазе зависимость r = f (K Р) может быть получена следующим путем.
, протекающей в газовой фазе зависимость r = f (K Р) может быть получена следующим путем.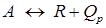 выражается уравнением:
выражается уравнением: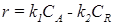 ,
,
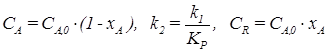 ,
,
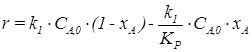
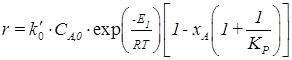 .
.
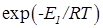 , а с другой стороны снижается так как для экзотермической реакции константа равновесия уменьшается при повышении температуры и, следовательно, возрастает 1/КР и уменьшается множитель в квадратных скобках. В связи с этим
, а с другой стороны снижается так как для экзотермической реакции константа равновесия уменьшается при повышении температуры и, следовательно, возрастает 1/КР и уменьшается множитель в квадратных скобках. В связи с этим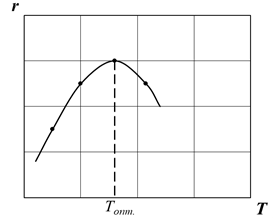
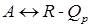 характер зависимости r = φ (T) также может быть установлен на основе уравнения (2.24). При повышении температуры скорость реакции возрастает за счет увеличения как значения
характер зависимости r = φ (T) также может быть установлен на основе уравнения (2.24). При повышении температуры скорость реакции возрастает за счет увеличения как значения 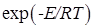 так и значения КР. При увеличении хА (при прочих равных условиях) общая скорость реакции снижается (рис. 2.9).
так и значения КР. При увеличении хА (при прочих равных условиях) общая скорость реакции снижается (рис. 2.9).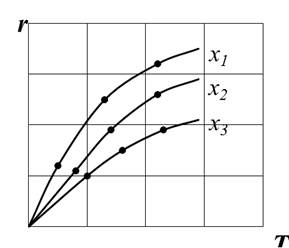
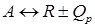 зависимость x *=f(KP) может быть получена следующим путем.
зависимость x *=f(KP) может быть получена следующим путем.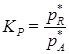 ,
,
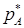 ,
, 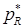 - парциальное давление вещества A и R в состоянии равновесия.
- парциальное давление вещества A и R в состоянии равновесия.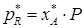
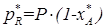 ,
,
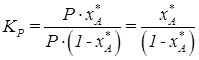 .
.
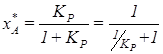 .
.
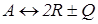 аналогично можно получить:
аналогично можно получить: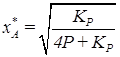 .
.
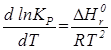 .
.
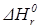 не зависит от Т, получаем:
не зависит от Т, получаем: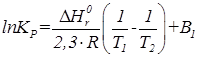 .
.
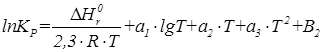 .
.



