
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В практических расчетах часто пользуются приближенными уравнением ⇐ ПредыдущаяСтр 4 из 4
где В справочной литературе имеются значения константы равновесия или коэффициенты в приведенных уравнениях для многих реакций. Если же эти сведения отсутствуют, значения констант равновесия находят экспериментально. Для этого опытным путем для каждой рассматриваемой реакции в состоянии равновесия определяют концентрации (парциальные давления) исходных веществ и продуктов при нескольких температурах. Подставив эти данные, например, в уравнение (2.25), находят кинетическую константу равновесия Kc (Kp). Далее слайд 2.20: Влияние концентрации и давления. Концентрация реагирующих веществ оказывает сильное влияние на равновесный выход целевых продуктов, что вытекает из закона действующих масс. Например, для реакции:
протекающей в жидкой фазе:
При увеличении концентрации исходных реагентов, т.е. при увеличении знаменателя, соответственно, возрастает числитель (поскольку при данной температуре КС величина постоянная). С другой стороны, при уменьшении концентрации продуктов, т.е. при уменьшении числителя, соответственно, снижаются концентрации исходных веществ, т.е. увеличивается степень их переработки. Оба эти фактора используются на практике для сдвига равновесия в сторону получения целевого продукта, и, следовательно, для увеличения его выхода. Характер влияния давления на равновесие химических реакций определяется законом разности числа молей газообразных участников реакции Δ n или законом изменения объема Δ V. Для газовых реакций, в которых число молей продуктов превышает число молей реагентов, т.е. Δ n >0, увеличение давления неблагоприятно. Смещению равновесия реакции вправо способствует снижение давления. Если же реакция протекает с уменьшением числа молей (Δ n < 0), повышение давления целесообразно – оно повышает выход продуктов. слайд№2.20 до. Далее слайд 2.21: Введение инертного газа в систему при Р= const подобно эффекту уменьшения общего давления, что следует из закона Дальтона:
где pi – парциальное давление i -го компонента; Ni – мольная доля i -го компонента; P – общее давление в системе. Вопросы и упражнения для самостоятельной Проработки материала 1. По каким признакам классифицируют химические реакции? Перечислите их.
2. От каких факторов зависит скорость химической реакции. Запишите полное кинетическое уравнение. 3. Напишите уравнение основного закона кинетики для простой необратимой и обратимой реакции. 4. Для каких целей используются в химической технологии изобарно-изотермический потенциал Δ G? Приведите примеры. 5. В каких единицах измерения выражается кинетическая константа равновесия? Свои соображения подтвердите примерами. 6. Как влияет температура на скорость обратимой реакции 7. При постоянной температуре протекают две параллельные реакции 8. Каким уравнением описывается зависимость термодинамической константы равновесия от температуры? Приведите его. 9. В гомогенной химической реакции участвуют два реагента А и В. Реакция имеет первый порядок по А и второй по В. Увеличение концентрации какого реагента даст больший эффект увеличения скорости реакции. 10. При температуре 748К константа скорости реакции составляет 3,2·105 ч-1. Определите константы скорости этой реакции при температуре 793К, если ее энергия активации Е = 87,9 кДж/моль. Сравните эти константы скорости. 11. Напишите уравнение Вант-Гоффа и прокомментируйте его. 12. Как влияют температура и давление на равновесие обратимых химических процессов? Приведите примеры.
|
|||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 78; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.246.203 (0.008 с.) |
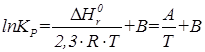 ,
,
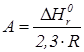 . слайд№2.19 до.
. слайд№2.19 до.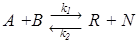 ,
, .
.
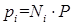 ,
,
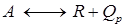 . Для этого случая выведете зависимость r = f (xA, Kp).
. Для этого случая выведете зависимость r = f (xA, Kp). ;
; 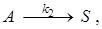 характеризующиеся значениями констант скорости k 1 = 10-3 с-1; k 2 = 10-2 с-1. Перед началом реакции СА,0 = 2 кмоль/м3, С R ,0 = С S ,0 = 0. Определите значения скорости химической реакции по исходному реагенту А (rA) и продукту S в момент времени, когда С R = 0,05кмоль/м3, С S = 0,5кмоль/м3.
характеризующиеся значениями констант скорости k 1 = 10-3 с-1; k 2 = 10-2 с-1. Перед началом реакции СА,0 = 2 кмоль/м3, С R ,0 = С S ,0 = 0. Определите значения скорости химической реакции по исходному реагенту А (rA) и продукту S в момент времени, когда С R = 0,05кмоль/м3, С S = 0,5кмоль/м3.


