
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рубидий — элемент № 37 . Его относительная атомная масса равна 85 .
В ядре атома рубидия — 37 протонов и 85 – 37 = 48 нейтронов. Нуклиды Вид атомов с определённым числом протонов и нейтронов в ядре называется нуклидом. Нуклид обозначается следующим образом: внизу слева записывается число протонов Z (порядковый номер), вверху слева указывается массовое число A (сумма чисел протонов и нейтронов) — R ZA, например: C 612, Se 3479.
Для обозначения нуклидов используют и другие способы записи:
углерод — 12, C — 12, C 12;
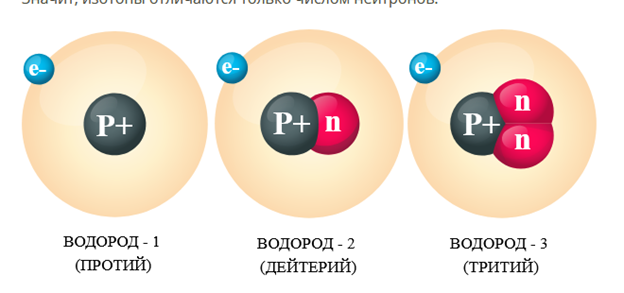
селен — 79, Se — 79, Se 79. Изотопы Атомы одного и того же химического элемента могут иметь разные массы. Существуют атомы водорода с массами 1, 2 и 3, атомы хлора с массами 35 и 37 и т. д. Разновидности атомов одного химического элемента, имеющие разные атомные массы, называют изотопами. С учётом знаний о строении ядра это определение можно сформулировать по-другому. Изотопы — разновидности атомов с одинаковым числом протонов в ядре (зарядом ядра), но разным числом нейтронов. Значит, изотопы отличаются только числом нейтронов.
Протоны определяют свойства атома, то есть придают ему индивидуальность. А нейтроны не влияют на свойства атома, а отражаются на его массе. Поэтому все изотопы одного и того же элемента химически неотличимы. Химический элемент — это вид атомов с определённым зарядом ядра. Относительная атомная масса элемента Большинство химических элементов существуют в виде смеси изотопов. Приведённая в Периодической таблице относительная атомная масса элемента — это средняя величина атомных масс всех его изотопов.
Пример: определим относительную атомную массу хлора. 25 % его атомов — это атомы с массой 37, а 75 % — с массой 35. Найдём среднее значение:
A r (Cl)=(37⋅25+35⋅75)100 = 35,5.
Состояние электрона в атоме Электрон в атоме находится в постоянном движении вокруг ядра.
Для описания состояния электрона оценивается вероятность его нахождения в околоядерной области пространства и используются понятия «электронное облако», «электронная орбиталь». Электронное облако — модель движения электрона в атоме; область пространства, в каждой точке которой может находиться данный электрон.
Электронное облако Электронная орбиталь — область околоядерного пространства, в которой вероятность нахождения электрона более
Электронные орбитали имеют разную форму. В атоме водорода орбиталь единственного электрона имеет форму шара. Это
В атомах других элементов электроны могут находиться на гантелеобразных
Известны и более сложные по форме орбитали.
Электронные орбитали различаются размерами. Размер зависит от энергии электрона. Чем больше энергия электрона, тем больше по размеру его орбиталь, и тем дальше он находится от ядра.
Обрати внимание!
|
|||||
|
Последнее изменение этой страницы: 2021-04-13; просмотров: 165; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.124.232 (0.005 с.) |
 %.
%. -орбиталь.
-орбиталь.
 -орбиталях.
-орбиталях.



