
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Предпосылки открытия периодического законаСтр 1 из 5Следующая ⇒
Предпосылки открытия периодического закона По мере открытия новых химических элементов учёные пытались их разделить на группы по общим признакам. Деление элементов на металлы и неметаллы Такое разделение основывалось на различиях в свойствах простых веществ и соединений.
Металлы:
Неметаллы:
Но классификация элементов на металлы и неметаллы оказалась недостаточной, когда были изучены свойства таких элементов, как цинк и алюминий. Как известно, соединения этих элементов амфотерны, то есть проявляют и кислотные, и основные свойства. Значит, им характерны свойства и металлов, и неметаллов; это переходные элементы. Естественные семейства элементов Были обнаружены группы элементов, близких по свойствам. Среди металлов выделялись своей активность щелочные металлы, а среди неметаллов — галогены. Щелочные металлы (литий Li, натрий Na, калий K, рубидий Rb, цезий Cs):
2 Li + 2 H 2 O = 2 LiOH + H 2↑, 2 K + 2 H 2 O = 2 KOH + H 2↑.
Na 2 O + H 2 O = 2 NaOH, K 2 O + H 2 O = 2 KOH.
Галогены (фтор F, хлор Cl, бром Br, иод I):
2 Na + Cl 2= 2 NaCl, 2 Na + Br 2= 2 NaBr.
H 2+ F 2= 2 HF, H 2+ I 2= 2 HI.
Попытки систематизации химических элементов
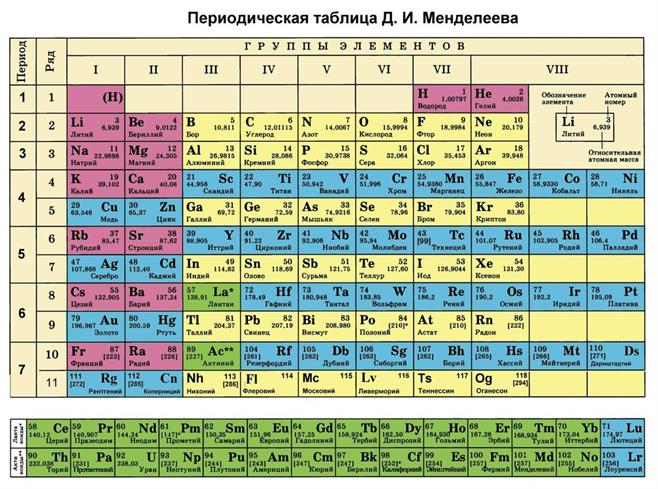
Формы Периодической таблицы
Короткая форма Периодической таблицы Большие периоды поделены на ряды.
Каждая группа делится на главную и побочную подгруппы.
28 элементов третьей группы (лантаноиды и актиноиды) расположены внизу таблицы.
К лантаноидам относятся 14 элементов шестого периода (№ 58 — № 71).
К актиноидам относятся 14 элементов седьмого периода (№ 90–103).
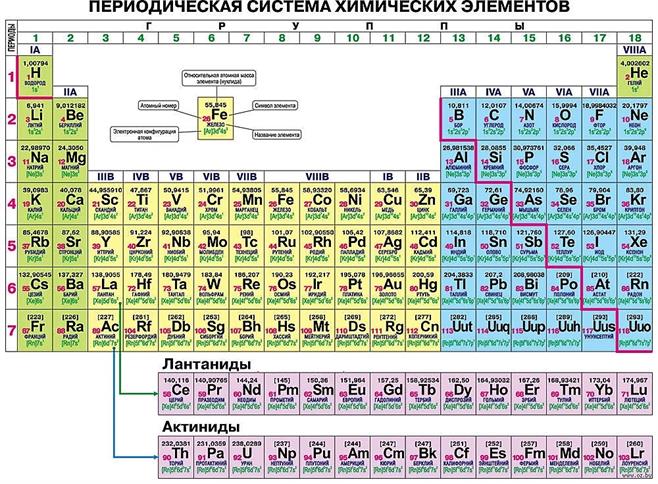
Полудлинный вариант Выделены группы A и B. Между IIA и IIIA группами расположены группы B. Лантаноиды и актиноиды — под таблицей.
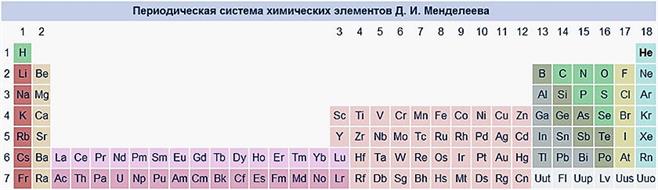
Длинный вариант Лантаноиды и актиноиды включены в таблицу. Каждый период представлен одним рядом элементов.
Строение ядра атома Состояние электрона в атоме Электрон в атоме находится в постоянном движении вокруг ядра.
Для описания состояния электрона оценивается вероятность его нахождения в околоядерной области пространства и используются понятия «электронное облако», «электронная орбиталь». Электронное облако — модель движения электрона в атоме; область пространства, в каждой точке которой может находиться данный электрон.
Электронное облако Электронная орбиталь — область околоядерного пространства, в которой вероятность нахождения электрона более
Электронные орбитали имеют разную форму. В атоме водорода орбиталь единственного электрона имеет форму шара. Это
В атомах других элементов электроны могут находиться на гантелеобразных
Известны и более сложные по форме орбитали.
Электронные орбитали различаются размерами. Размер зависит от энергии электрона. Чем больше энергия электрона, тем больше по размеру его орбиталь, и тем дальше он находится от ядра.
Обрати внимание! Предпосылки открытия периодического закона По мере открытия новых химических элементов учёные пытались их разделить на группы по общим признакам. Деление элементов на металлы и неметаллы Такое разделение основывалось на различиях в свойствах простых веществ и соединений.
Металлы:
Неметаллы:
Но классификация элементов на металлы и неметаллы оказалась недостаточной, когда были изучены свойства таких элементов, как цинк и алюминий. Как известно, соединения этих элементов амфотерны, то есть проявляют и кислотные, и основные свойства. Значит, им характерны свойства и металлов, и неметаллов; это переходные элементы. Естественные семейства элементов Были обнаружены группы элементов, близких по свойствам. Среди металлов выделялись своей активность щелочные металлы, а среди неметаллов — галогены. Щелочные металлы (литий Li, натрий Na, калий K, рубидий Rb, цезий Cs):
2 Li + 2 H 2 O = 2 LiOH + H 2↑, 2 K + 2 H 2 O = 2 KOH + H 2↑.
Na 2 O + H 2 O = 2 NaOH, K 2 O + H 2 O = 2 KOH.
Галогены (фтор F, хлор Cl, бром Br, иод I):
2 Na + Cl 2= 2 NaCl, 2 Na + Br 2= 2 NaBr.
H 2+ F 2= 2 HF, H 2+ I 2= 2 HI.
Попытки систематизации химических элементов
|
||||||
|
Последнее изменение этой страницы: 2021-04-13; просмотров: 125; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.168.172 (0.01 с.) |
 %.
%. -орбиталь.
-орбиталь.
 -орбиталях.
-орбиталях.



