Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Значение и развитие периодического закона
Открытие периодического закона и создание Периодической таблицы химических элементов имеет огромное значение для развития науки.
Периодический закон:
Сам Дмитрий Иванович Менделеев, предвидя развитие науки, писал: «Периодическому закону будущее не грозит разрушением, а только надстройка и развитие обещаются». Развитие периодического закона Во времена Д. И. Менделеева основным свойством атомов химических элементов считалась атомная масса. Периодический закон в формулировке Д. И Менделеева звучит так: Свойства элементов, а также состав и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величин их атомных масс. Позже было изучено строение атома, и стало ясно, что основной характеристикой атома химического элемента является не величина его атомной массы, а величина положительного заряда ядра. Периодический закон стали формулировать иначе. Современная формулировка выглядит следующим образом: Свойства химических элементов и образуемых ими веществ находятся в периодической зависимости от величин зарядов ядер их атомов. Заряды ядер атомов элементов, расположенных в ряд, возрастают непрерывно. Объяснить причины периодичности учёные смогли тогда, когда изучили строение электронных оболочек атомов. Причиной периодического изменения свойств химических элементов и образуемых ими веществ является периодически повторяющееся строение наружных энергетических уровней электронных оболочек атомов.
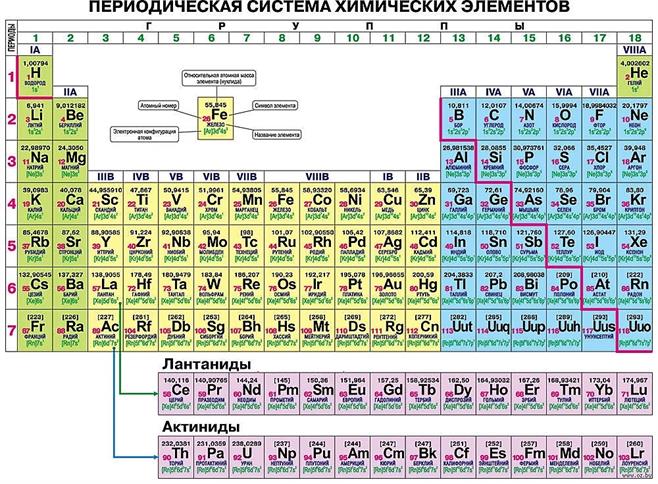
Периодическая таблица Графическим отображением периодического закона является Периодическая система химических элементов. Известно более 700 форм периодической таблицы. Официальным по решению Международного союза химиков является её полудлинный вариант.
Каждому химическому элементу в таблице отведена одна клеточка, в которой указаны символ и название элемента, порядковый номер и относительная атомная масса.
Ломаная линия обозначает границу между металлами и неметаллами.
Последовательность расположения элементов не всегда совпадает с возрастанием атомной массы. Есть несколько исключений из правила. Так, относительная атомная масса аргона меньше атомной массы калия, в теллура — меньше, чем иода.
Каждый элемент имеет свой порядковый (атомный) номер, располагается в определённом периоде и определённой группе. Период — горизонтальный ряд химических элементов, начинающийся щелочным металлом (или водородом) и заканчивающийся инертным (благородным) газом. В таблице семь периодов. В каждом содержится определённое число элементов:
1-й период — 2 элемента, 2-й период — 8 элементов, 3-й период — 8 элементов, 4-й период — 18 элементов, 5-й период — 18 элементов, 6-й период — 32 элемента (18+14), 7-й период — 32 элемента (18+14).
Три первых периода называют малыми периодами, остальные — большими. И в малых, и в больших периодах происходит постепенное ослабление металлических свойств и усиление неметаллических, только в больших периодах оно происходит более плавно.
Элементы с порядковыми номерами 58–71 (лантаноиды) и 90–103 (актиноиды) вынесены из таблицы и располагаются под ней. Это элементы IIIB группы. Лантаноиды относятся к шестому периоду, а актиноиды — к седьмому.
Восьмой период появится в Периодической таблице, когда будут открыты новые элементы. Группа — вертикальный столбец химических элементов, имеющих сходные свойства. В Периодической таблице 18 групп, пронумерованных арабскими цифрами. Часто используют нумерацию римскими цифрами с добавлением букв A или B. В таком случае групп 8.
Группы A начинаются элементами малых периодов, включают также и элементы больших периодов; содержат и металлы, и неметаллы. В коротком варианте Периодической таблицы это главные подгруппы.
Группы B содержат элементы больших периодов, и это только металлы. В коротком варианте Периодической таблицы это побочные подгруппы.
Число элементов в группах: IA, VIIIA — по 7 элементов; IIA — VIIA — по 6 элементов; IIIB — 32 элемента (4+14 лантаноидов +14 актиноидов); VIIIB — 12 элементов; IB, IIB, IVB — VIIB — по 4 элемента.
Количественный состав групп будет изменяться по мере добавления в таблицу новых элементов.
Римский номер группы, как правило, показывает высшую валентность в оксидах. Но для некоторых элементов это правило не выполняется. Так, фтор не бывает семивалентным, а кислород — шестивалентным. Не проявляют валентность, равную номеру группы, гелий, неон и аргон — эти элементы не образуют соединений с кислородом. Медь бывает двухвалентной, а золото — трёхвалентным, хотя это элементы первой группы.
Некоторые группы A получили особые названия:
IA — щелочные металлы (Li, Na, K, Rb, Cs, Fr); IIA (кроме бериллия и магния) — щелочноземельные металлы (Ca, Sr, Ba, Ra); VIIA — галогены (F, Cl, Br, I, At); VIIIA — благородные, или инертные, газы (He, Ne, Ar, Kr, Xe, Rn, Og).
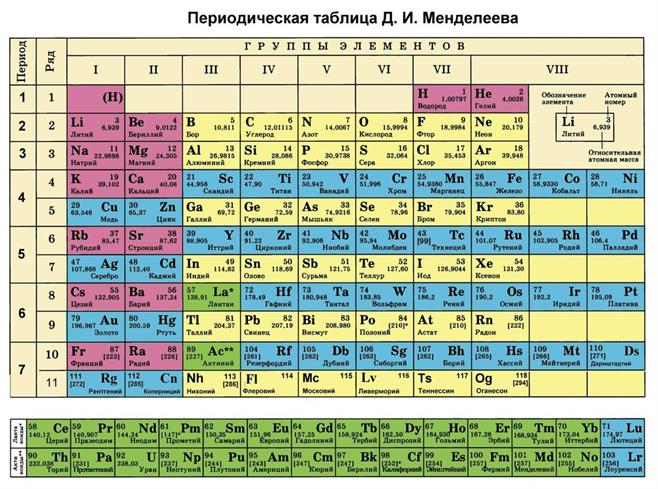
Формы Периодической таблицы Короткая форма Периодической таблицы Большие периоды поделены на ряды.
Каждая группа делится на главную и побочную подгруппы.
28 элементов третьей группы (лантаноиды и актиноиды) расположены внизу таблицы.
К лантаноидам относятся 14 элементов шестого периода (№ 58 — № 71).
К актиноидам относятся 14 элементов седьмого периода (№ 90–103).
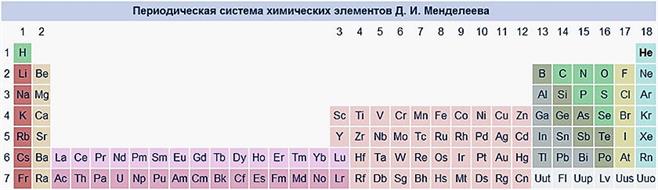
Полудлинный вариант Выделены группы A и B. Между IIA и IIIA группами расположены группы B. Лантаноиды и актиноиды — под таблицей.
Длинный вариант Лантаноиды и актиноиды включены в таблицу. Каждый период представлен одним рядом элементов.
Строение ядра атома
|
||||||
|
Последнее изменение этой страницы: 2021-04-13; просмотров: 228; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.100.180 (0.011 с.) |