Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Формы контроля (стоматология)Содержание книги Поиск на нашем сайте Промежуточный – 2 контрольные работы. Итоговый – экзамен в 1 семестре Учебно-методическое обеспечение курса I. Рекомендуемая литература (основная)
II. Дополнительная литература
Лабораторные работы Работа №1. Соли. ВНИМАНИЕ! ВСЕ РЕАКЦИИ ПРОВОДИТЬ В ПРОБИРКАХ, ПОЛЬЗУЯСЬ НЕБОЛЬШИМИ (0,5 - 1 мл) КОЛИЧЕСТВАМИ ИСХОДНЫХ ВЕЩЕСТВ!!!
1. Осуществить реакции, используя полученный углекислый газ – установка в тяге. Ca(OH)2 ® CaCO3 ® Ca(HCO3)2 ® CaCO3
2. Имея раствор соли хрома(III), получить гидроксид хрома(III) и убедиться в его амфотерности.
3. Исходя из оксида меди, получить сульфат меди(II), а затем перейти к гидроксиду меди(II). CuO ® CuSO4 ® Cu(OH)2 ¯
4. В банках N1 и N2 находятся соли: Na2CO3 и NaHCO3. Определить, какая из этих солей находится в банке N1 и какая - в банке N2.
5. Из смеси твердых соединений трех металлов - ZnCl2, MgO, BaCl2 - выделить каждый металл в виде любого индивидуального соединения.
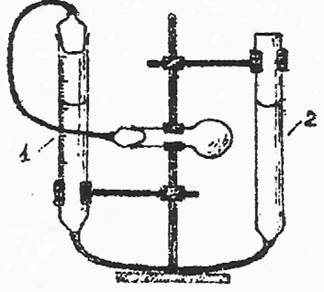
Для всех проделанных опытов написать молекулярные и ионные уравнения реакций. Работа N2. Определение атомной массы металла по объему выделившегося водорода Определение атомной массы металла по объему выделившегося водорода производится в приборе, изображенном на рисунке.
Две бюретки закрепляются в лапках штатива и соединяются друг с другом резиновой трубкой. К одной из бюреток резиновой трубкой присоединяется реакционная колба емкостью 50 - 100 мл. Чтобы приготовить прибор к работе, выньте пробку из колбы и в бюретку 2 налейте столько воды, чтобы обе бюретки были заполнены до половины своего объема.
Ход работы Проверьте герметичность прибора. Для этого закройте колбу пробкой герметично, предварительно смазав шлиф вазелином, чтобы поверхность шлифа была зеркально гладкой (без белесых продольных полос). Установите объем воды в обеих бюретках на один уровень. Опустите бюретку 2 на 10-15 см вниз. Наблюдайте за уровнем воды в бюретке 1. Если прибор герметичен, то уровень воды в бюретке 1 сначала несколько понизится, а затем останется без изменений. Убедившись в герметичности прибора, верните бюретку 2 в прежнее положение, чтобы вода в обеих бюретках была на одном уровне. Получите у преподавателя навеску металла. В колбу при помощи длинной воронки налейте 20-25 мл кислоты, указанной на доске, в зависимости от навески металла. Закрепите колбу почти горизонтально. Снимите с навески внешний слой бумаги, записав предварительно массу навески. Пакетик с навеской осторожно разрыхлите, но не разворачивайте. Поместите пакетик в сухое горло колбы. Закройте колбу пробкой и снова проверьте прибор на герметичность. Установите объем воды в обеих бюретках на один уровень, зафиксируйте V1 в мл по бюретке 1. Подождите 2-3 минуты, если объем не изменился, значит, система герметична. Наклоните колбу так, чтобы пакетик с металлом упал в кислоту, и закрепите колбу в штативе. Выделяющийся водород вытесняет воду из бюретки 1 в бюретку 2. Наблюдайте за реакцией. Бюретку 2 в течение реакции опускайте вниз, чтобы уровень воды в обеих бюретках был одинаков. Когда весь металл растворится, и понижение уровня воды прекратится, дайте колбе постоять 1-2 мин. Затем приведите положение воды в обеих бюретках точно к одному уровню. Отметьте уровень воды в бюретке 1 и запишите его значение – V2. Разность уровней равна объему выделившегося водорода. Запишите показания термометра, барометра и давление водяных паров при температуре опыта.
Давление паров воды при температуре от 15 до 26°С (мм.рт.ст.)
Вычисления 1. Объем выделившегося водорода V H2 = V2 - V1. 2. Абсолютная температура Т = 273 + t. 3. Давление водорода P(H2) = Pатм - P(H2O). 4. На основании объединенного газового закона рассчитайте объем выделившегося водорода при нормальных условиях (760 мм рт.ст. и 273 К). 5. Рассчитайте эквивалент металла. 6. На основании величины полученного эквивалента и ваших знаний химии определите, какой это металл.
|
||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 236; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.006 с.) |