Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
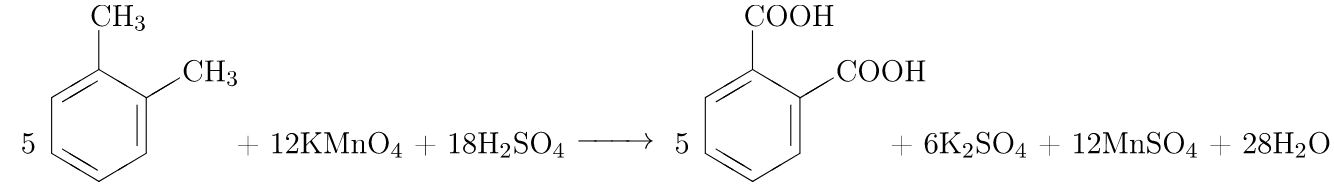
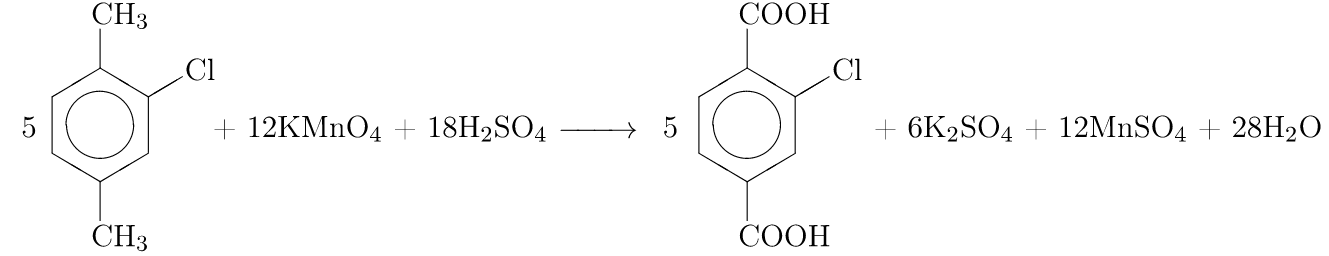
Окисление гомологов бензола.
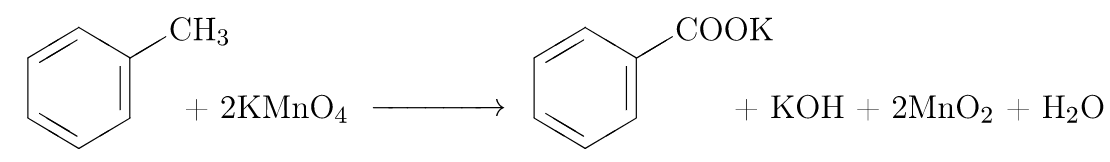
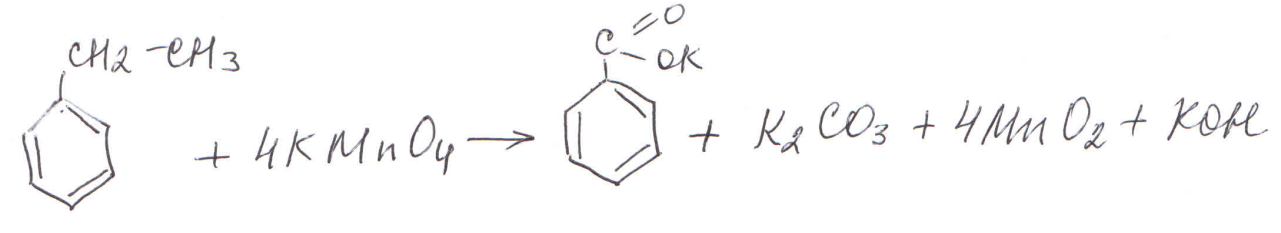
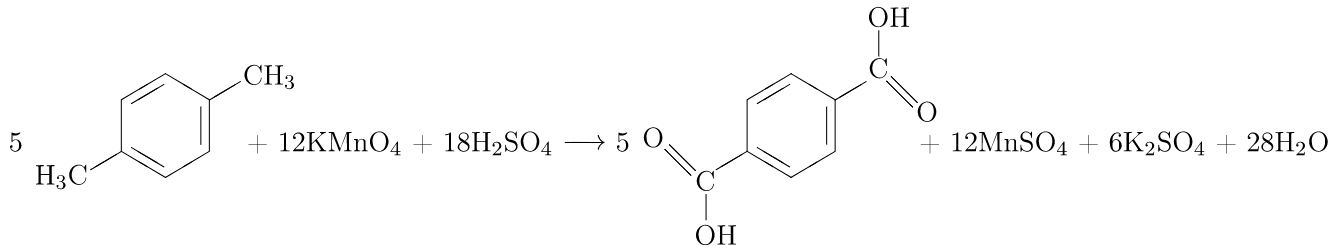
Бензол устойчив к действию традиционных окислителей – не изменяет окраску KMnO4, K2Cr2O7. Гомологи же бензола окисляются достаточно легко, причем бензольное кольцо сохраняется, окисляются боковые цепи – углеводородные радикалы. Надо запомнить следующие правила: – любой гомолог бензола с одним заместителем окисляется до бензойной кислоты или ее солей; с двумя заместителями – до двухосновных фталиевых кислот или их солей: – если окисление проходит в кислой среде – образуются кислоты, если в щелочной или нейтральной среде – соли этих кислот; – толуол в очень мягких условиях может быть окислен до бензойного альдегида (см. контекст задачи, это редкий случай):
– если в боковой цепи есть двойная связь, то в очень мягких условиях образуется двухатомный спирт, но в жестких условиях – кислоты (их соли) или кетоны (если у двойной связи третичный углерод). Разберем различные примеры реакций:
!! здесь лучше записать 2КОН + 3К2СО3 Дополнительно приведем реакции окисления производных, содержащих различные функциональные группы:
3) Окисление изопропилбензола (кумола) – промышленный способ получения фенола и ацетона (т.н. кумольный способ получения фенола). В промышленности для окисления кумола используют кислород:
изопропилбензол гидропероксид фенол ацетон (кумол) кумола
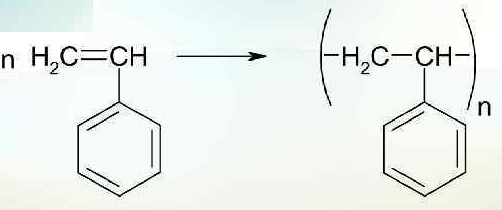
4) К реакциям боковой цепи относится полимеризация винилбензола (стирола) – образуется известнейший полимер полистирол:
стирол полистирол
Галогенсодержащие ароматические соединения Для всех производных ароматических углеводородов чрезвычайно важно, где находится функциональная группа: в боковой цепи или непосредственно связана с бензольным кольцом:
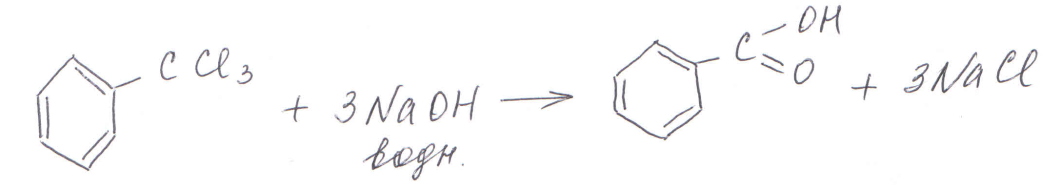
Свойства галогенпроизводых, содержащих галоген в боковой цепи, очень похожи на свойства галогеналканов. Наиболее часто в цепочках ЕГЭ встречается гидролиз галогенпроизводных – взаимодействие с водным раствором щелочи, например:
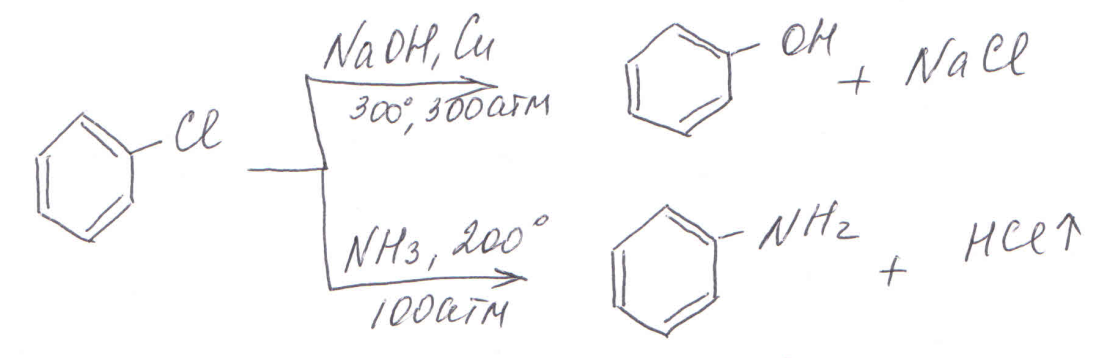
Если же галоген соединен с непосредственно с кольцом, то такие галогенпроизводные характеризуются меньшей химической активностью, галоген замещается только в очень жестких условиях, например:
Кислородсодержащие ароматические соединения
Фенолы Фенолы – это производные ароматических углеводородов, молекулы которых содержат одну или несколько гидроксильных групп –ОН, непосредственно соединенных с бензольным кольцом. Самым популярным представителем этого класса является сам фенол (гидроксибензол), устаревшее название фенола – карболовая кислота:
см. видео https://youtu.be/0hRmepJwxT0?list=PLnbQh4j9gZkKZDdTU1xVdJZ8FQIvkJCWF
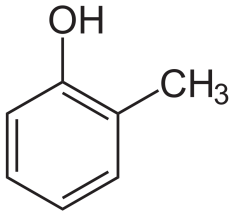
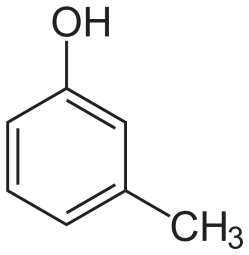
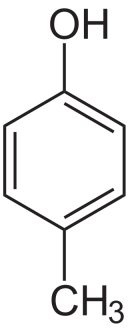
Также одноатомными (содержащие одну группу –ОН), являются крезолы:
2-метилфенол 3-метилфенол 4-метилфенол (орто-крезол) (мета-крезол) (пара-крезол)
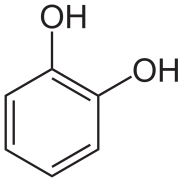
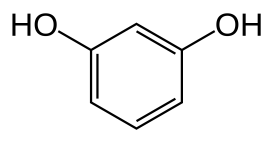
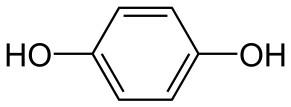
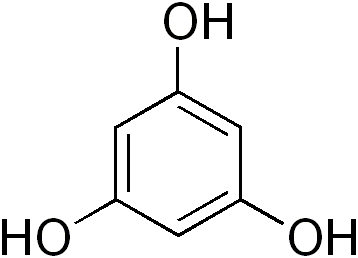
Общая формула одноатомных фенолов С n H2 n –6О или С n H2 n –7ОН. Существуют двух- и трехатомные фенолы, например (названия запоминать не нужно):
пирокатехин резорцин гидрохинон флороглюцинол (1,2-, 1,3- и 1,4-дигидроксибензолы) (1,3,5-тригидроксибензол)
Химические свойства фенолов будем разбирать на примере простейшего представителя – фенола. Химические свойства фенола и отличие свойств фенола от спиртов – популярнейшее задание ЕГЭ.
Химические свойства фенола
|
|||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 115; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.196.184 (0.009 с.) |
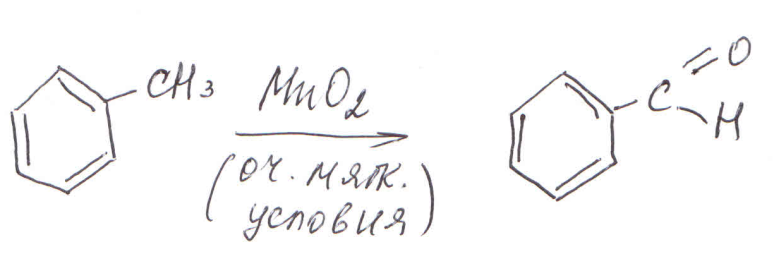



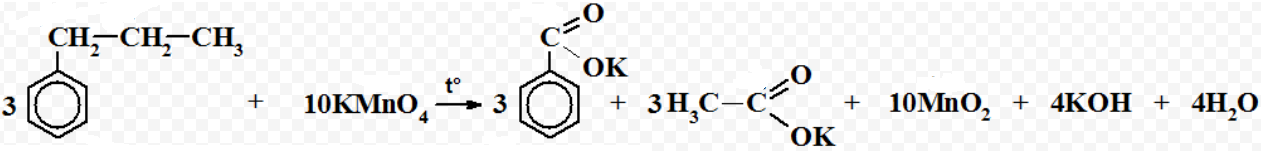









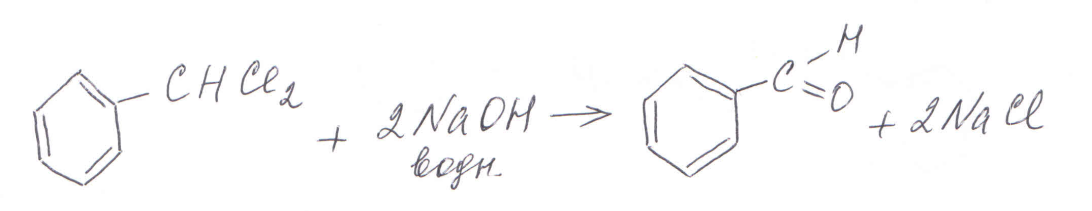

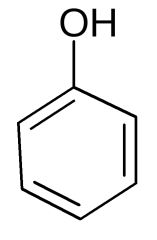 гидроксибензол / фенол / карболовая кислота
гидроксибензол / фенол / карболовая кислота