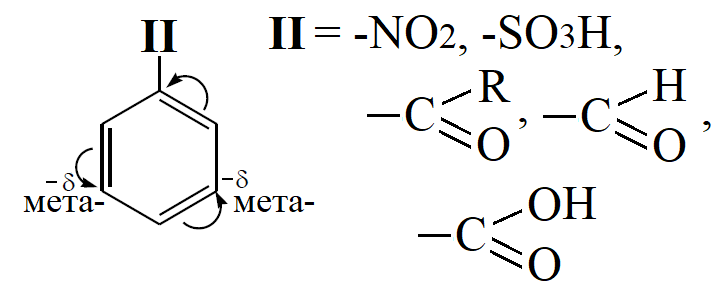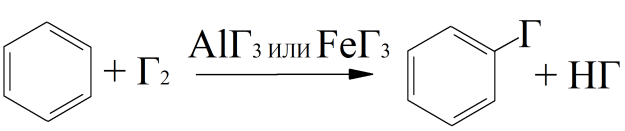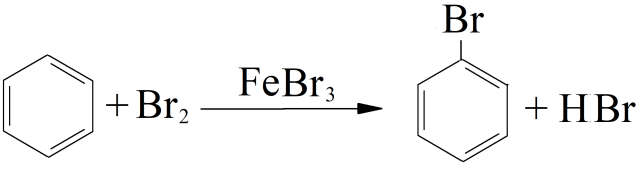Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Правила ориентации (замещения) в бензольном кольце
В молекуле бензола π-электронное облако распределено равномерно между всеми атомами углерода. Но если в бензольное кольцо ввести какой-нибудь заместитель, то равномерность распределения π-электронной плотности нарушается. В результате этого бензольное кольцо становится частично поляризованным, и место вступления нового заместителя определяется природой уже имеющегося заместителя [из https://himija-online.ru]. Пусть в положении один (у первого, верхнего атома углерода) находится электроннодонорный заместитель – так называемый заместитель I рода. К заместителям I рода относятся: все алкильные (углеводородные) радикалы –R, гидроксогруппа –ОН, аминогруппа –NH2, галогены –Cl, –Br. Они смещают электронную плотность в сторону бензольного кольца, создавая благоприятные условия для электрофильного замещения и ориентируя в орто- и пара- положения: именно там будут максимумы электронной плотности:
Если в положении один находится электронноакцепторный заместитель – так называемый заместитель II рода, то они притягивают электронную плотность от кольца к себе, частичный отрицательный заряд образуется в метаположении:
К заместителям II рода относятся: нитрогруппа –NO2, карбоксильная группа –СООН, карбонильная группа –С(О)R, сульфогруппа –SО3Н. Такие заместители уменьшают электронную плотность в бензольном кольце, тем самым затрудняя реакции электрофильного замещения.
Природный источник ароматических углеводородов – каменноугольная смола. При нагревании каменных углей в коксовых печах (коксование) при температуре 1000–1300°С без доступа кислорода, образуется кокс, коксовый газ и каменноугольная смола от 100 до 300 ароматических соединений. Бензол получают из нефти (см. алканы). Физические свойства ароматических углеводородов. Бензол и его гомологи – это жидкости со сладковатым запахом, нерастворимые в воде. Они прекрасные растворители органических веществ. см. видео https://youtu.be/dbOIS8Xmiec?list=PLnbQh4j9gZkKZDdTU1xVdJZ8FQIvkJCWF
Химические свойства ароматических углеводородов Ароматический характер бензола и других аренов выражается в том, что эти соединения, по составу непредельные, в целом ряде реакций проявляют себя как предельные: для них характерна химическая стойкость, они не склонны к присоединению, а склонны к реакциям замещения, причем электрофильного.
см. видео https://youtu.be/SdU4whofnYc?list=PLnbQh4j9gZkKZDdTU1xVdJZ8FQIvkJCWF
I. Реакции электрофильного замещения Галогенирование бензола. Ароматические углеводороды в обычных условиях не реагируют с галогенами (например, с бромной водой), но в присутствии катализаторов AlCl3, FeCl3, AlBr3, FeBr3 галоген легко замещает водород:
Если нужно провести реакцию с Cl2 – берут AlCl3 или FeCl3, если с Br2 – берут AlBr3, FeBr3, например:
Роль этих катализаторов – создание положительной, электрофильной частицы, например:
Cl2 + AlCl3 ® Cl+ + [AlCl4]–
Br2 + FeBr3 ® Br+ + [FeBr4]– См. опыт: https://youtu.be/kU_T16vk1LA
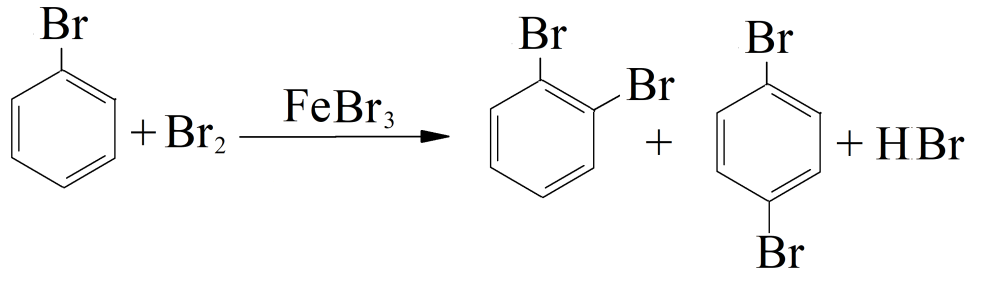
Если галоген в избытке, может быть замещен следующий водород. Здесь уже не безразлично, какой из атомов водорода будет замещен: нужно вспомнить правила ориентации (замещения) в бензольном кольце: так как галогены относятся к заместителям I рода, второй галоген размещается в орто- или пара-положении, образуется смесь продуктов:
|
|||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 169; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.219.166 (0.004 с.) |