
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Зависимость скорости реакции от температурыСодержание книги
Поиск на нашем сайте
Повышение температуры ускоряет все химические реакции. Первоначально Вант-Гофф экспериментально установил, что при увеличении температуры на каждые 10 градусов скорость возрастает в 2 ¸ 4 раза ( правило Вант-Гоффа ). Это соответствует степенной зависимости скорости от температуры:
где Т > Т0, g - температурный коэффициент Вант-Гоффа. Однако это уравнение теоретически не обосновано; экспериментальные данные лучше описываются экспоненциальной функцией (уравнение Аррениуса):
где А - предэкспоненциальный множитель, не зависящий от Т, Еа - энергия активации химической реакции (кДж/моль), R - универсальная газовая постоянная.
Уравнение Аррениуса обычно записывают для константы скорости:
Это уравнение теоретически обосновывается методами статистической физики. Качественно это обоснование состоит в следующем: так как реакции идут в результате беспорядочных столкновений молекул, то эти столкновения характеризуются практически непрерывным набором энергий от самых маленьких до очень больших. Очевидно, что реакция произойдет только тогда, когда молекулы соударяются с энергией, достаточной для разрыва (или существенного растяжения) некоторых химических связей. Для каждой системы существует порог энергии Еа, начиная с которого энергия достаточна для протекания реакции, – этому механизму как раз и соответствует кривая 1 на рисунке 1. Так как соударения происходят с частотой, зависящей от температуры по экспоненциальному закону, то и получаются данные формулы. Тогда предэкспоненциальные множители А и k0 представляют некоторую характеристику полного числа столкновений, а член Анализ экспериментальных данных проводят, пользуясь логарифмической формой уравнения Аррениуса:
График строят в так называемых аррениусовских координатах
При наличии экспериментальных данных для двух температур ko и Еа легко теоретически найти:
Скорость химической реакции в значительной мере зависит от энергии активации. Для подавляющего большинства реакций она лежит в пределах от 50 до 250 кДж/моль. Реакции, для которых Еа > 150 кДж/моль, при комнатной температуре практически не протекают
Тема 5 Катализ
Одним из наиболее распространенных в химической практике методов ускорения химических реакций является катализ. Катализатор - вещество, которое многократно участвует в промежуточных стадиях реакции, но выходит из нее химически неизменным.
Например, для реакции А2 + В2 = 2АВ участие катализатора К можно выразить уравнением
А2 + К + В2 ® А2....К + В2 ® А2...К...В2 ® 2АВ + К.
Эти уравнения можно представить кривыми потенциальной энергии (рис. 2). Рис. 2. Энергетическая схема хода реакции с катализатором и без катализатора
Из рисунка 2 видно, что: 1) катализатор уменьшает энергию активации, изменяя механизм реакции, – она протекает через новые стадии, каждая из которых характеризуется невысокой энергией активации; 2) катализатор не изменяет DН реакции (а также DG, DU и DS); 3) если катализируемая реакция обратимая, катализатор не влияет на равновесие, не изменяет константу равновесия и равновесные концентрации компонентов системы. Он в равной степени ускоряет и прямую, и обратную реакции, тем самым ускоряя время достижения равновесия.
Очевидно, в присутствии катализатора энергия активации реакции снижается на величину DЕк. Поскольку в уравнении Аррениуса энергия активации входит в отрицательный показатель степени, то даже небольшое уменьшение Еа вызывает очень большое увеличение скорости реакции: Влияние катализатора на снижение Еа можно показать на примере реакции распада иодида водорода:
2HI = H2 + I2.
Таким образом, для рассматриваемой реакции уменьшение энергии активации на 63 кДж, т.е. в 1,5 раза, соответствует повышению скорости реакции при 500 К более чем 106 раз.
Следует отметить, что предэкспоненциальный множитель каталитической реакции k01 не равен k0 и обычно значительно меньше, однако соответствующее уменьшение скорости далеко не компенсирует её увеличения за счёт Еа.
Пример. Энергия активации некоторой реакции в отсутствие катализатора равна 75,24 кДж/моль, а с катализатором - 50,14 кДж/моль. Во сколько раз возрастает скорость реакции в присутствии катализатора, если реакция протекает при 250 С, а предэкспоненциальный множитель в присутствии катализатора уменьшается в 10 раз. Решение. Обозначим энергию активации реакции без катализатора через Еа, а в присутствии катализатора - через Еа1; соответствующие константы скоростей реакций обозначим через k и k1. Используя уравнение Аррениуса (5.9) (см. раздел 5.3) и принимая k01/k0 = 10, находим:
Окончательно находим:
Таким образом, снижение энергии активации катализатором на 25,1 кДж привело к увеличению скорости реакции в 2500 раз, несмотря на 10-кратное уменьшение предэкспоненциального множителя.
Каталитические реакции классифицируются по типу катализаторов и по типу реакций. Так, например, по агрегатному состоянию катализаторов и реагентов катализ подразделяется на гомогенный (катализатор и реагент образуют одну фазу) и гетерогенный (катализатор и реагенты – в разных фазах, имеется граница раздела фаз между катализатором и реагентами).
Примером гомогенного катализа может быть окисление СО до СО2 кислородом в присутствии NO2 (катализатор). Механизм катализа можно изобразить следующими реакциями:
CO(г) + NO2(г) ® CO2(г) + NO(г) , 2NO(г) + O2(г) ® 2NO2(г);
и катализатор (NO2) снова участвует в первой реакции.
Аналогично этому может быть катализирована реакция окисления SO2 в SO3; подобная реакция применяется в производстве серной кислоты "нитрозным" способом.
Примером гетерогенного катализа является получение SO3 из SO2 в присутствии Pt или V2O5: SO2(г) + O2(г) ® SO3(г).
Эта реакция также применяется в производстве серной кислоты ("контактный" метод).
Гетерогенный катализатор (железо) применяется также в производстве аммиака из азота и водорода и во многих других процессах.
Эффективность гетерогенных катализаторов обычно намного больше, чем гомогенных. Скорость каталитических реакций в случае гомогенного катализатора зависит от его концентрации, а в случае гетерогенного - от его удельной поверхности (то есть дисперсности) - чем она больше, тем больше скорость. Последнее связано с тем, что каталитическая реакция идет на поверхности катализатора и включает в себя стадии адсорбции (прилипание) молекул реагентов на поверхности; по окончании реакции ее продукты десорбируются. Для увеличения поверхности катализаторов их измельчают или получают специальными способами, при которых образуются очень тонкодисперсные порошки.
Приведенные примеры одновременно являются примерами окислительно-восстановительного катализа. В этом случае в качестве катализаторов обычно выступают переходные металлы или их соединения (Mn3+, Pt, Au, Ag, Fe, Ni, Fe2O3 и др.).
В кислотно-основном катализе роль катализатора выполняют Н+, ОН- и другие подобные частицы - носители кислотности и основности. Так, реакция гидролиза
ускоряется примерно в 300 раз при добавлении любой из сильных кислот: HCl, HBr или HNO3. Большое значение катализ имеет в биологических системах. В этом случае катализатор называют ферментом. Эффективность действия многих ферментов намного больше, чем обычных катализаторов. Например, для реакции связывания азота в аммиак
N2 + 3H2 = 2NH3
в промышленности используется гетерогенный катализатор в виде губчатого железа с добавками оксидов и сульфатов металлов.
При этом реакция проводится при Т» 700 К и Р» 30 МПа. Этот же синтез идет в клубеньках бобовых растений под действием ферментов при обычных Т и Р.
Каталитические системы небезразличны к примесям и добавкам. Некоторые из них увеличивают эффективность катализа, как например, в вышеприведенном примере катализа синтеза аммиака железом. Такие добавки в катализатор называются промоторами (оксиды калия и алюминия в железе). Некоторые примеси, наоборот, подавляют каталитическую реакцию ("отравляют" катализатор), это каталитические яды. Например, синтез SO3 на Pt-катализаторе очень чувствителен к примесям, содержащим сульфидную серу; сера отравляет поверхность платинового катализатора. И напротив, катализатор на основе V2O5 малочувствителен к таким примесям; честь разработки катализатора на основе оксида ванадия принадлежит российскому учёному Г.К. Борескову.
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 125; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.007 с.) |

 ,
,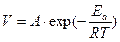 ,
,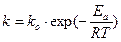 .
.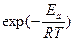 - долю результативных столкновений.
- долю результативных столкновений. .
.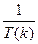 ), рис. 2; из графика находят ko и Еа.
), рис. 2; из графика находят ko и Еа.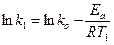 ;
;  ;
;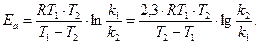

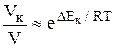 .
. (500К)
(500К)
 Отсюда
Отсюда 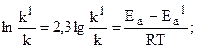

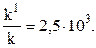

 CH3COOCH3 + H2O CH3COOH + CH3OH
CH3COOCH3 + H2O CH3COOH + CH3OH


