
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химическая кинетика и катализСтр 1 из 6Следующая ⇒
ХИМИЧЕСКАЯ КИНЕТИКА И КАТАЛИЗ ТЕМА: Химическое равновесие
Истинное и кажущееся равновесие
Многие химические реакции не протекают до конца, то есть исходные реагенты не полностью превращаются в продукты. Такие реакции начинают протекать в одном направлении, затем за счет взаимодействия продуктов реакции идут в обратном направлении, то есть являются двусторонними. Их называют химически обратимыми.
Химические реакции могут быть практически необратимыми и совершенно необратимыми. Например, реакция Н2+½ О2 = Н2О
практически необратима; лишь при температурах в несколько тысяч градусов вода распадается на Н2 и О2. Примером совершенно необратимых реакций является разложение взрывчатых веществ, для которых
Pb(N3)2 ®Pb + 3N2.
Необратимости способствуют такие условия, при которых один из продуктов является малорастворимым и выпадает в осадок, либо образуется в виде газообразного вещества, удаляемого из системы, либо является слабодиссоциирующим в реакционной среде веществом. Любая реакция может протекать самопроизвольно только в направлении, которое приближает систему к состоянию равновесия, в котором силы, вызывающие процесс, уравновешиваются.
Химическим равновесием называют не изменяющееся во времени при постоянном давлении, объеме и температуре состояние системы, содержащей вещества, способные к взаимодействию. Как было показано, при некоторой температуре энтальпийный и энтропийный факторы уравниваются, то есть
В этом случае DG = 0,что является термодинамическим условием химического равновесия. Существуют различные виды равновесных состояний.
Истинное (устойчивое, термодинамическое) равновесие системы характеризуется неизменностью во времени. При этом система изменяет состояние соответственно внешним воздействиям и его характеристики (например, концентрации) не зависят от того, с какой стороны система подходит к равновесию.
Устойчивое равновесие является динамическим. Равновесное состояние сохраняется во времени не вследствие отсутствия или прекращения процесса, а вследствие протекания его одновременно в двух противоположных направлениях с одинаковой скоростью.
Кажущееся (метастабильное, заторможенное) равновесие отличается тем, что для него выполняется только один признак – неизменность во времени. Например, смесь Н2 и О2 может практически бесконечно находиться в неизменном, метастабильном состоянии. Однако это не истинное равновесие, так как, раз начавшись (от искры или действия платинового катализатора, который при этом химически не изменяется), процесс взаимодействия идет быстро и практически до конца с выделением тепла:
H2 (г) + 1/2О2(г) = H2О (г); DНo298= -241 кДж.
Константа равновесия
Количественной характеристикой равновесного состояния является величина, называемая константой равновесия (К). В состоянии равновесия состав системы не меняется, то есть концентрации реагентов и продуктов реакции остаются постоянными (они называются равновесными). В 1864 году норвежские ученые К. Гульдберг и П. Вааге сформулировали закон действующих масс (ЗДМ): отношение произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ (реагентов) в степенях, равных стехиометрическим коэффициентам, при Т = const, является величиной постоянной. Например, для обратимой реакции
закон действующих масс имеет вид
или, если вещества – газы,
где [A], [В] и т. д. – равновесные концентрации веществ (моль/л); РА, РВ и т.д... – парциальные давления газов.
закон действующих масс имеет вид
Если все реагенты газообразны и их поведение подчиняется законам идеальных газов, то связь между КР и КС можно выразить уравнением:
где Δn - изменение числа молей газов в результате реакции; так что для рассматриваемой реакции Δn = (1 + 3) - 2 = 2 и Константа равновесия обладает тем свойством, что она не зависит от концентрации реагентов и продуктов. Это значит, что увеличение концентрации одного из веществ приводит к такому изменению концентрации других веществ, что константа равновесия остается неизменной. Если увеличить [A], то [B] уменьшится, а [C] и [D] увеличатся. В то же время константа равновесия зависит от температуры: с увеличением температуры она увеличивается для эндотермических и уменьшается для экзотермических реакций.
В выражение ЗДМ включаются только концентрации растворов, концентрации или давления газов; конденсированные вещества в собственной фазе (Н2Ож, КСlт и т.п.) в формулу не включаются. Например, для реакции
Fe2O3 (т) + 3H2 (г) = 2Fe (т) + 3H2O (ж);
Так как Fe2O3 , Fe и H2O - конденсированные вещества, то равновесие реакции зависит только от концентрации Н2. Константа равновесия - важнейшая термодинамическая характеристика реакции. По величине константы равновесия (К) можно судить о степени протекания реакции. При очень большом значении К равновесие реакции сильно сдвинуто вправо (в сторону продуктов), а при очень низком значении К реакция протекает в очень незначительной степени и равновесная смесь содержит преимущественно реагенты. Кроме того, по величине К можно вычислять концентрации реагентов и продуктов при достижении равновесия и, как будет показано ниже, DG реакции.
Основные понятия химической кинетики Термодинамика изучает только состояния систем, она не прослеживает подробно путь реакции, поэтому она определяет лишь потенциальную возможность ее протекания в определенном направлении. В уравнениях термодинамики нет такой величины как время, поэтому она не может описать скорости процессов. Скорость реакции не связана со значением энергии Гиббса (ΔG). Например, термодинамическая вероятность реакции окисления водорода до воды
Н2 + ½О2 = Н2О (ж), ΔG0298 = -237,2 кДж/моль,
значительно выше, чем вероятность реакции нейтрализации с образованием воды
Н+ + ОН- = Н2О (ж); ΔG0298 = -79,9 кДж/моль.
Однако первая реакция в обычных условиях без катализатора практически не идет, а вторая реакция протекает мгновенно.
Химическая кинетика представляет собой учение о скоростях химических реакций, о факторах, определяющих эти скорости (природы реагирующих веществ, концентрации, температуры, присутствия катализаторов и др.), а также о механизме химических реакций.
Содержание кинетики химических реакций составляют два основных раздела: 1. формально-математическое описание скорости реакции без учёта действительного механизма самой реакции, так называемая формальная кинетика; 2. учение о механизме химического взаимодействия.
В зависимости от того, в одной или нескольких фазах находятся компоненты реакции, различают кинетику гомогенных реакций и кинетику гетерогенных реакций.
Гомогенной химической реакцией называется процесс, протекающий в одной фазе. Гетерогенной реакцией называется процесс, протекающий на поверхности раздела фаз.
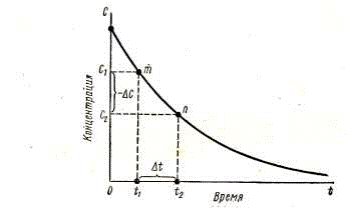
Скоростью химической реакции называется изменение количества одного из реагирующих веществ в единицу времени в единице объема, а для реакций при постоянном объеме - изменение концентрации одного из реагирующих веществ в единицу времени.
Скорость реакции может быть установлена лишь для определенного промежутка времени. Так, концентрация исходного вещества в некоторый момент времени t 1 равна с 1, в момент t 2 – c 2., то за промежуток времени D t = t 2 - t 1 изменение концентрации составит
D С = С 2 — С 1
Различают среднюю и истинную скорости.
Ṽ =±
Знак минус ставится потому, что хотя концентрация исходного вещества убывает, скорость может быть только положительной величиной. Поскольку средняя скорость реакции изменяется в интервале D t, то в химической кинетике рассматривают только истинную скорость реакции, т.е. скорость в данный момент времени, которая определяется как первая производная от концентрации по времени.
В выражение скорости по исходному веществу ставят знак минус, а по продукту реакции – плюс. Пусть имеется реакция: аА + вВ ® сС + dD, тогда между скоростями, определенными по различным веществам, существует связь:
От концентрации реагентов
Так как скорость химической реакции зависит от столкновений, а количество столкновений в единице объема, очевидно, пропорционально концентрации сталкивающихся молекул, то можно предположить, что скорость реакции пропорциональна концентрациям реагентов, то есть для необратимой простой реакции
аА + bВ +.... = сС + dD +...
(закон действующих масс для скорости химической реакции). Здесь k - константа скорости, то есть скорость реакции при
[A] = [B] = 1 моль/л.
Эти рассуждения верны лишь в том случае, если реакция элементарная (в одном столкновении участвуют а молекул А, b молекул В) и при этом сразу образуются конечные продукты С, D и т. д. Если реакция сложная, то скорость зависит не только от [A] и [В], но и от концентраций промежуточных продуктов и скоростей их расходования, так что обычно коэффициенты в уравнении реакции не совпадают с а и b (они меньше их). В этом случае кинетическое уравнение записывается:
Уравнения типа вырыжающие закон действующих масс для скорости реакции называются кинетическими уравнениями химических реакций. Константа скорости (k) не зависит от концентраций реагентов, но зависит от природы реагентов, направления реакции (природы продуктов) и от температуры. Константу скорости находят из экспериментальных данных расчетом (известны V, [A], [B]...., а, в,...)
n = kC A n × C B p.
Коэффициент пропорциональности k называется константой скорости химической реакции и численно равен скорости при концентрациях реагирующих веществ, равных единице. Размерность k зависит от природы реагирующих веществ, равных единице. Размерность k зависит от природы реакции [k] = время-1·конц1-r. Показатели степени (n, p), в которые возведены концентрации соответствующих веществ (СА и СВ), называются порядком реакции по соответствующему веществу. Общий порядок равен сумме порядков реакций по каждому веществу или сумме показателей степеней
r = n + p.
Порядок может быть целым, дробным, положительным, отрицательным и даже нулевым. Для очень многих реакций, даже сравнительно простых реакций, порядок не совпадает со стехиометрическим коэффициентом. Это объясняется тем, что реакции протекают обычно по сложным механизмам в несколько стадий, которые не находят отражения в химических уравнениях. Порядок реакции понятие формальное, поскольку в большинстве случаев не отражает механизма реакции. Определяется порядок реакции экспериментально и отражает зависимость скорости реакции от концентрации вещества.
Приведем реакции различных порядков.
Реакции нулевого порядка.
Нитрование бензола большим избытком азотной кислоты
С6H6 + HNO3 → C6H5NO2 + H2O
2HNO3 ® NO2+ NO3 ̅ + H2O – медленная
C6H6 + NO2+ → C6H5NO2 + H+ - быстрая
n= kC2 HNO k CHNO =const; n= k
Реакции первого порядка. CH3COCH3 → C2H4+H2+CO;
n = kC CH 3 COCH 3
Классическим примером реакции первого порядка в растворе является гидролитический распад тростникового сахара в воде на глюкозу и фруктозу:
C12H22O11 + H2O → C6H12O6 + C6H12O6. Согласно закону действия масс для такой реакции
n = kC C 12 H 22 O 11 × C H 2 O
но в разбавленном водном растворе количество воды, расходуемое на гидролиз, настолько незначительно, что можно её концентрацию считать постоянной.
Тогда n = kC C 12 H 22 O 11, что отвечает уравнению первого порядка.
Реакции второго порядка CH3COOC2H5 + NaOH ® CH3COONa + C2H5OH;
n = kC CH 3 COOC 2 H 5 × C NaOH CH3Br+KOH ®CH3OH+KBr;
n = kC CH Br × C KOH 3
Реакции третьего порядка. 2NO + O2 ® 2NO2;
n = kC NO 2 × C O 2
Для элементарных реакций вместо порядка реакции говорят о её молекулярности.
Молекулярность реакции равна числу частиц (молекул, радикалов, атомов), принимающих участие в элементарной реакции или элементарном акте реакции.
Коэффициенты a и b в этих уравнении носят название "молекулярность" реакции по веществу А и В, соответственно; сумма (a + b) - суммарная (общая) молекулярность простой реакции. Понятие "молекулярность" применимо только к простой реакции. Вычисления и наблюдения показывают, что (a + b) не может быть больше трех. Если для какой-либо реакции эта сумма больше трех, то можно утверждать, что реакция сложная. По количеству сталкивающихся в элементарном акте молекул реакции называют моно-, би- и тримолекулярными.
Коэффициенты aи b в уравнении для сложных реакций носят название "частный порядок" реакции по веществу А и В, соответственно, а сумма:
(a + b)=n общий порядок реакции.
Эти коэффициенты находят экспериментально, и они могут быть целыми, дробными, отрицательными и равными нулю. Порядок и молекулярность простой реакции обычно совпадают, но если, например, концентрация одного из реагентов много больше, чем других, то скорость практически не зависит от этой концентрации и, хотя в реакции участвуют все молекулы, ее порядок будет меньше молекулярности. На этом основано нахождение порядков реакций по веществам - метод понижения порядка реакции.
Молекулярность реакции всегда целочисленна, положительна и не превышает трех. Примером монолекулярных реакций могут служить реакции изомеризации (внутримолекулярной перегруппировки), термического разложения:
СНзNСНз → С2Н6 + N2 (разложение азометана);
CH3OCH3 → CH4 + H2 + CO (разложение диметилового эфира).
Примеры бимолекулярных реакций:
H2 + J2 → 2HJ;
CH3COOH + C2H5OH → CH3COOC2H5 + H2O.
Тримолекулярных реакций известно не много. Это, например, реакции
2NO + H2 → N2O + H2O;
2NO + O2 → 2NO2.
Молекулярность - это теоретическое понятие. Она отражает механизм реакции, дает представление о том какие именно и через какие стадии идет образование продуктов. В простых (элементарных) реакциях, протекающих в одну стадию порядок реакции и молекулярность совпадают и имеют целое положительное значение. Для большинства реакций порядок реакции меньше молекулярности. Порядок реакции зависит от условий (концентрации, давления) протекания процесса. Рассмотрим случаи несовпадения порядка реакции и молекулярности:
1) Большой избыток одного из реагирующих веществ.
HCOOC2H5 + H2O → HCOOH + C2H5OH;
n = kC HCOOC 2 H 5 × C H 2 O
Порядок = 1; молекулярность = 2.
2) Для гетерогенных реакций
CaO(тв) + CO2(г) → CaCO3(тв)
учитывается концентрация только газообразных веществ:
n = kC СO 2
Порядок = 1; молекулярность = 2.
ФОРМАЛЬНАЯ КИНЕТИКА
Раздел химической кинетики, который математически описывает зависимость скорости реакций от концентрации реагентов, называется формальной кинетикой. Аппарат формальной кинетики позволяет рассчитать количество всех участников реакции в любой момент времени. Рассмотрим кинетические уравнения односторонних реакций, порядок которых дается целым числом.
Тема 5 Катализ
Одним из наиболее распространенных в химической практике методов ускорения химических реакций является катализ. Катализатор - вещество, которое многократно участвует в промежуточных стадиях реакции, но выходит из нее химически неизменным.
Например, для реакции А2 + В2 = 2АВ участие катализатора К можно выразить уравнением
А2 + К + В2 ® А2....К + В2 ® А2...К...В2 ® 2АВ + К.
Эти уравнения можно представить кривыми потенциальной энергии (рис. 2). Рис. 2. Энергетическая схема хода реакции с катализатором и без катализатора
Из рисунка 2 видно, что: 1) катализатор уменьшает энергию активации, изменяя механизм реакции, – она протекает через новые стадии, каждая из которых характеризуется невысокой энергией активации; 2) катализатор не изменяет DН реакции (а также DG, DU и DS); 3) если катализируемая реакция обратимая, катализатор не влияет на равновесие, не изменяет константу равновесия и равновесные концентрации компонентов системы. Он в равной степени ускоряет и прямую, и обратную реакции, тем самым ускоряя время достижения равновесия.
Очевидно, в присутствии катализатора энергия активации реакции снижается на величину DЕк. Поскольку в уравнении Аррениуса энергия активации входит в отрицательный показатель степени, то даже небольшое уменьшение Еа вызывает очень большое увеличение скорости реакции: Влияние катализатора на снижение Еа можно показать на примере реакции распада иодида водорода:
2HI = H2 + I2.
Таким образом, для рассматриваемой реакции уменьшение энергии активации на 63 кДж, т.е. в 1,5 раза, соответствует повышению скорости реакции при 500 К более чем 106 раз.
Следует отметить, что предэкспоненциальный множитель каталитической реакции k01 не равен k0 и обычно значительно меньше, однако соответствующее уменьшение скорости далеко не компенсирует её увеличения за счёт Еа.
Пример. Энергия активации некоторой реакции в отсутствие катализатора равна 75,24 кДж/моль, а с катализатором - 50,14 кДж/моль. Во сколько раз возрастает скорость реакции в присутствии катализатора, если реакция протекает при 250 С, а предэкспоненциальный множитель в присутствии катализатора уменьшается в 10 раз. Решение. Обозначим энергию активации реакции без катализатора через Еа, а в присутствии катализатора - через Еа1; соответствующие константы скоростей реакций обозначим через k и k1. Используя уравнение Аррениуса (5.9) (см. раздел 5.3) и принимая k01/k0 = 10, находим:
Окончательно находим:
Таким образом, снижение энергии активации катализатором на 25,1 кДж привело к увеличению скорости реакции в 2500 раз, несмотря на 10-кратное уменьшение предэкспоненциального множителя.
Каталитические реакции классифицируются по типу катализаторов и по типу реакций. Так, например, по агрегатному состоянию катализаторов и реагентов катализ подразделяется на гомогенный (катализатор и реагент образуют одну фазу) и гетерогенный (катализатор и реагенты – в разных фазах, имеется граница раздела фаз между катализатором и реагентами).
Примером гомогенного катализа может быть окисление СО до СО2 кислородом в присутствии NO2 (катализатор). Механизм катализа можно изобразить следующими реакциями:
CO(г) + NO2(г) ® CO2(г) + NO(г) , 2NO(г) + O2(г) ® 2NO2(г);
и катализатор (NO2) снова участвует в первой реакции.
Аналогично этому может быть катализирована реакция окисления SO2 в SO3; подобная реакция применяется в производстве серной кислоты "нитрозным" способом.
Примером гетерогенного катализа является получение SO3 из SO2 в присутствии Pt или V2O5: SO2(г) + O2(г) ® SO3(г).
Эта реакция также применяется в производстве серной кислоты ("контактный" метод).
Гетерогенный катализатор (железо) применяется также в производстве аммиака из азота и водорода и во многих других процессах.
Эффективность гетерогенных катализаторов обычно намного больше, чем гомогенных. Скорость каталитических реакций в случае гомогенного катализатора зависит от его концентрации, а в случае гетерогенного - от его удельной поверхности (то есть дисперсности) - чем она больше, тем больше скорость. Последнее связано с тем, что каталитическая реакция идет на поверхности катализатора и включает в себя стадии адсорбции (прилипание) молекул реагентов на поверхности; по окончании реакции ее продукты десорбируются. Для увеличения поверхности катализаторов их измельчают или получают специальными способами, при которых образуются очень тонкодисперсные порошки.
Приведенные примеры одновременно являются примерами окислительно-восстановительного катализа. В этом случаев качестве катализаторов обычно выступают переходные металлы или их соединения (Mn3+, Pt, Au, Ag, Fe, Ni, Fe2O3 и др.).
В кислотно-основном катализе роль катализатора выполняют Н+, ОН- и другие подобные частицы - носители кислотности и основности. Так, реакция гидролиза
ускоряется примерно в 300 раз при добавлении любой из сильных кислот: HCl, HBr или HNO3. Большое значение катализ имеет в биологических системах. В этом случае катализатор называют ферментом. Эффективность действия многих ферментов намного больше, чем обычных катализаторов. Например, для реакции связывания азота в аммиак
N2 + 3H2 = 2NH3
в промышленности используется гетерогенный катализатор в виде губчатого железа с добавками оксидов и сульфатов металлов.
При этом реакция проводится при Т» 700 К и Р» 30 МПа. Этот же синтез идет в клубеньках бобовых растений под действием ферментов при обычных Т и Р.
Каталитические системы небезразличны к примесям и добавкам. Некоторые из них увеличивают эффективность катализа, как например, в вышеприведенном примере катализа синтеза аммиака железом. Такие добавки в катализатор называются промоторами (оксиды калия и алюминия в железе). Некоторые примеси, наоборот, подавляют каталитическую реакцию ("отравляют" катализатор), это каталитические яды. Например, синтез SO3 на Pt-катализаторе очень чувствителен к примесям, содержащим сульфидную серу; сера отравляет поверхность платинового катализатора. И напротив, катализатор на основе V2O5 малочувствителен к таким примесям; честь разработки катализатора на основе оксида ванадия принадлежит российскому учёному Г.К. Борескову. ХИМИЧЕСКАЯ КИНЕТИКА И КАТАЛИЗ ТЕМА: Химическое равновесие
|
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 70; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.40.43 (0.168 с.) |
 аА + bВ сС + dD
аА + bВ сС + dD
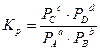 ,
, Например, для реакции 2СН4 (г) С2Н2 (г) + 3Н2 (г)
Например, для реакции 2СН4 (г) С2Н2 (г) + 3Н2 (г) или
или 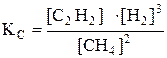 .
. ,
,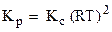 .
. .
.
 (Dt ® 0) ® V= ±
(Dt ® 0) ® V= ± 
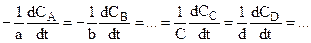

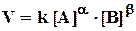 .
. 
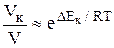 .
. (500К)
(500К)
 Отсюда
Отсюда 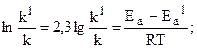

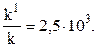

 CH3COOCH3 + H2O CH3COOH + CH3OH
CH3COOCH3 + H2O CH3COOH + CH3OH


