
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Зависимость скорости химической реакции
От концентрации реагентов
Так как скорость химической реакции зависит от столкновений, а количество столкновений в единице объема, очевидно, пропорционально концентрации сталкивающихся молекул, то можно предположить, что скорость реакции пропорциональна концентрациям реагентов, то есть для необратимой простой реакции
аА + bВ +.... = сС + dD +...
(закон действующих масс для скорости химической реакции). Здесь k - константа скорости, то есть скорость реакции при
[A] = [B] = 1 моль/л.
Эти рассуждения верны лишь в том случае, если реакция элементарная (в одном столкновении участвуют а молекул А, b молекул В) и при этом сразу образуются конечные продукты С, D и т. д. Если реакция сложная, то скорость зависит не только от [A] и [В], но и от концентраций промежуточных продуктов и скоростей их расходования, так что обычно коэффициенты в уравнении реакции не совпадают с а и b (они меньше их). В этом случае кинетическое уравнение записывается:
Уравнения типа вырыжающие закон действующих масс для скорости реакции называются кинетическими уравнениями химических реакций. Константа скорости (k) не зависит от концентраций реагентов, но зависит от природы реагентов, направления реакции (природы продуктов) и от температуры. Константу скорости находят из экспериментальных данных расчетом (известны V, [A], [B]...., а, в,...)
n = kC A n × C B p.
Коэффициент пропорциональности k называется константой скорости химической реакции и численно равен скорости при концентрациях реагирующих веществ, равных единице. Размерность k зависит от природы реагирующих веществ, равных единице. Размерность k зависит от природы реакции [k] = время-1·конц1-r. Показатели степени (n, p), в которые возведены концентрации соответствующих веществ (СА и СВ), называются порядком реакции по соответствующему веществу. Общий порядок равен сумме порядков реакций по каждому веществу или сумме показателей степеней
r = n + p.
Порядок может быть целым, дробным, положительным, отрицательным и даже нулевым. Для очень многих реакций, даже сравнительно простых реакций, порядок не совпадает со стехиометрическим коэффициентом. Это объясняется тем, что реакции протекают обычно по сложным механизмам в несколько стадий, которые не находят отражения в химических уравнениях. Порядок реакции понятие формальное, поскольку в большинстве случаев не отражает механизма реакции. Определяется порядок реакции экспериментально и отражает зависимость скорости реакции от концентрации вещества.
Приведем реакции различных порядков.
Реакции нулевого порядка.
Нитрование бензола большим избытком азотной кислоты
С6H6 + HNO3 → C6H5NO2 + H2O
2HNO3 ® NO2+ NO3 ̅ + H2O – медленная
C6H6 + NO2+ → C6H5NO2 + H+ - быстрая
n= kC2 HNO k CHNO =const; n= k
Реакции первого порядка. CH3COCH3 → C2H4+H2+CO;
n = kC CH 3 COCH 3
Классическим примером реакции первого порядка в растворе является гидролитический распад тростникового сахара в воде на глюкозу и фруктозу:
C12H22O11 + H2O → C6H12O6 + C6H12O6. Согласно закону действия масс для такой реакции
n = kC C 12 H 22 O 11 × C H 2 O
но в разбавленном водном растворе количество воды, расходуемое на гидролиз, настолько незначительно, что можно её концентрацию считать постоянной.
Тогда n = kC C 12 H 22 O 11, что отвечает уравнению первого порядка.
Реакции второго порядка CH3COOC2H5 + NaOH ® CH3COONa + C2H5OH;
n = kC CH 3 COOC 2 H 5 × C NaOH CH3Br+KOH ®CH3OH+KBr;
n = kC CH Br × C KOH 3
Реакции третьего порядка. 2NO + O2 ® 2NO2;
n = kC NO 2 × C O 2
Для элементарных реакций вместо порядка реакции говорят о её молекулярности.
Молекулярность реакции равна числу частиц (молекул, радикалов, атомов), принимающих участие в элементарной реакции или элементарном акте реакции.
Коэффициенты a и b в этих уравнении носят название "молекулярность" реакции по веществу А и В, соответственно; сумма (a + b) - суммарная (общая) молекулярность простой реакции. Понятие "молекулярность" применимо только к простой реакции. Вычисления и наблюдения показывают, что (a + b) не может быть больше трех. Если для какой-либо реакции эта сумма больше трех, то можно утверждать, что реакция сложная. По количеству сталкивающихся в элементарном акте молекул реакции называют моно-, би- и тримолекулярными.
Коэффициенты aи b в уравнении для сложных реакций носят название "частный порядок" реакции по веществу А и В, соответственно, а сумма:
(a + b)=n общий порядок реакции.
Эти коэффициенты находят экспериментально, и они могут быть целыми, дробными, отрицательными и равными нулю. Порядок и молекулярность простой реакции обычно совпадают, но если, например, концентрация одного из реагентов много больше, чем других, то скорость практически не зависит от этой концентрации и, хотя в реакции участвуют все молекулы, ее порядок будет меньше молекулярности. На этом основано нахождение порядков реакций по веществам - метод понижения порядка реакции.
Молекулярность реакции всегда целочисленна, положительна и не превышает трех. Примером монолекулярных реакций могут служить реакции изомеризации (внутримолекулярной перегруппировки), термического разложения:
СНзNСНз → С2Н6 + N2 (разложение азометана);
CH3OCH3 → CH4 + H2 + CO (разложение диметилового эфира).
Примеры бимолекулярных реакций:
H2 + J2 → 2HJ;
CH3COOH + C2H5OH → CH3COOC2H5 + H2O.
Тримолекулярных реакций известно не много. Это, например, реакции
2NO + H2 → N2O + H2O;
2NO + O2 → 2NO2.
Молекулярность - это теоретическое понятие. Она отражает механизм реакции, дает представление о том какие именно и через какие стадии идет образование продуктов. В простых (элементарных) реакциях, протекающих в одну стадию порядок реакции и молекулярность совпадают и имеют целое положительное значение. Для большинства реакций порядок реакции меньше молекулярности. Порядок реакции зависит от условий (концентрации, давления) протекания процесса. Рассмотрим случаи несовпадения порядка реакции и молекулярности:
1) Большой избыток одного из реагирующих веществ.
HCOOC2H5 + H2O → HCOOH + C2H5OH;
n = kC HCOOC 2 H 5 × C H 2 O
Порядок = 1; молекулярность = 2.
2) Для гетерогенных реакций
CaO(тв) + CO2(г) → CaCO3(тв)
учитывается концентрация только газообразных веществ:
n = kC СO 2
Порядок = 1; молекулярность = 2.
ФОРМАЛЬНАЯ КИНЕТИКА
Раздел химической кинетики, который математически описывает зависимость скорости реакций от концентрации реагентов, называется формальной кинетикой. Аппарат формальной кинетики позволяет рассчитать количество всех участников реакции в любой момент времени. Рассмотрим кинетические уравнения односторонних реакций, порядок которых дается целым числом.
|
||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 95; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.111.24 (0.012 с.) |

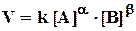 .
. 


