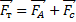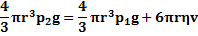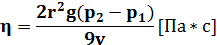Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Период колебания физического маятникаСтр 1 из 4Следующая ⇒
Период колебания физического маятника
Период колебания пружинного маятника.
19. Среда, частицы которой связаны между собой так, что изменение положения одной из них ведёт к изменению положения других частиц, называется упругой. Процесс распространения колебаний в упругой среде называется волной. Продольной называется волна, в которой частицы колеблются вдоль направления распространения волны. Такие волны могут распространяться в любой среде. Поперечной - называется волна, у которой частицы колеблются перпендикулярно направлению распространения волны. Поперечные волны могут распространяться только в твёрдых телах и на поверхности жидкости. В однородной среде волны распространяются равномерно, поэтому скорость распространения волны можно определить по формуле.
Скорость распространения волны зависит от свойств упругой среды, в которой волна распространяется.
где E - модуль Юнга среды, ρ -плотность среды. 20. Волновое число — это отношение 2π радиан к длине волны, то есть это пространственный аналог круговой частоты ω
Волновым числом часто называют величину, обратную длине волны (1/λ), измеряемую обычно в обратных сантиметрах (см^−1).
Все тела состоят из молекул. Молекулы находятся в хаотическом тепловом движении. Закон Бойля-Мариотта Закон Бойля-Мариотта устанавливает зависимость между давлением и объемом при постоянной температуре. Запишем основное уравнение МКТ для двух состояний газа: Так, как правые части уравнений (8.13) и (8.14) равны, приравняем левые:
Закон Бойля-Мариотта: произведение давления на объем данной массы газа есть величина постоянная при неизменной температуре. Процесс, протекающий при T = const называется изотермическим и изображается изотермой (рис. 58):
Рис. 58.
Закон Гей-Люссака Закон Гей-Люссака устанавливает зависимость между объемом и температурой при постоянном давлении.
Запишем основное уравнение МКТ для двух состояний газа:
Разделим почленно уравнение (8.15) на (8.16) и получим:
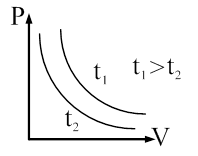
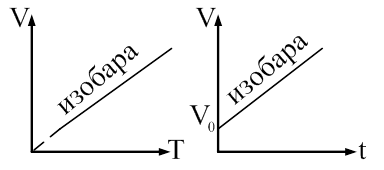
Закон Гей-Люссака: объем данной массы газа прямо пропорционален абсолютной температуре при постоянном давлении. Закон Гей-Люссака через температуру по шкале Цельсия перепишется в виде: где α = 1/273 К -1 – коэффициент объемного расширения; V0– объем при 0 0С; t– температура. Процесс, протекающий при постоянном давлении называется изобарическими изображается изобарой (рис. 59).
Рис. 59 Закон Шарля Закон Шарля устанавливает зависимость между давлением ри температурой Т при постоянном объеме. Запишем основное уравнение МКТ для двух состояний газа: Разделим почленно (8.18) на (8.19) и получим:
Закон Шарля: давление данной массы газа пропорционально абсолютной температуре при постоянном объеме. Через температуру по шкале Цельсия закон Шарля запишется где α = 1/273 К-1, P0 – давление при 00С. Процесс в газах, протекающий при постоянном объеме называется изохорным и изображается изохорой (рис. 60).
Рис. 60
Адиабатический процесс Адиабатным, называется процесс, протекающий без теплообмена с окружающей средой (рис. 61).
Рис. 61 Абсолютный нуль Рассмотрим график изохорического процесса в координатных осях P-t (рис. 62).
Рис. 62.
При понижении температуры давление, производимое газом, будет уменьшаться. Запишем закон Шарля:
Найдем температуру, при которой давление, производимое газом
Абсолютный нуль - это температура, при которой прекращается поступательное движение молекул и давление, производимое газом становится равным нулю.
24. 3. Основное уравнение МКТ Основное уравнение молекулярно-кинетической теории идеального газа устанавливает зависимость между давлением (p); объемом (V) и кинетической энергией поступательного движения его молекул. Для вывода формулы рассмотрим одноатомный идеальный газ, находящийся в цилиндрическом сосуде с площадью основания ∆ S и длиной l (рис. 56).
Рис. 56.
Молекулы движутся хаотически и беспорядочно, их количество N. Определим давление, оказываемое газом на площадку
где
где Импульс одной молекулы равен:
Так как после удара о стенки сосуда направление скорости изменится на Общее количество молекул в сосуде будет равно:
где
Рассчитаем импульс ∆ p, сообщенный площадке С учетом уравнения (8.3) уравнение (8.5) примет вид:
Подставим значение ∆ p из уравнения (8.6) в (8.2) и выразим силу Подставим правую часть уравнения (8.7) в уравнение (8.1):
Молекулы в сосуде движутся со скоростями
C введением основное уравнение МКТ идеального газа. Умножив и разделив правую часть уравнения (8.9) на 2, получим другой вид данного уравнения:
где По закону Больцмана Подставив значение
Т. к. концентрация газа (8.12) 25.. Уравнение Менделеева-Клапейрона. Закон Дальтона Пусть дан газ состоящий из смеси газов с концентрациями: Общее давление по основному уравнению МКТ
Закон Дальтона: общее давление смеси газов равно сумме парциальных давлений, производимых каждым газом в отдельности. 26. 2. Первое начало термодинамики. Первое начало термодинамики применительно к изопроцессам Изменить внутреннюю энергию термодинамической системы можно двумя путями: 1. Путем теплопередачи – сообщая количество теплоты Q (Дж). 2. Совершив работу. Если система сама совершит работу, то она считается положительной (+ А). Если работа совершается над системой, то работа отрицательна (- А). Пусть дана термодинамическая система, имеющая внутреннюю энергию U 1, подведем к системе количество теплоты Q и совершим над системой работу (- А), в результате внутренняя энергия системы станет U 2. Изменение энергии
Выразим Q: Первое начало термодинамики: Подводимое к системе тепло идет на изменение внутренней энергии системы Δ U и совершение системой работы А против внешних сил. Первый закон (начало) термодинамики для малых изменений состояния газов будет иметь вид: Если система периодически возвращается в исходное состояние, и, следовательно, Применим первое начало термодинамики к изопроцессам в газах. а) если
б) если V = const (изохорический процесс), работа газа в) если Первое начало термодинамики устанавливает количественные соотношения и ничего не говорит о направлении процессов в природе.
Адиабатический процесс Адиабатным, называется процесс, протекающий без теплообмена с окружающей средой (рис. 61).
27. 3. Работа при изотермическом и адиабатическом процессах в газах Работа газа при изотермическом процессе. В общем случае работа газа определяется выражением: Работа газа при изотермическом процессе равна подведенному к системе количеству теплоты: Выразим давление газа из уравнения Менделеева-Клапейрона: Подставив выражение (9.14) в выражение (9.13), получим:
. Работа газа при адиабатическом процессе При адиабатическом процессе отсутствует теплообмен между термодинамической системой и окружающей средой (Q=0). Работа газа равна изменению внутренней энергии системы:
28. Количество теплоты. Теплоемкость. Теплоемкость при Второе начало термодинамики Второе начало термодинамики возникло из анализа работы теплового двигателя (рис. 67). Тепловой двигатель – периодически действующий двигатель, который совершает работу за счет полученной извне теплоты или это двигатель, в котором внутренняя энергия топлива превращается в механическую работу. К ним относятся паровые машины, паровые турбины, двигатели внутреннего сгорания, реактивные двигатели. Любой тепловой двигатель состоит из нагревателя и холодильника. Нагреватель – устройство, в котором сгорает топливо и выделяется количество теплоты Q 1. Часть теплоты Q 2 передается холодильнику. Рабочее тело (пар или газ) совершают работу: А = Q 1 – Q 2.
Рис. 67 КПД теплового двигателя определяется по формуле:
Для работы тепловой машины необходим нагреватель и холодильник, благодаря которому система возвращается в исходное состояние.
Процесс, обратный рассмотренному в тепловом двигателе используется в холодильной машине. Для того, чтобы отбирать теплоту от менее нагретого тела и отдавать ее более нагретому, необходимо совершить работу над системой. Кельвин и Планк сформулировали второе начало термодинамики: Невозможен процесс, при котором все тепло, полученное от нагревателя превращается в работу (вечный двигатель второго рода). В холодильных машинах протекает процесс, обратный процессу в тепловых двигателях, т.е. над системой совершается отрицательная работа. Второе начало термодинамики сформулировал также Клаузиус: Теплота никогда не может переходить сама собой от тел с более низкой температурой к телам с более высокой температурой.
30. братимые и необратимые тепловые процессы Круговым процессом (циклом) называется процесс, при котором система, пройдя через ряд состояний возвращается в исходное. Изобразим круговой процесс в координатных осях р - V (рис. 66).
Рис. 66 На рисунке 65: а) 1-2 – расширение газа, б) 2-1 – сжатие газа. Работа расширения определяется площадью фигуры
Работа сжатия определяется площадью фигуры
Таким образом работа, совершаемая за цикл, определяется площадью охватываемую кривой, описывающей процессы данного цикла. Если цикл протекает по часовой стрелке, совершается положительная работа и цикл называется прямым. Если за цикл совершается отрицательная работа (цикл протекает против часовой стрелки), то он называется обратным. Прямой цикл используется в тепловом двигателе. Обратный цикл используется в холодильных машинах, в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой. Коэффициент полезного действия (КПД) кругового процесса определяется выражением:
где Q1 – количество теплоты, получаемое термодинамической системой за цикл; Q2 – количество теплоты, отдаваемое термодинамической системой за цикл. Термодинамический процесс называется обратимым, если он может протекать, как в прямом, так и в обратном направлениях. Причем если такой процесс протекает сначала в прямом, а затем в обратном направлениях и система возвращается в исходное состояние, то ни в окружающей среде, ни в этой системе не происходит никаких изменений. Всякий процесс, неудовлетворяющий этим условиям называется необратимым. В результате кругового процесса система возвращается в исходное состояние и изменение внутренней энергии
Цикл Карно - это прямой круговой процесс, состоящий из 2-х изотерм и 2-х адиабат в координатных осях р – V (рис. 68). Рис. 68 Рис. 69
В данном случае качество рабочего тела использован идеальный газ, который заключен в сосуд с подвижным поршнем (Рис. 69). В точке 1 газ характеризуется параметрами Работа, совершаемая в результате кругового процесса равна: (9.32) Найдем каждую из составляющих формулы (9.32). А1-2 – работа при изотермическом расширении.
А2-3 – работа при адиабатическом расширении. В данном процессе Δ Q = 0 (нет теплообмена с окружающей средой) и работа совершается за счет изменения внутренней энергии ΔU:
А3-4 – работа при изотермическом сжатии, газ отдает холодильнику количество теплоты Q 2.
А4-1 – работа при адиабатическом сжатии:
Подставим выражения (9.33, 9.34, 9.35 и 9.36) в уравнение (9.32):
Используя уравнение Пуассона для адиабатического процесса можно доказать, что
КПД теплового двигателя по формуле Карно, через температуру нагревателя Т1 и холодильника Т2 (9.38). Коэффициент полезного действия цикла Карно является наибольшим и определяется только температурой нагревателя и холодильника и не зависит от природы рабочего тела. Благодаря этой формуле возникло направление в науке по созданию экономически выгодного теплового двигателя. Это максимальный КПД для данного теплового двигателя. КПД реального теплового двигателя из-за потерь на преодоление трения, тепловых потерь всегда ниже, чем КПД по Карно. 31.. Энтропия Преобразуем выражение для КПД теплового двигателя к следующему виду:
Для цикла Карно алгебраическая сумма приведенных количеств теплоты равна 0. Величина Для малых обратимых циклов это выражение примет вид:
Подынтегральное выражение
энтропия – функция состояния термодинамической системы. Для обратимых процессов изменение энтропии Δ S = 0. В необратимых процессах изменение энтропии:
Так как реальные процессы необратимы, то можно утверждать, что все процессы в замкнутой системе ведут к увеличению ее энтропии – принцип возрастания энтропии.
32..Изменение формы или размеров тела под действием внешних сил – деформация тела Упругая деформация – деформация исчезающая после снятия вызывающих ее напряжений Остаточная деформация – деформация возникающая после прекращения действия вызывающих ее напряжение 2. Абсолютная деформация – величина равная разности длины тела при и без деформации
Относительная деформация – величина равная отношению абсолютной деформации к первоначальной длине
3. скалярная величина, численно равная силе действующая на единицу площади поперечного сечения предмета
4. Напряжение прямо пропорционально относительному удлинению при малых деформациях
Е – модуль юнга
33. Неинерциа́льная систе́ма отсчёта — система отсчёта, движущаяся с ускорением или поворачивающаяся относительно инерциальной. Второй закон Ньютона также не выполняется в неинерциальных системах отсчёта. Для того чтобы уравнение движения материальной точки в неинерциальной системе отсчёта по форме совпадало с уравнением второго закона Ньютона, дополнительно к «обычным» силам, действующим в инерциальных системах, вводят силы инерции. Законы Ньютона выполняются только в инерциальных системах отсчёта. Тем не менее, движение тел в неинерциальных системах отсчёта можно описывать теми же уравнениями движения, что и в инерциальных, если наряду с силами, обусловленными воздействием тел друг на друга, учитывать силы инерции Так как в неинерциальных системах отсчёта в принципе не может быть замкнутых систем тел (силы инерции всегда являются внешними силами для любого тела системы), то в них не выполняются законы сохранения импульса, момента импульса и энергии.
Си́ла ине́рции (также инерционная сила ) — многозначное понятие, применяемое в механике по отношению к трём различным физически величинам. Одна из них — «даламберова сила инерции» [ ⇨ ] — вводится в инерциальных системах отсчёта для получения формальной возможности записи уравнений динамики в виде более простых уравнений статики. Другая — «эйлерова сила инерции» [] — используется при рассмотрении движения тел в неинерциальных системах отсчёта[1][2]. Наконец, третья — «ньютонова сила инерции» [ ⇨ ] — сила противодействия, рассматриваемая в связи с третьим законом Ньютона. Общим для всех трёх величин является их векторный характер и размерность силы. Кроме того, первые две величины объединяет возможность их использования в уравнениях движения, по форме совпадающих с уравнением второго закона Ньютона[1, а также их пропорциональность массе тел. 34. Метод Стокса, основанный на измерении скорости шарика, равномерно падающего в вязкой среде. На шарик, свободно падающий в вязкой среде, действуют силы 1) Сила тяжести:
где: m – масса шарика, g – ускорение силы тяжести, 2) Выталкивающая сила Архимеда:
3) Сила сопротивления движению, обусловленная силами внутреннего трения между слоями жидкости, которая для малых скоростей падения небольших шарообразных тел, как показал Стокс, равна:
4) Применяя второй закон Ньютона для движения шарика, получим уравнение: Вначале шарик движется ускоренно, но по мере увеличения скорости падения шарика сила сопротивления Значит, сила тяжести уравновесится выталкивающей силой и силой сопротивления: Движение шарика станет равномерным. Подставляя выражения для силы тяжести, Архимеда и Стокса, получим:
Из последнего уравнения определим коэффициент вязкости:
35. Абсолютная влажность воздуха - физическая величина, численно равная массе водяного пара, содержащегося в единице объема воздуха при данной температуре. Обычно абсолютную влажность выражают в г/м3 или мм рт. ст. Так как плотность пара и его давления пропорциональны абсолютной температуре, то часто абсолютную влажность называют упругостью (парциальным давлением). Ощущение сухости или сырости воздуха связано не с абсолютной влажностью, а с относительной. Относительная влажность воздуха - отношение абсолютной влажности к ее максимальному значению при данной температуре. Относительная влажность выражается в процентах
Процесс перехода жидкости в газообразное состояние называется парообразованием. Парообразование может происходить двумя путями: -испарение (с поверхности жидкости при любой температуре); -кипение (со всего объема жидкости при температуре кипения). Точка росы t – температура, при которой находящиеся в воздухе водяные пары становятся насыщенными, т.е. если понижать температуру воздуха, то при t данный пар будет насыщенным, а при дальнейшем понижении температуры выпадет роса. Психрометр представляет собой два одинаковых термометра, укрепленных на штативе. Один из термометров "Б" является влажным. Шарик этого термометра обтянут слоем батиста, который, как фитиль, погружен в стаканчик с дистиллированной водой. Уровень воды должен отстоять на 3 см от шарика термометра. Если воздух содержит ненасыщенные пары, то показания влажного термометра tB всегда будут ниже показаний сухого термометра tc, так как вода, испаряясь, будет понижать его температуру. Разность температур (tC - tB) подчиняется строгой закономерности, на основании которой составлены психрометрические таблицы, по которым, зная tC и tB, можно найти все параметры влажности воздуха.
Период колебания физического маятника
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 157; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.0.192 (0.164 с.) |
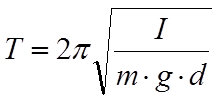


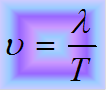 - через период
- через период - через частоту
- через частоту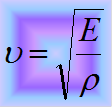
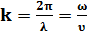
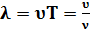 –связь между скоростью и длинной волны
–связь между скоростью и длинной волны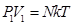 (8.13)
(8.13)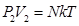 (8.14)
(8.14)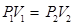 или
или 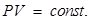
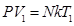 (8.15)
(8.15)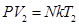 . (8.16)
. (8.16)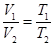
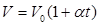 ,
,
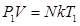 (8.18)
(8.18)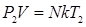 (8.19)
(8.19)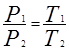 (8.20)
(8.20) , (8.21)
, (8.21) 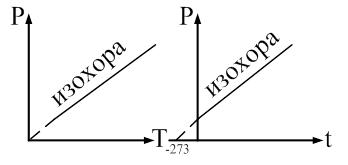
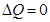 . Графически адиабатический процесс представляется адиабатой. Рассмотрим этот процесс в координатных осях
. Графически адиабатический процесс представляется адиабатой. Рассмотрим этот процесс в координатных осях 
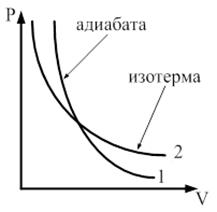 Адиабата в осях
Адиабата в осях  представляет собой гиперболу, которая более крута, чем изотерма, т. к. при адиабатическом процессе 1-2 возрастает давление и изменяется температура.
представляет собой гиперболу, которая более крута, чем изотерма, т. к. при адиабатическом процессе 1-2 возрастает давление и изменяется температура.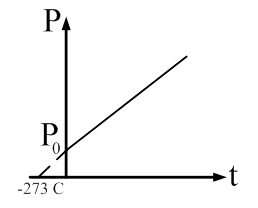
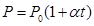 (8.22)
(8.22)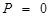
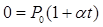
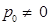 ,следовательно
,следовательно 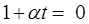 ,
, 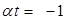 →
→ 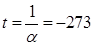 0C.
0C.
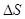 .
.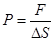 (8.1)
(8.1)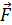 – сила, которая может быть выражена по второму закону Ньютона через импульс тела:
– сила, которая может быть выражена по второму закону Ньютона через импульс тела: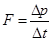 (8.2)
(8.2)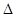 p – импульс.
p – импульс.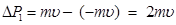 . (8.3)
. (8.3)
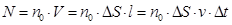 . (8.4)
. (8.4)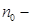 концентрация.
концентрация.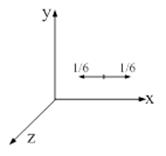 Молекулы движутся к площадке под разными углами. Для упрощения расчетов предположим, что молекулы движутся вдоль трех взаимно перпендикулярных направлений, 1/3 молекул вдоль каждого направления, причем половина молекул (1/6) движется в одну сторону, половина в противоположную (рис. 57). С учетом этого до площадки ∆ S дойдет 1/6 от (Рис. 57) N – общего числа молекул.
Молекулы движутся к площадке под разными углами. Для упрощения расчетов предположим, что молекулы движутся вдоль трех взаимно перпендикулярных направлений, 1/3 молекул вдоль каждого направления, причем половина молекул (1/6) движется в одну сторону, половина в противоположную (рис. 57). С учетом этого до площадки ∆ S дойдет 1/6 от (Рис. 57) N – общего числа молекул.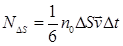 (8.5)
(8.5)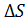 этими молекулами.
этими молекулами.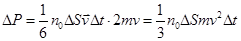 (8.6)
(8.6)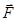 :
: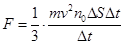 (8.7)
(8.7)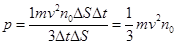 (8.8)
(8.8)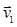 ;
; 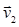 ; …
; … 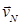 в этом случае рассматривают среднюю квадратичную скорость
в этом случае рассматривают среднюю квадратичную скорость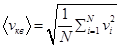
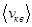 уравнение (8.8) перепишется в виде:
уравнение (8.8) перепишется в виде: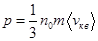 - (8.9)
- (8.9)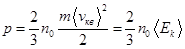 (8.10)
(8.10)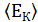 – средняя кинетическая энергия поступательного движения молекул.
– средняя кинетическая энергия поступательного движения молекул.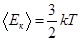 , где k–постоянная Больцмана, Т – абсолютная температура.
, где k–постоянная Больцмана, Т – абсолютная температура.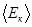 в (8.10) получим еще два вида основного уравнения МКТ идеального газа:
в (8.10) получим еще два вида основного уравнения МКТ идеального газа: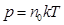 (8.11)
(8.11)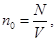 то уравнение (8.11) перепишется в виде:
то уравнение (8.11) перепишется в виде: 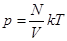
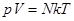
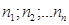 . Давление, производимое каждым газом в отдельности называется парциальным давлением:
. Давление, производимое каждым газом в отдельности называется парциальным давлением:  .
.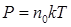 , газ перемешивается и с течением времени
, газ перемешивается и с течением времени 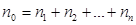 , тогда
, тогда 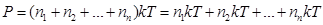 .
.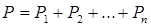 . (8.31).
. (8.31).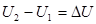 будет равно:
будет равно: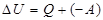
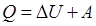 (9.9)
(9.9) .
.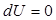
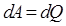 , т. е. нельзя построить двигатель, который бы совершал работу большую, чем количество сообщенной ему извне энергии – вторая формулировка первого начала термодинамики. Невозможно построить вечный двигатель первого рода.
, т. е. нельзя построить двигатель, который бы совершал работу большую, чем количество сообщенной ему извне энергии – вторая формулировка первого начала термодинамики. Невозможно построить вечный двигатель первого рода.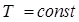 , то изменение внутренней энергии
, то изменение внутренней энергии 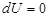 ,т.к.
,т.к. 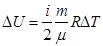 , вся теплота идет на совершение механической работы. Первый закон термодинамики для изотермического процесса будет иметь вид:
, вся теплота идет на совершение механической работы. Первый закон термодинамики для изотермического процесса будет иметь вид: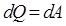 (9.10)
(9.10) , т. к.
, т. к. 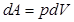 и, следовательно, вся теплота идет на изменение внутренней энергии:
и, следовательно, вся теплота идет на изменение внутренней энергии: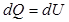 (9.11)
(9.11)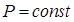 (изобарный процесс), то в этом случае совершается работа и изменяется внутренняя энергия газа:
(изобарный процесс), то в этом случае совершается работа и изменяется внутренняя энергия газа:  (9.12)
(9.12)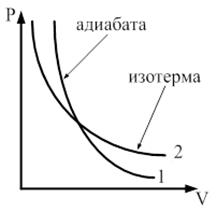 Адиабата в осях
Адиабата в осях 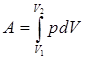 (9.13)
(9.13)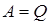
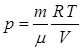 (9.14)
(9.14)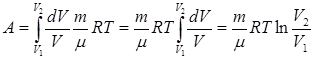


 (9.31)
(9.31)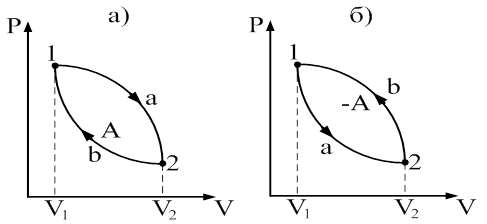
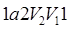 ,
, 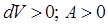 (рис. 65, а);
(рис. 65, а);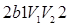 ,
,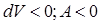 (рис. 65, б).
(рис. 65, б).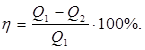 , (9.29)
, (9.29)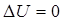 , поэтому первое начало термодинамики для кругового процесса запишется в виде:
, поэтому первое начало термодинамики для кругового процесса запишется в виде: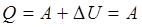
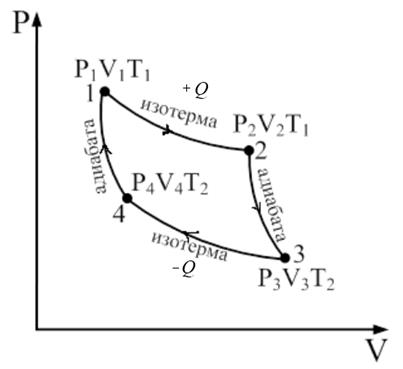

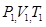 . Во 2-е состояние газ переходит изотермически расширяясь при Т1 = const, при этом к системе подведено количество теплоты Q 1 и газ характеризуется параметрами
. Во 2-е состояние газ переходит изотермически расширяясь при Т1 = const, при этом к системе подведено количество теплоты Q 1 и газ характеризуется параметрами 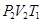 Переход из 2-го в 3-е состояние является адиабатическим расширением и газ характеризуется в третьем положении параметрами
Переход из 2-го в 3-е состояние является адиабатическим расширением и газ характеризуется в третьем положении параметрами 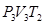 . Переход из 3 в 4 – изотермическое сжатие, при котором холодильнику передается количество теплоты Q 2 и параметр газа
. Переход из 3 в 4 – изотермическое сжатие, при котором холодильнику передается количество теплоты Q 2 и параметр газа  . Переход из 4 в 1 состояние – адиабатическое сжатие.
. Переход из 4 в 1 состояние – адиабатическое сжатие.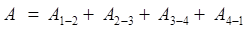
 (9.33)
(9.33)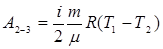 (9.34)
(9.34)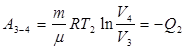 (9.35)
(9.35)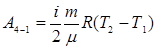 (9.36)
(9.36)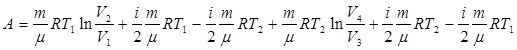
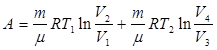 (9.37)
(9.37)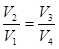 и с учетом этого уравнение (9.31) запишется в виде:
и с учетом этого уравнение (9.31) запишется в виде: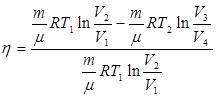
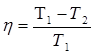 - (9.38)
- (9.38)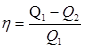 ,
, 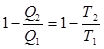 ,
, 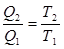 ,
,  .
. - приведенное количество теплоты.
- приведенное количество теплоты.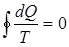 .
. - (9.39)
- (9.39)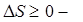 уравнение Клаузиса. (9.40)
уравнение Клаузиса. (9.40)  (м)
(м)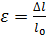 (безразмерная)
(безразмерная)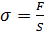
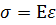 где,
где, – относительная деформация
– относительная деформация 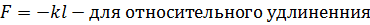
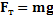 – сила тяжести шарика
– сила тяжести шарика 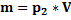 - масса тела
- масса тела 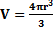 – объем сферы
– объем сферы 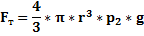
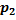 – плотность материала шарика, V – объем шарика, r – радиус
– плотность материала шарика, V – объем шарика, r – радиус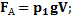
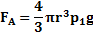 где
где  - равна весу вытесненной шариком жидкости
- равна весу вытесненной шариком жидкости – плотность жидкости
– плотность жидкости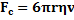 – где v –скорость движения шарика
– где v –скорость движения шарика
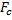 будет тоже возрастать, и наступит такой момент, когда движение шарика станет равномерным. Применяя второй закон Ньютона для движения шарика, получим уравнение:
будет тоже возрастать, и наступит такой момент, когда движение шарика станет равномерным. Применяя второй закон Ньютона для движения шарика, получим уравнение: