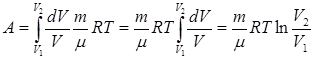Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физический смысл универсальной газовой постоянной ( R )
Закон Авогадро: Один Моль любого газа занимает одинаковый объем при нормальных условиях. В одном Моле вещества число молекул всегда равно Запишем основное уравнение МКТ для одного моля газа:
уравнение Клапейрона для одного моля газа. Выразим универсальную газовую постоянную из уравнения (8.26):
Рассмотрим состояние газа при нормальных условиях: Запишем уравнение Клапейрона для 2-х состояний газа. Первое при температуре Т, второе при температуре Т+10, т. е при нагреве газа на 1 0С.
Вычтем из (8.29) выражение (8.28):
Физический смысл универсальной газовой постоянной: R численно равна работе, которую совершает 1 моль газа при его нагревании на 1 К. Запишем основное уравнение МКТ идеального газа:
Подставим значения N и ν в уравнение (8.23), получим:
уравнение Менделеева-Клапейрона для любой массы газа. Закон Дальтона Пусть дан газ состоящий из смеси газов с концентрациями: Общее давление по основному уравнению МКТ
Закон Дальтона: общее давление смеси газов равно сумме парциальных давлений, производимых каждым газом в отдельности. 26. 2. Первое начало термодинамики. Первое начало термодинамики применительно к изопроцессам Изменить внутреннюю энергию термодинамической системы можно двумя путями: 1. Путем теплопередачи – сообщая количество теплоты Q (Дж). 2. Совершив работу. Если система сама совершит работу, то она считается положительной (+ А). Если работа совершается над системой, то работа отрицательна (- А).
Пусть дана термодинамическая система, имеющая внутреннюю энергию U 1, подведем к системе количество теплоты Q и совершим над системой работу (- А), в результате внутренняя энергия системы станет U 2. Изменение энергии
Выразим Q: Первое начало термодинамики: Подводимое к системе тепло идет на изменение внутренней энергии системы Δ U и совершение системой работы А против внешних сил. Первый закон (начало) термодинамики для малых изменений состояния газов будет иметь вид: Если система периодически возвращается в исходное состояние, и, следовательно, Применим первое начало термодинамики к изопроцессам в газах. а) если б) если V = const (изохорический процесс), работа газа в) если Первое начало термодинамики устанавливает количественные соотношения и ничего не говорит о направлении процессов в природе.
Адиабатический процесс Адиабатным, называется процесс, протекающий без теплообмена с окружающей средой
(рис. 61).
27. 3. Работа при изотермическом и адиабатическом процессах в газах Работа газа при изотермическом процессе. В общем случае работа газа определяется выражением: Работа газа при изотермическом процессе равна подведенному к системе количеству теплоты: Выразим давление газа из уравнения Менделеева-Клапейрона: Подставив выражение (9.14) в выражение (9.13), получим:
. Работа газа при адиабатическом процессе При адиабатическом процессе отсутствует теплообмен между термодинамической системой и окружающей средой (Q=0). Работа газа равна изменению внутренней энергии системы:
28. Количество теплоты. Теплоемкость. Теплоемкость при
|
||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 412; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.29.145 (0.009 с.) |
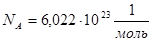 (постоянная Авогадро)
(постоянная Авогадро)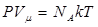 , но
, но 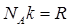 - универсальная газовая постоянная.
- универсальная газовая постоянная.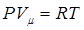 - (8.26)
- (8.26) (8.27)
(8.27)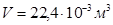 ,
,  Если эти значения подставить в формулу (8.27), то получим:
Если эти значения подставить в формулу (8.27), то получим:  .
.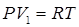 (8.28)
(8.28)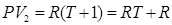 (8.29)
(8.29) ,
,  , т.к.
, т.к. 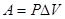 (8.27), то
(8.27), то 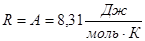 .
. Известно, что
Известно, что 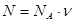 , где
, где  - число молей,
- число молей, 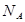 - число Авогадро.
- число Авогадро.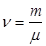 , где m – масса, μ – молярная масса.
, где m – масса, μ – молярная масса.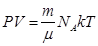 , так как
, так как 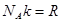 . то
. то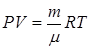 – (8.30)
– (8.30)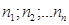 . Давление, производимое каждым газом в отдельности называется парциальным давлением:
. Давление, производимое каждым газом в отдельности называется парциальным давлением:  .
.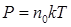 , газ перемешивается и с течением времени
, газ перемешивается и с течением времени 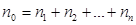 , тогда
, тогда 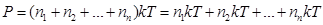 .
.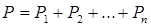 . (8.31).
. (8.31).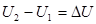 будет равно:
будет равно: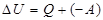
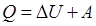 (9.9)
(9.9) .
.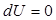
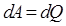 , т. е. нельзя построить двигатель, который бы совершал работу большую, чем количество сообщенной ему извне энергии – вторая формулировка первого начала термодинамики. Невозможно построить вечный двигатель первого рода.
, т. е. нельзя построить двигатель, который бы совершал работу большую, чем количество сообщенной ему извне энергии – вторая формулировка первого начала термодинамики. Невозможно построить вечный двигатель первого рода.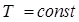 , то изменение внутренней энергии
, то изменение внутренней энергии 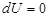 ,т.к.
,т.к. 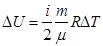 , вся теплота идет на совершение механической работы. Первый закон термодинамики для изотермического процесса будет иметь вид:
, вся теплота идет на совершение механической работы. Первый закон термодинамики для изотермического процесса будет иметь вид: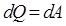 (9.10)
(9.10) , т. к.
, т. к. 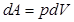 и, следовательно, вся теплота идет на изменение внутренней энергии:
и, следовательно, вся теплота идет на изменение внутренней энергии: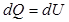 (9.11)
(9.11)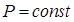 (изобарный процесс), то в этом случае совершается работа и изменяется внутренняя энергия газа:
(изобарный процесс), то в этом случае совершается работа и изменяется внутренняя энергия газа:  (9.12)
(9.12)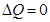 . Графически адиабатический процесс представляется адиабатой. Рассмотрим этот процесс в координатных осях
. Графически адиабатический процесс представляется адиабатой. Рассмотрим этот процесс в координатных осях 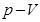
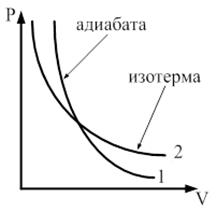 Адиабата в осях
Адиабата в осях 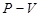 представляет собой гиперболу, которая более крута, чем изотерма, т. к. при адиабатическом процессе 1-2 возрастает давление и изменяется температура.
представляет собой гиперболу, которая более крута, чем изотерма, т. к. при адиабатическом процессе 1-2 возрастает давление и изменяется температура.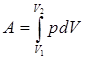 (9.13)
(9.13)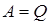
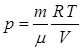 (9.14)
(9.14)