
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Как надо решать задачи по физике.Стр 1 из 5Следующая ⇒
Как надо решать задачи по физике. Чтобы правильно и осмысленно решать задачи по физике, необходимо следовать алгоритму: Алгоритм «Решение задач по физике» 1. Внимательно прочитайте условие задачи. 2. Установите о каком (их) физических явлениях идёт речь в задаче. 3. Вспомните основные количественные и качественные закономерности, объясняющие это (и) явление. 4. Определите, что требуется найти в задаче. 5. Установите, какие физические величины даны в задаче. Не забудьте о табличных величинах. Примечание: Иногда использование табличных величин зашифровано текстовой информацией: - определить массу молекулы азота, - найти количества вещества в массе алюминия. 6. Переведите, если этого необходимо, физические величины в систему СИ (стандартные единицы измерения) 7. Определите какую (ие) количественную (ые) зависимость (и) надо использовать в решение. Для этого лучше всего определить количественные зависимости, куда входит искомая физическая величина, а также данные физических величин по условию задачи. 8. Использовать преобразования в физических формулах, получите окончательную расчётную формулу. Примечание: при проверке правильности полученной формулы используйте размерность физической величины. Например: Если мы должны найти силу F, то в результате сокращения размерности должны получить H (Ньютон), если получить, что-то другое, значит, формула получена не верно. 9. Выполните вычисления по полученной формуле. 10. Запишите ответ задачи. Примечание: Иногда, для успешного решения задачи требуется выполнить чертёж. Помните о том, что правильно выполнит чертёж, помогает в решение задач, это 50% вашего успеха. 2. Основы молекулярно-кинетической теории. Основные понятия и закономерности. В основе молекулярно-кинетической теории строения вещества лежат три утверждения: вещество состоит из частиц; эти частицы беспорядочно движутся; частицы взаимодействуют друг с другом. Относительно молекулярной (или атомной) массой вещества М r называют отношение массы молекулы (или атома) m В Международной системе единиц количество вещества выражают в молях. Один моль- это количество вещества, в котором содержится столько же молекул или атомов, сколько атомов содержится в углероде массой 0,012 кг.
Значит, в 1 моле любого вещества содержится одно и то же число атомов или молекул. Это число атомов обозначают N Между молярной массой Μ и относительной молекулярной массой M r существует следующая связь: M =Mr ⋅ 10−3 Следующей основной физической величиной в МКТ будет – количество вещества. Количество вещества, содержащегося в теле, определяется числом молекул (или атомов) в этом теле. Поскольку число молекул в макроскопических телах очень велико, для определения количества вещества в теле сравнивают число молекул в нем с числом атомов в 0,012 кг изотопа углерода 126C. Единица количества вещества называется молем (моль). Обозначают количесвта вещества – ν. Количество вещества ν определяется как отношение числа N частиц (молекул) вещества к постоянной Авогадро N А: ν = N/ NА = m\M Зная массу вещества и его молярную массу М, можно найти число молей (количество вещества) N = νNA = mMNA. Зная молярную массу и постоянную Авогадро, можно рассчитать массу одной молекулы: m 0= M\NA = mN. Броуновское движение-это тепловое движение взвешенных в жидкости (или газе) частиц. Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало. p Это основное уравнение молекулярно-кинетической теории. p 2.2. Решение задач Задача 1. Какое количество вещества содержится в алюминиевой отливке массой 5,4 кг? [2]
M(Al)=27 m (Al)=5,4 кг
Задача 2. Какой объем занимает 100 моль ртути?
M(Hg)=201
Задача 3. Чему равно число молекул в 10 г. кислорода? Дано СИ Решение
M(O
N-? Ответ: Задача 4. На изделие, поверхность которого 50 см
S=50 cм
Na=6.02*10
N= Ответ: Задача 5. Определите сколько молекул воды в объёме 2л. Дано СИ Решение
Na=6.02*10
N-? Ответ: Задача 6. Находившаяся в стакане воде массой 0,5 кг. полностью испарилась за 30 суток. Сколько в среднем молекул воды вылетало с её поверхности за 1с? Дано СИ Решение
t=30 суток 2,592·10 t
N
Ответ: Задача 7. В озеро, имеющее среднюю глубину 10м и площадь поверхности 20 км Дано СИ Решение h=10м Чтобы найти N
m=0.01 г 10
V Na=6.02·10
Р -? Задача 9. Какова средняя квадратичная скорость движения молекул газа, если имея массу 8 кг, он занимает объем 10 м Дано СИ Решение
V=10 м
V-? 2. Разделим первую и вторую часть на m: V 3. Возьмем квадратичный корень из первой и второй части. V= V= Ответ: 306 м/с Задача 10. Найти концентрацию молекул кислорода, если давление его 0,3 МПа, а средняя квадратичная скорость молекул равна 900
V=900
n-? n= Ответ: Задача 11. Найти среднюю кинетическую энергию молекулы одноатомного газа при давлении 30 кПа. Концентрация молекул газа при указанном давление 5*10
P=30 кПа 3*10
Е Основные понятия и закономерности.
Величины, характеризующие состояние макроскопических тел без учета молекулярного строения тел(V,p,Т) называют макроскопическими параметрами. Тепловым равновесием называют такое состояние, при котором все макроскопические параметры сколь угодно долго остаются неизменными. Температура характеризует состояние теплового равновесия системы тел: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру. Предельную температуру, при которой давление идеального газа обращается в нуль при фиксированном объеме или объем идеального газа стремится к нулю при неизменном давлении, называют нулем температуры. Постоянная Больцмана связывает температуру 0 в энергетических единицах с температурой Т в Кельвинах. Один Кельвин и один градус шкал Цельсия совпадают. Поэтому любое значение абсолютной температуры Т будет на 273 градуса выше соответствующей температуры t по Цельсию. T=t+2730С; Средняя кинетическая энергия хаотичного поступательного движения молекул газа пропорциональна абсолютной температуре. Решение задач. Задача 1. Определить кинетическую энергию молекулы одноатомного газа и концентрацию молекул при температуре 37
T=37 P=1,2 МПа 1,2*10 к=1,38*10
n= Ответ: Задача 2. Найти температуру водорода и среднюю квадратичную скорость его молекул при давлении 150 кПа и концентрации молекул 1,5*10 Дано СИ Решение P=150 кПа 1.5*10
k=1,38*10 Na=6.02*10
уравнение (2) V = V = Ответ: Задача 3. При какой температуре средняя квадратичная скорость молекул равна 700
Дано СИ Решение
К=1,38*10 Na=6.02*10
Т-? Итак, Т= молекулы кислорода. Найдем её, зная молекулярную массу кислорода: Ответ: Задача 4. Средняя квадратичная скорость молекул газа, находящихся при температуре 110 Дано СИ Решение t=110 V=600 к=1,38*10
2.Умножим обе части на m 3. Разделим обе части на V Вычислим: m Основные понятия и закономерности. Еще философы древности догадывались о том, что теплота - это вид внутреннего движения. Но только в 18 веке начала развиваться молекулярно-кинетическая теория (МКТ). Цель МКТ - объяснение свойств макроскопических тел и тепловых процессов, протекающих в них, на основе представлений о том, что все тела состоят из отдельных, беспорядочно движущихся частиц. В основе МКТ строения вещества лежат три утверждения: - вещество состоит из частиц; - эти частицы беспорядочно движутся; - частицы взаимодействуют друг с другом. Качественное объяснение основных свойств газов на основе МКТ не является особенно сложным. Однако теория, устанавливающая количественные связи между измеряемыми на опыте величинами и свойствами самих молекул, их числом и скоростью, весьма сложна. Вместо реального газа, между молекулами которого действуют сложные силы взаимодействия, мы будем рассматривать его физическую модель. Эта модель называется идеальным газом. Идеальный газ - это газ, взаимодействие, между молекулами которого пренебрежимо мало и молекулы не занимают объема. Для описания процессов в газах и других макроскопических телах нет необходимости всё время обращаться к МКТ. Величины, характеризующие состояние макроскопических тел без учета молекулярного строения тел называют макроскопическими параметрами. Это объем, давление и температура. Уравнение, связывающее все три макроскопических параметра вместе, называют уравнением состояния идеального газа. Оно имеет еще одно название - уравнение Менделеева - Клапейрона. Получим его:
Можно заметить, что это уравнение получено для газа любой массы. Для газа неизменной массы эту зависимость можно представить в следующем виде:
Это уравнение получило название - уравнение Клапейрона. Как можно заметить уравнение Клапейрона является частным случаем уравнения состояния идеального газа. C помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из трех макроскопических параметров остаются неизменными. Количественные зависимости между двумя параметрами при фиксированном значении третьего параметра называют газовыми законами. Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами. ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС - процесс изменения состояния термодинамической системы (газ) макроскопических тел при постоянной температуре называют изотермическим. В частом случае этого явления, когда масса газа не изменяется, получается газовый закон, носящий имя закона Бойля-Мариотта. Для газа данной массы произведение давления газа на его объём постоянно, если температура газа не меняется. Математическая запись закона выглядит так: Зависимость макроскопических параметров в различных осях выглядит следующим образом:
Легко заметить, что изотерме располагающейся выше в осях P,V соответствует большая абсолютная температура. ИЗОБАРНЫЙ ПРОЦЕСС - процесс изменения состояния термодинамической системы (газ) при постоянном давлении называют изобарным. В частом случае этого явления, когда масса газа не изменяется, получается газовый закон, носящий имя закона Гей-Люссака. Для газа данной массы отношение объёма к температуре постоянно, если давление газа не меняется. Математическая запись закона выглядит так: Зависимость макроскопических параметров в различных осях выглядит следующим образом:
ИЗОХОРНЫЙ ПРОЦЕСС - процесс изменения состояния термодинамической системы (газ) при постоянном объёме называют изохорным. В частом случае этого явления, когда масса газа не изменяется, получается газовый закон, носящий имя закона Шарля. Для газа данной массы отношение давления к температуре постоянно, если объём газа не меняется. Математическая запись закона выглядит так: Зависимость макроскопических параметров в различных осях выглядит следующим образом:
Нетрудно определить, что изохоре в осях P,T имеющей меньший угол наклона к оси температур соответствует больший объём[4]. Решение задач Задача1. Какое количество вещества содержится в газе, если при давлении 200кПа и температуре 240К его объем равен 40л? Дано СИ Решение Р=200кПа Т=240К поскольку в задаче идет речь о состоянии газа. V=40л
Ответ: 4 моль Задача 2. Газ при давлении 0,2МПа и температуре 150С имеет объем 5л. Чему равен объем этой массы газа при нормальных условиях? Дано СИ Решение
задаче речь идет о изменении макропараметров без изменении массы
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 94; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.15.15 (0.19 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
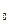 данного вещества к
данного вещества к  массы атома углерода m
массы атома углерода m 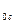 : Mr =
: Mr = 
 и называют постоянной Авогадро в честь итальянского учёного.
и называют постоянной Авогадро в честь итальянского учёного.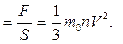

 [1]
[1]
 Дано СИ Решение
Дано СИ Решение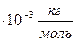
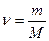
 моль
моль .
.  -? Ответ: 200 моль.
-? Ответ: 200 моль.
 Подставим
Подставим 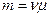 в первую формулу
в первую формулу  (Hg)=13.6·10
(Hg)=13.6·10  V=
V=  =1,5 ·10
=1,5 ·10  м
м 

 V-? Ответ: 1,5·10
V-? Ответ: 1,5·10 
 m (O
m (O 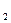 )=10 г. 0,01кг.
)=10 г. 0,01кг.  (1)
(1) 
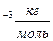 Выразим N; получаем
Выразим N; получаем 
 Na=6.02·10
Na=6.02·10  моль
моль 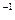 N=
N= 
 1,88·10
1,88·10 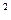 , нанесен слой меди толщиной 2 мкм. Сколько атомов меди содержится в покрытии?
, нанесен слой меди толщиной 2 мкм. Сколько атомов меди содержится в покрытии? Дано СИ Решение
Дано СИ Решение
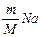

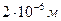 N= , но масса цинка не известна.
N= , но масса цинка не известна. 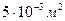 Найдём массу цинка через объём и плотность.
Найдём массу цинка через объём и плотность.
 , объём найдём, зная площадь поверхности
, объём найдём, зная площадь поверхности Подставим в начальную формулу
Подставим в начальную формулу N-?
N-? 
 молекул
молекул
 V=2л. 2*10
V=2л. 2*10  N=
N=  , масса воды неизвестна.
, масса воды неизвестна. Найдём массу воды через объём и плотность. m=
Найдём массу воды через объём и плотность. m= 


 N=
N= 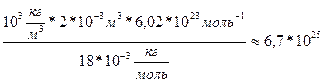

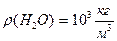


 m(H
m(H 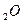 )=0.5 кг. N
)=0.5 кг. N 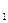 =
= 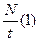 Чтобы найти число молекул, испаряющихся за
Чтобы найти число молекул, испаряющихся за с. 1сек. - N
с. 1сек. - N 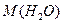 =18·10
=18·10 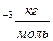 . N=
. N=  Подставим(2)
Подставим(2) 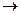 (1) и учтем время в секундах.
(1) и учтем время в секундах. N
N 


 S=20 км
S=20 км 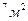 частиц соли N V=hS(1); N=
частиц соли N V=hS(1); N=  ; N
; N 
 Подставим (1) и (2) в (3)
Подставим (1) и (2) в (3) 
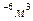
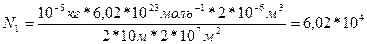
 N
N 
 Задача 8. Каково давление кислорода, если средняя квадратичная скорость его молекул 600
Задача 8. Каково давление кислорода, если средняя квадратичная скорость его молекул 600 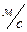 , а его плотность 1,54
, а его плотность 1,54 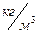 ?
? Дано СИ Решение
Дано СИ Решение
 Отразим на произведение m
Отразим на произведение m 

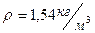
 Следовательно,
Следовательно, 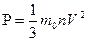
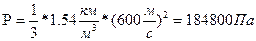 Ответ:1,848*10
Ответ:1,848*10 

 m=8кг
m=8кг 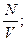
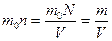 Следовательно,
Следовательно, 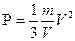
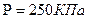 2,5*10
2,5*10  1. Умножим первую и правую части на 3V: 3РV=mV
1. Умножим первую и правую части на 3V: 3РV=mV 



 Дано CИ Решение
Дано CИ Решение
 3*10
3*10 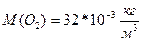 Для этого воспользуемся малярной массой кислорода
Для этого воспользуемся малярной массой кислорода  Na=6,02*10
Na=6,02*10 

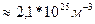
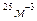 .
.
 Дано СИ Решение
Дано СИ Решение Eк
Eк 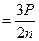 E
E 
 N=5*10
N=5*10 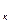 -? Ответ:9*10
-? Ответ:9*10 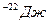


 [3]
[3] С и давлении 1,2 МПа.
С и давлении 1,2 МПа.
 Дано СИ Решение
Дано СИ Решение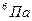 . Е
. Е 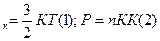 Выразим из (2)уравнения n => n =
Выразим из (2)уравнения n => n = 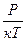
 Итак: Е
Итак: Е  и n =
и n =  Е
Е 

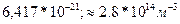
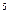 Па P=nКТ (1). Выразим Т из Уравнения (1): Т=
Па P=nКТ (1). Выразим Т из Уравнения (1): Т= 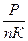

 N=1,5*10
N=1,5*10  724 К; V=
724 К; V=  (2)
(2) Масса молекулы водорода неизвестна. Найдем его,
Масса молекулы водорода неизвестна. Найдем его,
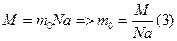 Подставим выражение (3) в
Подставим выражение (3) в  Т-? V-?.
Т-? V-?.
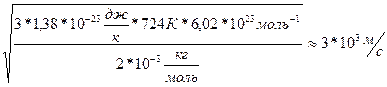


 V=700
V=700  (1). Выразим из уравнения(1)поэтапно
(1). Выразим из уравнения(1)поэтапно


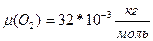 3.Разделим обе части на 3К: Т=
3.Разделим обе части на 3К: Т= 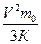
 , но мы не знаем m
, но мы не знаем m  Подставим (3) в (2), получим:
Подставим (3) в (2), получим: 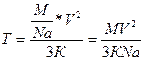 Т=
Т= 


 Т=t+273К; Т=110
Т=t+273К; Т=110  Выразим m
Выразим m  m
m 

 Ответ:
Ответ: 
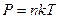 ,
,  ,
,  ,
,  →
→ 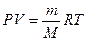
 ,
,  ,
, 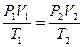








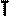

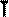
 ,
, 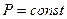


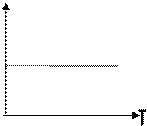

 Нетрудно определить, что изобаре в осях V,T имеющей меньший угол наклона к оси температур соответствует большее давление.
Нетрудно определить, что изобаре в осях V,T имеющей меньший угол наклона к оси температур соответствует большее давление. ,
, 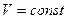



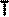

 Воспользуемся уравнением состояния идеального газа,
Воспользуемся уравнением состояния идеального газа,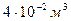
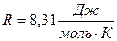

 , выразим
, выразим 


 Р=0,2МПа
Р=0,2МПа 


